碱性淀粉酶的发酵生产及其应用研究进展
杨海泉,刘龙,李江华,堵国成,陈坚
1 江南大学工业生物技术教育部重点实验室,江苏 无锡 214122
2 江南大学生物工程学院,江苏 无锡 214122
3 江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122
淀粉酶为作用于淀粉、糖原等α-1,4-葡聚糖,水解α-1,4-糖苷键的酶。根据酶水解产物异构类型的不同可分为α-淀粉酶 (EC3.2.1.1) 与β-淀粉酶 (EC3.2.1.2)。α-淀粉酶能水解淀粉分子内部α-1,4-葡萄糖苷键,水解产物为糊精、麦芽寡糖、麦芽糖和葡萄糖[1-2],在食品、纺织、医药和饲料等工业领域广泛应用[3-6]。β-淀粉酶是一种外切葡糖苷酶,从淀粉的非还原端开始裂解α-1,4-糖苷键,产物为麦芽糖和β-极限糊精,可应用于食品、酿酒等工业领域[7]。根据 pH稳定性不同,淀粉酶可以分为耐酸型、普通型和耐碱型3类。碱性淀粉酶在pH 9~11的碱性环境下具有高效催化活性和稳定性[8-10]。碱性淀粉酶在强碱性条件下水解淀粉的潜力,使其可以应用于淀粉加工、纺织退浆以及用于自动洗衣机的洗涤剂添加等工业领域[4-6,8]。添加碱性淀粉酶可有效除去餐具和衣物上的淀粉类污垢,提高纺织品印染质量,有着良好的实际应用效果和广阔的市场需求,相关研究也因此受到广泛重视[2,11]。日本学者Horikoshi在1971年首先报道了产自嗜碱芽胞杆菌A-40-2的碱性α-淀粉酶[12]。此后关于碱性淀粉酶的研究陆续报道,其中大多数研究主要集中在产碱性淀粉酶嗜碱微生物的筛选、培养及酶的分离纯化等方面[4,9,13-15]。近年来,对碱性淀粉酶的研究逐渐向重组表达以及酶分子改造等方面发展[4,6,16]。
1 碱性淀粉酶的特性
不同来源的碱性淀粉酶酶学性质和理化性质有一定差别,性质不同对其工业应用的影响也不同。工业生产中应根据具体需要,选用合适来源具有特定性质的酶。因此,碱性淀粉酶酶学性质的研究显得尤为重要。
1.1 酶对底物的作用特性
碱性淀粉酶和其他酶类一样,具有反应底物特异性。不同来源的碱性淀粉酶其反应底物也各不相同。碱性α-淀粉酶显示出对淀粉及其衍生物具有最高的特异性,这些淀粉及衍生物包括支链淀粉、直链淀粉、环糊精、糖原质和麦芽三糖等。吴襟等对来源于嗜碱芽胞杆菌的碱性 α-淀粉酶进行研究发现,该碱性淀粉酶对于各种来源的淀粉均有较好的水解效果,但对普鲁兰寡糖、右旋葡聚糖和环状糊精没有水解活性[2]。Li等分离筛选到一株嗜盐芽胞杆菌 Halobacillus sp. 菌株,所产β-淀粉酶在碱性条件下降解可溶性淀粉,产物主要为β-麦芽糖[7]。
1.2 耐碱性与耐热性
pH对酶活力影响较大,不同来源的碱性淀粉酶具有不同最适反应pH和稳定pH范围 (表1)。在最适pH条件下反应,可最大程度发挥酶活力,提高酶反应效率。在稳定pH范围内,碱性淀粉酶稳定性最强,减小了酶在贮存过程中的损失。在工业应用中,应确定反应和贮存的最佳条件,最大程度上提高碱性淀粉酶的使用效率和贮存稳定性。
温度对碱性淀粉酶酶活力及稳定性具有较大影响,来源于不同微生物的碱性淀粉酶的最适反应温度和稳定温度范围也不同 (表1)。在最适反应温度和稳定温度范围内,碱性淀粉酶的催化效率和稳定性最高。具有较高热稳定性的碱性淀粉酶在洗涤剂制造工业以及医药和分析化学等领域具有广泛的商业应用价值[14]。
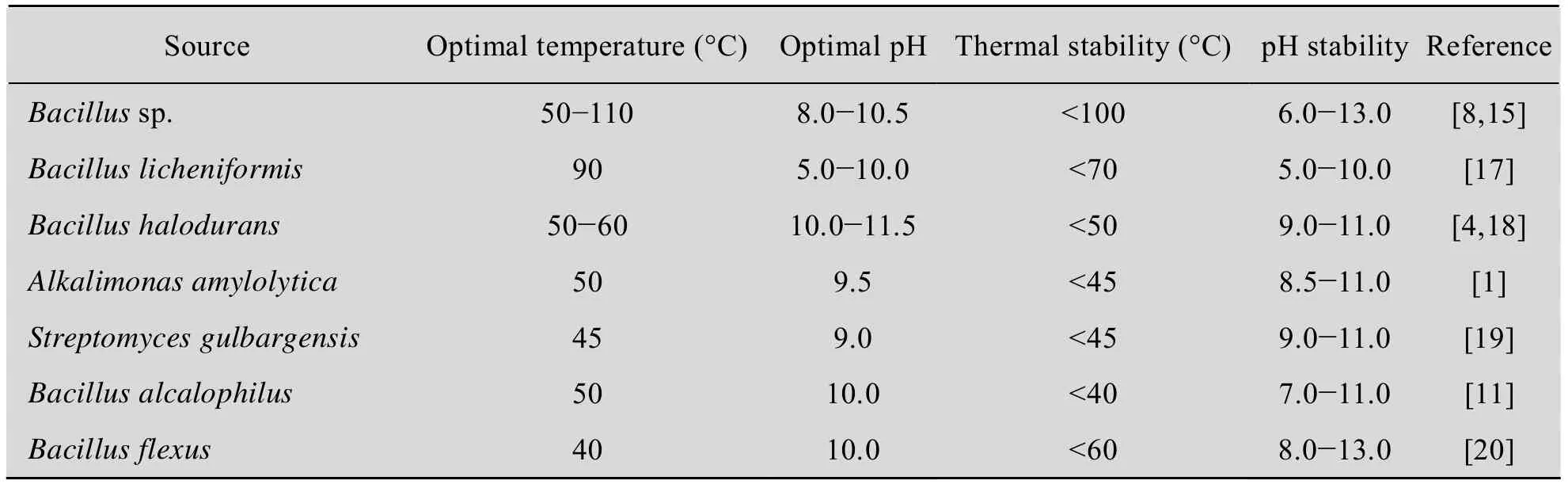
表1 碱性淀粉酶的耐碱性与耐热性Table 1 Alkali resistance and heat resistance of alkaline amylase
1.3 金属离子对酶活力的影响
碱性淀粉酶是金属酶,部分金属离子对酶有激活作用,但也有许多金属离子尤其是重金属离子对其有抑制作用。金属离子对酶的作用具有一定选择性,不同金属离子对不同来源的碱性淀粉酶的作用各不相同 (表2)。
1.4 理化特性
一些化学试剂对碱性淀粉酶活力具有一定影响,其中包括巯基、N-溴琥珀酸亚胺、p-羟基汞苯甲酸、碘乙酸、N,O-双 (三甲基硅烷基) 乙酰胺 (BSA)、乙二胺四乙酸 (EDTA)、乙二醇双 (2-氨基乙基醚) 四乙酸 (EGTA) 以及表面活性剂等[6,8,20]。不同来源的碱性淀粉酶对化学试剂敏感程度存在较大差异。Burhan等对来源于芽胞杆菌Bacillus sp. ANT-6的碱性淀粉酶进行研究发现,10 mmol/L EDTA、8 mol/L尿素及0.1% SDS对该碱性淀粉酶都有较强抑制作用[8]。吴襟等对来自嗜碱性芽胞杆菌的碱性淀粉酶进行研究发现,高浓度EDTA对其有部分抑制作用,而SDS对酶活影响不大[2]。Wang等对产自嗜碱菌Alkalimonas amylolytica的碱性淀粉酶进行研究发现,5 mmol/L EDTA对酶活性几乎没有影响[1]。Murakami等将来自嗜碱芽胞杆菌Bacillus halodurans MS-2-5的碱性淀粉酶在E. coli中进行表达后对其性质进行研究发现,重组碱性淀粉酶被EDTA抑制,而巯基试剂 (如 p-羟基汞苯甲酸 (PCMB) 和一碘代乙酸) 对酶活性没有明显抑制作用[6]。
2 碱性淀粉酶的生产
来源不同的碱性淀粉酶的产量存在较大差异。获得高产碱性淀粉酶菌株的主要方法包括:1) 筛选一株高效生产碱性淀粉酶的优良菌株;2) 利用传统方法对产酶菌株进行物理、化学诱变以及发酵过程优化等研究,提高酶产量;3) 通过分子生物学手段构建碱性淀粉酶重组生产菌株,实现酶的高效异源表达。
2.1 产酶微生物筛选
嗜碱微生物作为极端微生物,是一类仅能在碱性条件下 (pH 9.0~11.0) 生长的微生物总称,由于具有许多特殊性能,日益受到关注,其中对嗜碱芽胞杆菌研究最多[22]。Li等筛选获得一株生产碱性β-淀粉酶的Halobacillus sp. 菌株[7]。作者筛选获得一株生产碱性淀粉酶的嗜碱芽胞杆菌Bacillus alcalophilus JN21菌株[11]。
2.2 高产菌株选育
碱性淀粉酶生产菌株筛选是获得碱性淀粉酶的第一步,但初步筛选的产酶菌株产酶量相对较低。碱性淀粉酶高产菌株选育常采用传统紫外线 (UV)、Co-r射线、亚硝基胍 (NTG) 和硫酸二乙酯 (DES) 等方法。传统碱性淀粉酶生产菌株的选育存在正突变率较低、不利于选出优良产酶菌株等缺点。采用复合诱变方法可在一定程度上克服上述缺点,达到选育目的。刘建龙等采用复合诱变修复方法,将紫外线、亚硝基胍诱变处理与He-Ne激光辐照相结合,通过选择适宜的激光辐射剂量,正突变率明显提高,成功选育出一株优良的碱性淀粉酶生产菌株[23]。
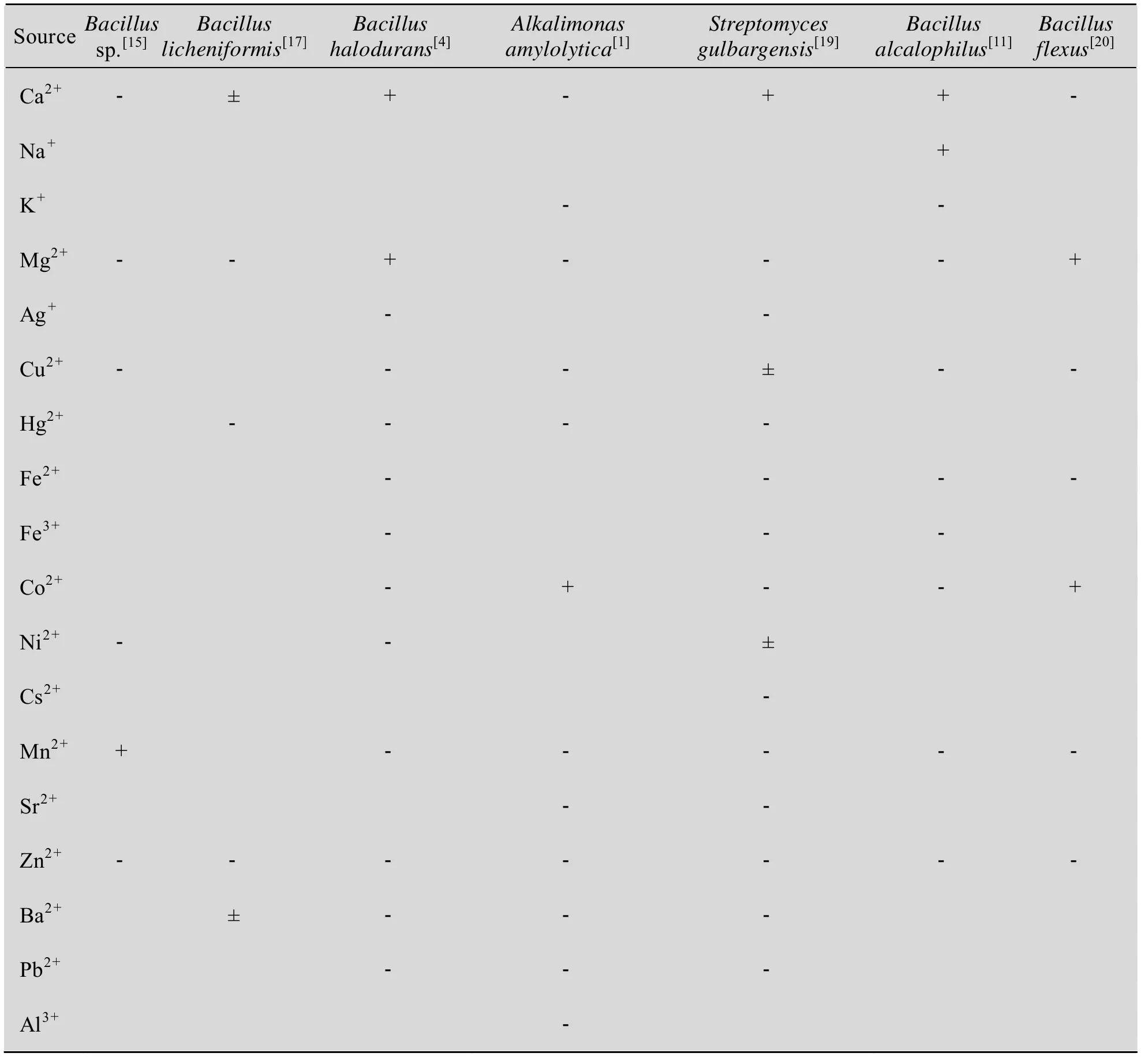
表2 金属离子对碱性淀粉酶酶活力的影响Table 2 Effects of metal ions on the activity of alkaline amylase
2.3 产酶重组菌的构建
野生型碱性淀粉酶生产菌株存在一定局限性,利用传统育种等手段,其产酶量较难得到实质性提高[11,13-14,19,23]。利用分子生物学手段对碱性淀粉酶进行高效异源表达是提高产量的一种有效方式[11]。Wang与Murakami等分别将来源于Alkalimonas amylolytica和B. halodurans的碱性淀粉酶基因序列成功在E. coli中进行表达,优化后碱性淀粉酶最高产量达52 U/mL[1,6]。作者将来源于B. alcalophilus的碱性淀粉酶基因序列成功在B. subtilis中进行高效表达,优化后碱性淀粉酶最高产量为441 U/mL,较野生菌提高了79倍[11]。
2.4 过程优化与分离纯化
为了进一步提高碱性淀粉酶生产菌株的产酶能力,需要进行过程优化与控制研究,包括培养基组成、发酵温度、pH、培养模式等。作者对产碱性淀粉酶重组枯草芽胞杆菌进行培养基优化,确定培养基成分为0.6%淀粉、1.45%蛋白胨、1.3%豆饼粉,碱性淀粉酶产量提高了4.5倍[11]。Pancha等对碱性淀粉酶生产菌株Bacillus sp. 进行培养基优化发现,添加乳糖、酵母粉和酪蛋白可显著提高酶的产量[15]。Saxena等对Bacillus sp. PN5的发酵温度和pH优化后发现,60 ℃时碱性淀粉酶产量较优化前提高2倍;发酵pH为10.0时产酶最高[13]。
高纯度碱性淀粉酶是一种重要的水解淀粉类酶制剂,可应用于酶反应机理和生化反应平衡常数等研究。碱性淀粉酶分离纯化方法很多,主要依据酶分子大小、形状、电荷性质、溶解度、稳定性、专一性结合位点等性质。高纯度碱性淀粉酶的获得,需要综合运用各种方法。盐析沉淀、凝胶过滤层析、离子交换层析、疏水作用层析、亲和层析和电泳等是碱性淀粉酶分离纯化的主要方法。吴襟等对来源于嗜碱芽胞杆菌alkaliphilic Bacillus sp. BG-CSN的碱性淀粉酶进行纯化,先后采用了硫酸铵盐析沉淀、Octyl-Sepharose CL-4B 疏水柱层析、DEAESepharose Fast Flow离子交换柱层析、DEAEToyopearl 650M 离子交换柱层析和 Sephadex G-100分子凝胶过滤柱层析等方法,纯化后比酶活提高了23倍[2]。Murakami等采用多种方法对重组表达碱性淀粉酶进行纯化,分别为:DEAE-cellulose柱、DEAE-Toyopearl 650 S柱、Phenyl-Toyopearl 650 M 柱、PAGE (Polyacry lamide gel electrophoresis) 柱等[4]。
3 碱性淀粉酶分子改造
碱性淀粉酶应用于纺织、洗涤剂等工业领域,对其酶学性质有不同的要求,主要包括抗氧化性和热稳定性。来源于野生菌株未经改造的碱性淀粉酶,在抗氧化性和热稳定性等方面存在一定局限性。针对以上局限性,利用蛋白质工程对酶进行修饰及分子改造可以达到提高抗氧化性和热稳定性的目的。碱性淀粉酶分子改造与修饰需要对其进行结构-功能关系、突变以及分子模型研究,这些研究的前提是进行各种与酶物理化学性质相关氨基酸残基的鉴定分析。
碱性淀粉酶抗氧化性是其应用于洗涤剂等行业的重要指标之一。半胱氨酸和甲硫氨酸是两种易氧化氨基酸。甲硫氨酸发生氧化后生成相应亚砜衍生物,导致碱性淀粉酶活性降低甚至失活。利用耐氧化氨基酸替代酶分子中甲硫氨酸,可以提高酶的抗氧化性。耐氧化氨基酸为较小且不含硫的氨基酸,例如亮氨酸、异亮氨酸、丙氨酸、丝氨酸和苏氨酸。Khemakhem等将碱性淀粉酶活性位点周围的甲硫氨酸 (Met197) 替换为丙氨酸,耐氧化性有极大提高[24]。
热稳定性提高对于碱性淀粉酶的应用具有重要意义。碱性淀粉酶热稳定性分子改造,首先需要对酶三维结构和相应氨基酸进行分析,确定关键位点和关键区域。针对关键位点及区域进行分子改造,改变酶分子不同位点、区域之间的相互作用,达到热稳定性提高的目的[25-27]。分子改造主要包括不同氨基酸替换突变、氨基酸敲除等。Ali等对碱性淀粉酶三维结构进行比对分析发现异亮氨酸 (Ile214) 和甘氨酸 (Gly215) 为影响酶热稳定性的关键位点。对这两个氨基酸残基进行敲除,敲除后碱性淀粉酶在100 ℃的半衰期由15 min提高至70 min[27]。
4 碱性淀粉酶的应用
碱性淀粉酶重要用途之一是应用于纺织退浆工业。传统纺织印染生产工艺污染严重,实行生态整理、绿色染整成为当务之急,生物酶退浆处理工艺应运而生。生物酶退浆具有显著优点:退浆率高、工艺条件温和、能耗低、对织物损伤小等[28]。酶退浆工艺因其绿色染整加工特性,在高档织物生产中居于重要地位[29]。生物酶退浆主要应用淀粉酶[30]。由于普通淀粉酶耐碱性能差,生物退浆和生物精炼工艺分开进行,存在工艺复杂、劳动强度大、生产效率低等缺点。在纺织物处理过程中,碱性淀粉酶的应用可使退浆与精炼两步处理工艺合为一步,实现一浴法。一浴法具有如下优点:更好的预洗涤效果、提高织物质量、较好的预处理效益、低污染、纤维表面效果提高等[31]。2005年Novozymes公司推出一种pH值范围为5~10的碱性淀粉酶,该碱性淀粉酶可替代普通淀粉酶,使退浆与生物精炼处理工艺合为一步成为可能。2008年Novozymes公司采用碱性淀粉酶与果胶酶对退浆与生物精炼一浴法进行实验,取得了较好结果,节省了能源且处理后纤维材质也有较大改变[10]。
碱性淀粉酶还可应用于加酶洗涤剂助剂。加酶洗涤剂具有增加洗涤效果、缩短洗涤时间、延长织物寿命等优点。加酶洗涤剂主要形式是利用多种碱性酶复配成复合型加酶洗涤剂,大大提高了洗涤效果,但对于碱性淀粉酶添加目前还处在初级阶段。Novozymes公司率先开发出添加洗涤剂型淀粉酶 Termanyl品种,该酶来源于地衣芽胞杆菌Bacillus licheniformis,在60 ℃、pH 9.0时,酶活力丧失60%以上,pH 10.0时仅有活力20%左右[22]。由此可见,尽管该酶已应用于洗涤剂,但在碱性条件下酶活力损失较大。
碱性淀粉酶其他应用领域为:与碱性纤维素共同作用,进行环境处理;在造纸工业中降低纸浆黏度;医药生产等[11]。随着酶工程技术及相关产业的快速发展,碱性淀粉酶应用范围将不断扩大。
5 发展前景
碱性淀粉酶作为一种重要工业用酶,逐步应用于洗涤剂添加和纺织退浆等领域,取得了一定使用效果。在提高效率、提高产品质量、节约资源和环境保护等方面都有着极其重要的作用。但由于前期主要研究工作集中在碱性淀粉酶生产菌种筛选以及酶学性质等方面,碱性淀粉酶产量以及部分酶学特性不能满足实际工业化生产、应用需要,这些局限性阻碍了碱性淀粉酶在工业生产中的应用进程。今后碱性淀粉酶研究前景主要集中在以下几个方面:碱性淀粉酶优良基因筛选及高效表达重组菌株构建;利用蛋白质工程等手段对碱性淀粉酶进行结构分析及分子改造,改良其酶学特性 (如抗氧化性、热稳定性等);通过发酵过程优化控制策略,实现碱性淀粉酶高效生产。
[1] Wang N, Zhang YH, Wang QH, et al. Gene cloning and characterization of a novel α-amylase from alkaliphilic Alkalimonas amylolytica. Biotechnol J, 2006, 1(11): 1258−1265.
[2] Wu J, Peng P, Shen W, et al. Purification and characterization of α-amylase from an alkaliphilic Bacillus sp. strain BG-CSN. Chin J Biochem Mol Biol, 2005, 21(6): 852−856.吴襟, 彭平, 沈文, 等. 嗜碱性芽孢杆菌碱性α淀粉酶的纯化和性质. 中国生物化学与分子生物学报, 2005, 21(6): 852−856.
[3] Malhotra R, Noorwez SM, Satyanarayana T. Production and partial characterization of thermostable and calcium-independent α-amylase of an extreme thermophile Bacillus thermooleovorans NP54. Lett Appl Microbiol, 2000, 31(5): 378−384.
[4] Murakami S, Nishimoto H, Toyama Y, et al. Purification and characterization of two alkaline, thermotolerant α-amylases from Bacillus halodurans 38C-2-1 and expression of the cloned gene in Escherichia coli. Biosci Biotechnol Biochem, 2007, 71(10): 2393−2401.
[5] Hashim SO, Delgado O, Hatti-Kaul R, et al. Starch hydrolysing Bacillus halodurans isolates from a Kenyan soda lake. Biotechnol Lett, 2004, 26(10): 823−828.
[6] Murakami S, Nagasaki K, Nishimoto H, et al. Purification and characterization of five alkaline, thermotolerant, and maltotetraose-producing α-amylases from Bacillus halodurans MS-2-5, and production of recombinant enzymes in Escherichia coli. Enzyme Microb Technol, 2008, 43(4/5): 321−328.
[7] Li X, Yu HY. Extracellular production of beta-amylase by a halophilic isolate, Halobacillus sp. LY9. J Ind Microbiol Biotechnol, 2011, 38(11): 1837−1843.
[8] Burhan A, Nisa U, Gökhan C, et al. Enzymatic properties of a novel thermostable, thermophilic, alkaline and chelator resistant amylase from an alkaliphilic Bacillus sp. isolate ANT-6. Process Biochem, 2003, 38(10): 1397−1403.
[9] Hagihara H, Igarashi K, Hayashi Y, et al. Novel α-amylase that is highly resistant to chelating reagents and chemical oxidants from the alkaliphilic Bacillus isolate KSM-K38. Appl Environ Microbiol, 2001, 67(4): 1744−1750.
[10] Kuilderd H, Wu G. Applied technologysimultaneous desizing and scouring with enzymes-simultaneous fabric desizing and scouring, using alkaline alpha-amylase and an alkaline scouring enzyme, reduces water. AATCC Rev-Am Assoc Text Chem Color, 2008, 8(6): 33−36.
[11] Yang HQ, Liu L, Li JH, et al. Heterologous expression, biochemical characterization, and overproduction of alkaline α-amylase from Bacillus alcalophilus in Bacillus subtilis. Microb Cell Fact, 2011, 10(1): 77.
[12] Horikoshi K. Production of alkaline enzymes by alkalophilic microorganisms. Agri Biol Chem, 1971, 35(11): 1783−1791.
[13] Saxena RK, Dutt K, Agarwal L, et al. A highly thermostable and alkaline amylase from a Bacillus sp. PN5. Bioresour Technol, 2007, 98(2): 260–265.
[14] Dastager GS, Li WJ, Agasar D, et al. Streptomyces gulbargensis sp. nov., isolated from soil in Karnataka, India. Antonie Van Leeuwenhoek, 2007, 91(2): 99−104.
[15] Pancha I, Jain D, Shrivastav A, et al. A thermoactive α-amylase from a Bacillus sp. isolated from CSMCRI salt farm. Int J Biol Macromol, 2010, 47(2): 288−291.
[16] Khemakhem B, Ali MB, Aghajari N, et al. Engineering of the α-amylase from Geobacillus stearothermophilus US100 for detergent incorporation. Biotechnol Bioeng, 2009, 102(2): 380−389.
[17] Hmidet N, Bayoudh A, Berrin JG, et al. Purification and biochemical characterization of a novel α-amylase from Bacillus licheniformis NH1: cloning, nucleotide sequence and expression of amyN gene in Escherichia coli. Process Biochem, 2008, 43(5): 499−510.
[18] Hashim SO, Delgado OD, Martínez MA, et al. Alkaline active maltohexaose-forming α-amylase from Bacillus halodurans LBK 34. Enzyme Microbial Technol, 2005, 36(1): 139−146.
[19] Syed DG, Agasar D, Pandey A. Production and partial purification of α-amylase from a novel isolate Streptomyces gulbargensis. J Ind Microbiol Biotechnol, 2009, 36(2): 189−194.
[20] Zhao J, Lan XJ, Su J, et al. Isolation and identification of an alkaliphilic Bacillus flexus XJU-3 and analysis of its alkaline amylase. Acta Microbiol Sin, 2008, 48(6): 750−756.
[21] Luo ZG, Yang JF, Luo FX. Properties and applications of α-amylase. Food Res Dev, 2007, 28(8): 163−167.罗志刚, 杨景峰, 罗发兴. α-淀粉酶的性质及应用. 食品研究与开发, 2007, 28(8): 163−167.
[22] Liu CL, Zhang WX, Yang R. Applying research and prospect of several special α-amylases. Sichuan Food Ferment, 2002, 38(4): 5−9.刘春莉, 张文学, 杨瑞. 特殊 α-淀粉酶的应用研究现状和前景展望. 四川食品与发酵, 2002, 38(4): 5−9.
[23] Liu JL, Liu JJ, Yang LS. Study on the breeding of alkaline amylase producing strain by UV and He-Ne laser compound mutation and the conditions for enzyme production. Laser J, 2005, 26(3): 83−84.刘建龙, 刘建军, 杨连生. 碱性淀粉酶菌株的紫外线和 He-Ne激光复合诱变及其产酶条件的研究.激光杂志, 2005, 26(3): 83−84.
[24] Khemakhem B, Ali MB, Aghajari N, et al. Engineering of the α-amylase from Geobacillus stearothermophilus US100 for detergent incorporation. Biotechnol Bioeng, 2009, 102(2): 380−389.
[25] Nielsen JE, Borchert TV. Protein engineering of bacterial α-amylases. Biochim Biophys Acta, 2000, 1543(2): 253−274.
[26] Declerck N, Machius M, Joyet P, et al. Engineering the thermostability of Bacillus licheniformis α-amylase. Biologia (Bratislava), 2002, 57(Suppl 11): 203−212.
[27] Ali MB, Khemakhem B, Robert X, et al. Thermostability enhancement and change in starch hydrolysis profile of the maltohexaose-forming amylase of Bacillus stearothermophilus US100 strain. Biochem J, 2006, 394(Pt 1): 51−56.
[28] Wang P, Wang Q, Fan XR, et al. evaluation of wetting property of cotton fabrics after enzyme pretreatment. Dye Finish, 2002, 28(12): 28−31.王平, 王强, 范雪荣, 等. 棉织物生物酶前处理润湿性评价. 印染, 2002, 28(12): 28−31.
[29] Pu ZY, Chen S, Lu T, et al. Study on thermo-stable amylase desizing for cotton fabric. Prog Text Sci Technol, 2006(1): 24−26.蒲宗耀, 陈松, 卢涛, 等. 耐碱耐温淀粉酶性能及退浆工艺试验研究. 纺织科技进展, 2006(1): 24−26.
[30] Zhao HJ, Liu ZJ, Wang PJ, et al. Application of enzyme OPT-260 in desizing. Dye Finish, 2003, 29(8): 12−14.赵海军, 刘志军, 王佩军, 等. 液体宽温退浆酶在前处理中的应用. 印染, 2003, 29(8): 12−14.
[31] Feng BB, Xu HY, Cai ZS. Steaming pretreatment with unsaturated steam for cotton fabric with enzymes. Dye Finish, 2004, 30(1): 7−14.冯碧波, 许海育, 蔡再生. 棉织物的生物酶退练一浴连续工艺探讨. 印染, 2004, 30(1): 7−14.

