遗传转化中诱导蓖麻子叶节分化适宜的PGR条件
王文跃 ,陈永胜 ,李国瑞 ,黄凤兰 ,尚雨丝 ,王 超 ,张智勇
(1.内蒙古民族大学,内蒙古 通辽 028000;2.内蒙古自治区高校蓖麻产业工程研究中心,内蒙古 通辽 028000)
蓖麻(Ricinus communis L.)属大戟科蓖麻属,是世界10大油料作物之一,对航天、航空、农业、医药、化工等行业都有突出的贡献[1-7]。
目前,国内外蓖麻优良品种较少、研究水平较低,随着科学技术的不断发展,基因工程技术对蓖麻新品种开发起到了积极的作用。Sujatha等[8]使用农杆菌介导法,首次获得基因组中整合了外源基因的蓖麻植株;Malathi等[9]用与Sujatha等相同的方法将CryI Ab基因转入蓖麻中,获得抗拟尺蠖的蓖麻转基因植株。国内外对蓖麻基因组的研究较多,黄凤兰等[10]构建了含有蓖麻毒蛋白A链基因的正义和反义重复表达载体,为获得低毒乃至无毒蓖麻奠定了基础;王亚等[11]通过ISSR扩增技术建立了适合单雌蓖麻的反应体系,为筛选单雌性状相关基因提供技术支持。
转基因蓖麻新品种获得需要一套完整的遗传转化体系,且蓖麻较其他植物缺乏植株再生能力和极低的增殖率而使其快繁体系建立困难重重。适当的PGR种类及浓度配比在植物生长中起着积极的作用,能够有效地加快蓖麻再生的效率。Sujatha等[12]发现,TDZ对丛生芽的形成有突出作用;张利明等[13]利用6-BA,有效地提高了外植体的芽增殖率;黄凤兰等[14]以ZT和NAA培养蓖麻子叶节,能有效地预防蓖麻子叶节玻璃化。
本研究在黄凤兰等[14]研究的基础上,以蓖麻子叶节为外植体,设置不同质量浓度的ZT和NAA,IAA,IBA处理农杆菌浸染的蓖麻子叶节,探索蓖麻子叶节再生最适发芽与生根的激素质量浓度,旨在建立蓖麻遗传转化中离体快繁体系。
1 材料和方法
1.1 试材与试剂
通蓖5号种子购于通辽市农业科学院;玉米素(ZT)、萘乙酸(NAA)、吲哚乙酸(IAA)、吲哚丁酸(IBA)、琼脂、乙酰丁香酮、卡那霉素均购于Sigma公司;蔗糖、无水乙醇、升汞、MS培养基均购于国内公司。
1.2 方法
1.2.1 诱导材料准备 根据黄凤兰等[10]的研究,取当年粒大、饱满的蓖麻种子经培养后,选淡黄色时期的子叶节预培养3 d,农杆菌浸染10min(不断地摇动农杆菌菌液),再接到原培养基进行共培养(一般为7 d)。
1.2.2 激素浓度筛选
1.2.2.1 诱导芽筛选
1.2.2.1.1 ZT和NAA不同质量浓度配比诱导芽筛选 设ZT质量浓度为0,1.0,2.0,4.0,6.0,8.0mg/L,NAA质量浓度为 0,0.05,0.10,0.15,0.20,0.25 mg/L,共36个处理,32颗材料,3次重复,记录30d时的生长状态。每升培养基:1/8 MS+蔗糖20g+琼脂10g+乙酰丁香酮5.00mg+卡那霉素2.50mg,pH值为5.6~5.8。以相同质量浓度配比诱导未进行农杆菌浸染的子叶节作为对照。
1.2.2.1.2 ZT和NAA低质量浓度配比诱导芽最适筛选 根据1.2.2.1.1结果设定ZT质量浓度为0,0.4,0.8,1.2,1.6,2.0,2.4 mg/L,NAA 质量浓度为 0,0.03 ,0.06,0.09,0.12,0.15 mg/L,共 42 个处理,40颗材料,3次重复,记录30d时的生长状态。每升筛选培养基:1/8 MS+蔗糖20g+琼脂10g+乙酰丁香酮5.00mg+卡那霉素2.50mg,pH值为5.6~5.8。
1.2.2.2 诱导根筛选
1.2.2.2.1 NAA不同质量浓度配比诱导根筛选
设 NAA的质量浓度为 0,0.05,0.10,0.15,0.20,0.25,0.30mg/L,共 7 个处理,30颗材料,3 次重复,记录30d时的生长状态。每升培养基:1/8 MS+蔗糖20g+琼脂10g,pH值为5.6~5.8。
1.2.2.2.2 NAA,IAA,IBA低质量浓度配比诱导根最适筛选 根据1.2.2.2.1结果设定NAA质量浓度为 0,0.02,0.04,0.06,0.08,0.10,0.12,0.14,0.16 mg/L。IAA,IBA的质量浓度梯度与NAA的质量浓度梯度相同,35颗材料,3次重复,记录30d时的生长状态。每升筛选培养基:1/8 MS+蔗糖20g+琼脂 10g,pH 值为 5.6~5.8。
2 结果与分析
2.1 诱导芽筛选结果
2.1.1 ZT和NAA不同质量浓度配比诱导芽的初筛选结果 由表1可知,ZT的质量浓度为0~2.0mg/L时的总芽诱导率明显高于其他质量浓度,所以,ZT的质量浓度为0~2 mg/L时适宜蓖麻子叶节发芽;NAA的质量浓度在0.15 mg/L以下时有助于芽诱导;农杆菌浸染的子叶节对卡那霉素有抗性,其生长状态明显要好于未浸染的子叶节。在此基础上需要进一步筛选,寻找更加适宜的蓖麻子叶节芽诱导的ZT与NAA质量浓度配比。
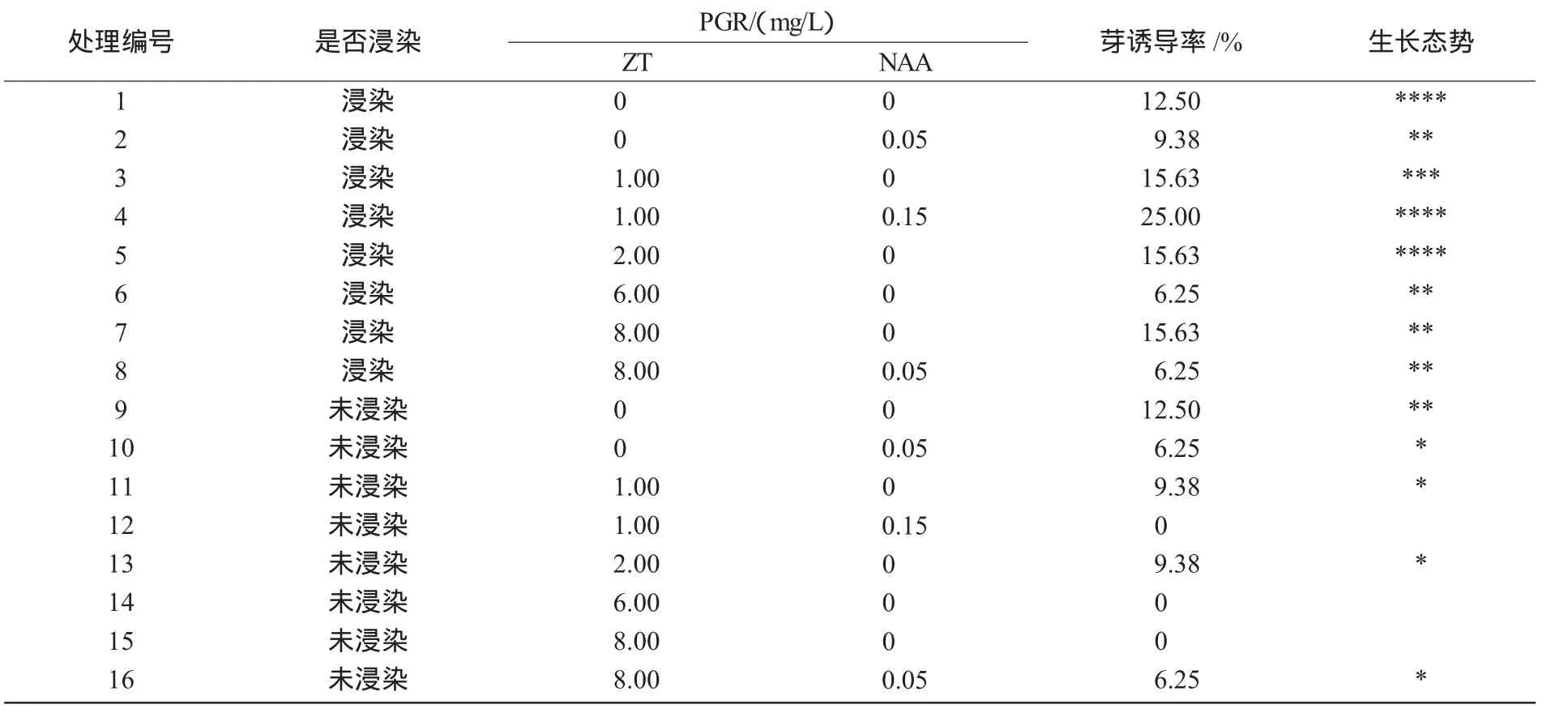
表1 ZT和NAA不同质量浓度配比诱导芽的初筛选
2.1.2 ZT和NAA低质量浓度配比诱导芽的最适筛选结果 从表2可以看出,与初筛选结果一致,不添加NAA比添加NAA芽诱导率要高出许多,在处理编号为 1,3,7,13,25,31 中的芽诱导率与生长状态都要好于其他处理,其中,处理编号为31的更为突出,故只添加ZT且质量浓度为2 mg/L时,最有利于蓖麻子叶节芽的诱导(图1-A)。
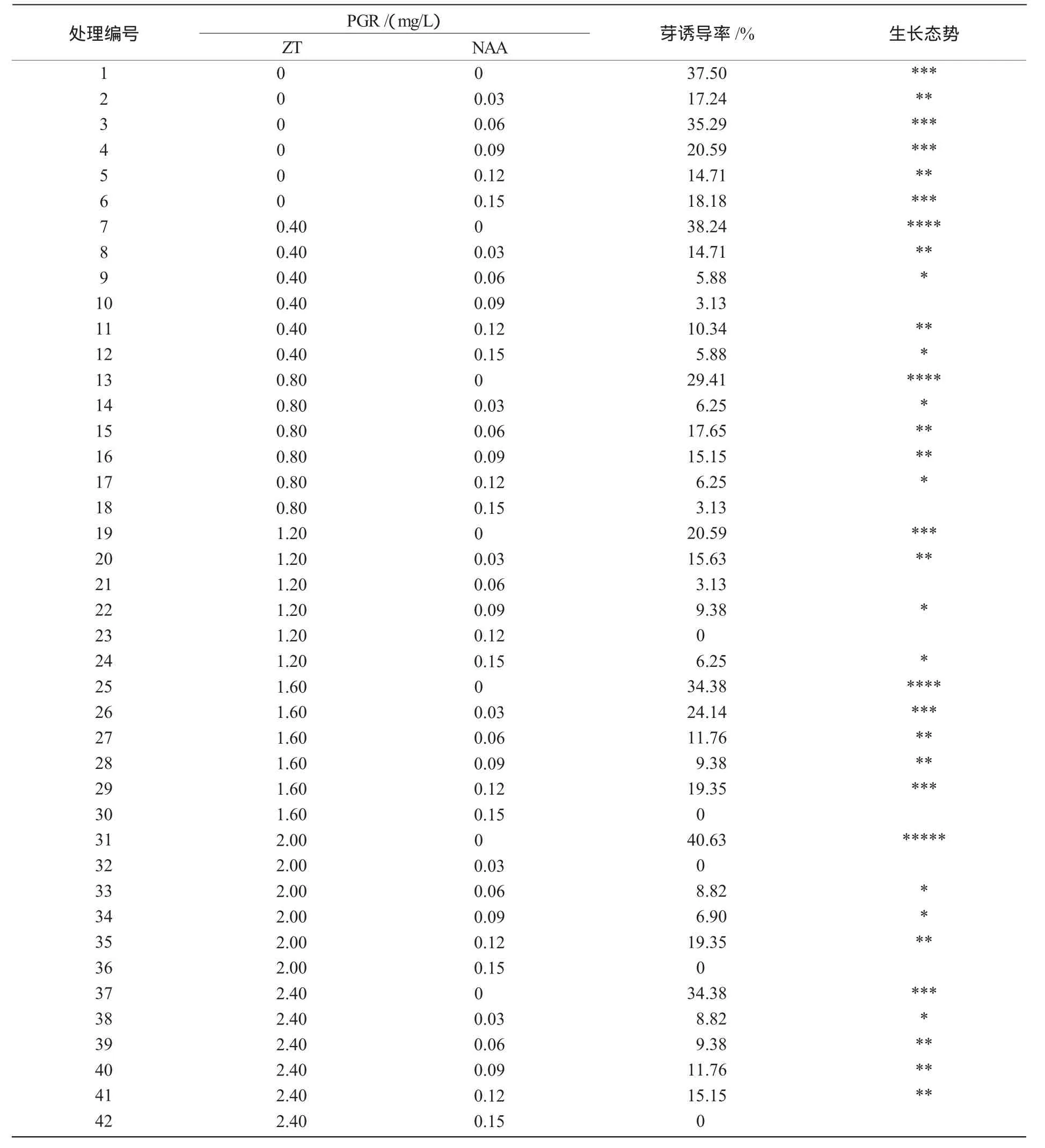
表2 ZT和NAA低质量浓度配比诱导芽的最适筛选
2.2 诱导根筛选结果
2.2.1 NAA不同质量浓度配比诱导根的初筛选结果 由表3可知,处理编号为1,3,4的根诱导率较高,且NAA质量浓度在0~0.15 mg/L时的总根诱导率较其他质量浓度高,且与未进行农杆菌浸染的子叶节处理相比,生长状态也较好,所以,低质量浓度的NAA有助于蓖麻子叶节的根诱导。但此时的根诱导率较低,应该筛选出更加适宜蓖麻子叶节诱导根的激素与激素质量浓度,以求得到更多的转化苗,提高蓖麻组织培养效率。2.2.2 NAA,IAA,IBA低质量浓度配比诱导根的最适筛选结果 NAA,IAA和IBA不同质量浓度组合最适筛选生根结果如表4所示。由表4可知,添加IBA的根诱导率要明显好于添加NAA或IAA,则IBA为最适根诱导PGR;当IBA质量浓度为0.10,0.16 mg/L时的根诱导率较高,且生长状态较好。但考虑到节省资源,则选IBA质量浓度为0.10mg/L时最适根诱导(图1-B)。

表3 NAA不同质量浓度配比诱导根的初筛选
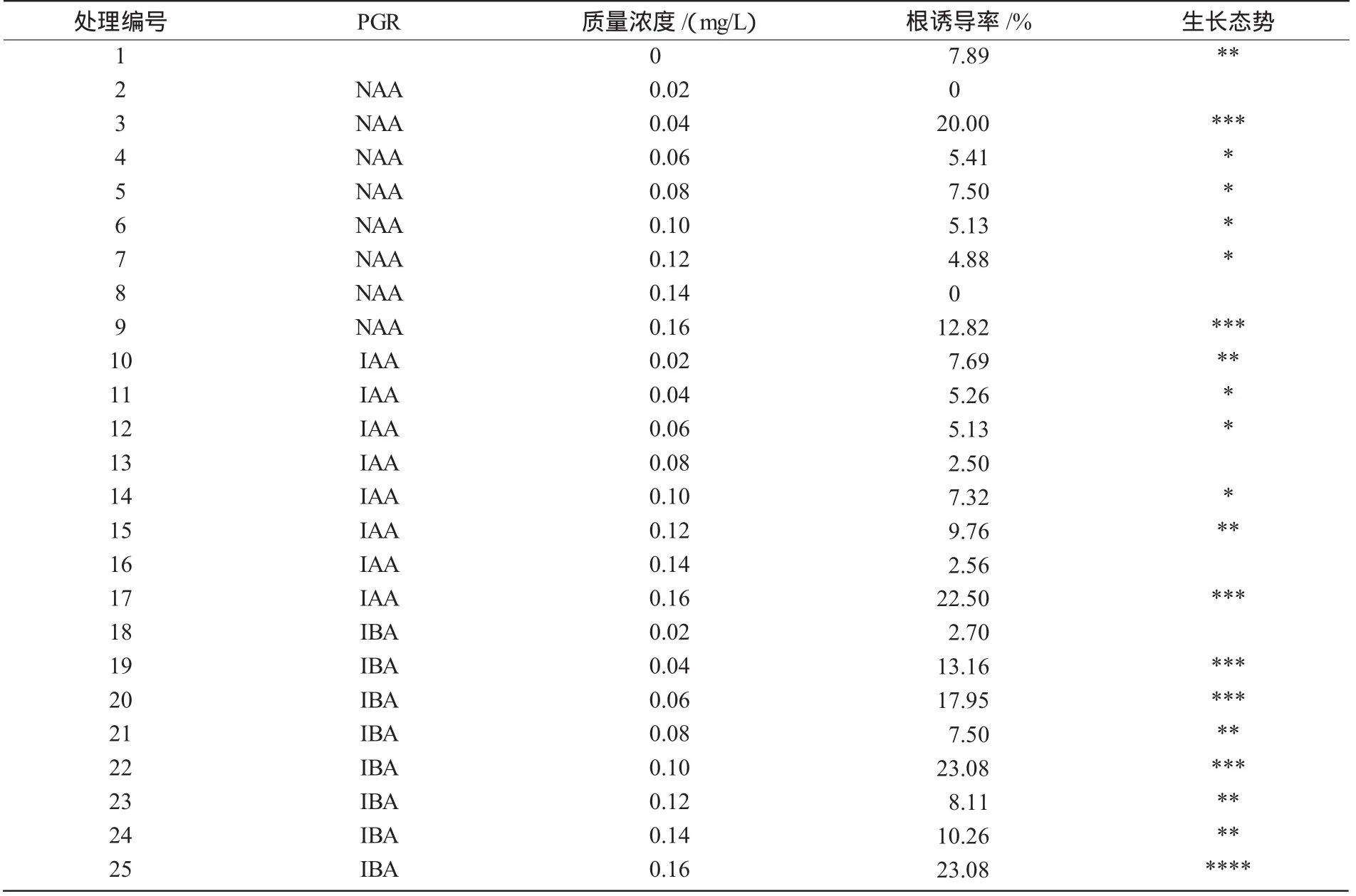
表4 NAA,IAA,IBA低质量浓度配比诱导根的最适筛选

3 结论与讨论
理想的遗传转化再生体系应该适合于各种基因型,这为蓖麻分子育种带来了契机。通过建立蓖麻高效遗传转化体系,可以有效地提高蓖麻再生的速率,进而缩短蓖麻培育新品种的年限。本试验在黄凤兰等[14]研究的基础上,对影响蓖麻子叶节再生过程中,芽和根诱导的最适PGR种类及其质量浓度进行了探索。结果表明,在只添加ZT且质量浓度为2 mg/L时最适芽的诱导;IBA为最适根诱导的PGR,其0.1 mg/L为蓖麻子叶节最适根诱导质量浓度。农杆菌浸染后的子叶节对卡那霉素具有抗性,这为子叶节再生后的筛选工作节省了工作时间。
本研究以蓖麻子叶节进行离体初代培养,有利于诱导新芽,并且芽是直接从外植体的芽点处萌发产生的,此培养途径有利于再生植株保持原母本的遗体性状。以蓖麻子叶节为外植体,诱导生根的关键优点在于,根系直接从皮层长出,其整个培养过程中不产生愈伤组织,这种根系便于从基质中吸收水分、养分,有利于再生苗的成活和生长,同时也加大了在转置土壤中的几率。本试验对适宜蓖麻组织培养中PGR的种类及质量浓度进行了探讨,为进一步深入研究提供参考。
[1]张爱琳,王玉荣,陈勉华.脱毒蓖麻饼粕饲喂小鼠安全性试验[J].黑龙江畜牧兽医,2010(1):85-86.
[2]Arslan G G,Eser I.An examination of the effect of castor oil packs on constipation in the elderly[J].Complement Ther Clin Pract,2011,17(1):58-62.
[3]何恒果.蓖麻提取液对菜青虫的生物活性研究[J].安徽农业科学,2010,38(15):7929-7930.
[4]Sampieri B R,Arnosti A,Nunes P H,et al.Ultrastructural changes in the ovary cells of engorged Rhipicephalus sanguineus female ticks treated with esters of ricinoleic acid from castor oil(Ricinus communis)[J].Microsc Res Tech,2012,75(5):683-690.
[5]Madhuri A,Nagaraju B,Harikrishna N,et al.Production of alkaline protease by bacillus alti-tudinis GVC11 using castor husk in solid-state fermentation [J].Appl Biochem Biotechnol,2012,167:1199-1207.
[6]Carmello J C,Fais L M,Ribeiro L N,et al.Diametral tensile strength and film thickness of an experimental dental luting agent derived from castor oil[J].J Appl Oral Sci,2012,20(1):16-20.
[7]张树军,狄建军,黄凤兰.以蓖麻酸(酯)为原料合成共轭亚油酸的研究进展 [J].内蒙古民族大学学报:自然科学版,2011(1):62-64.
[8]Sujatha M,Sailaja M.Stable genetic transformation of castor(Ricinus communis L.)via agrobacterium-mediated gene transfer using embryo axes from mature seeds[J].Plant Cell Reports,2005,23:803-810.
[9]Malathi B,Ramesh S,RaoK V,et al.Agrobacterium-mediated genetic transformation and production of semilooper resistant transgenenic castor (Ricinus communis L.)[J].Euphytica,2006,147:441-449.
[10]黄凤兰,李国瑞,陈永胜.蓖麻毒蛋白A链基因克隆与重复表达载体构建 [J].中国油料作物学报,2009,31(6):167-172.
[11]王亚,郭志强,王宏伟.单雌蓖麻ISSR-PCR反应体系的建立和优化[J].山西农业科学,2010,38(1):15-18.
[12]Sujatha M,ReddyT.Differential cytokinin effects on the stimulation of in vitro shoot proliferation from meristematic explants of castor (Ricinus communis L.)[J].Plant Cell Reports,1998,17:561-566.
[13]张利明,侯玲玲,李文彬.蓖麻组织培养和植株再生的研究[J].中国油料作物学报,2009,31(2):253-255.
[14]黄凤兰,孟凡娟,李国瑞.预防组培中蓖麻子叶节玻璃化的研究[J].中国油料作物学报,2010,32(1):139-143.

