基于毛细管液滴微阵列的分析检测
付广春 ,瞿祥猛
(厦门大学,a.物理与机电工程学院;b.萨本栋微米纳米技术研究院;福建 厦门 361005)
微阵列技术是一项进行核酸检测的有力工具,已被广泛应用于多个领域。不过微阵列的制作和核酸的杂交过程,均需昂贵的设备和较长的时间。在微流控芯片上进行微阵列分析,能够有效地克服这些不足,但是密度低,探针数目少,严重限制了基于微流控芯片的微阵列分析的应用。
微阵列技术广泛应用于核酸、细菌、结肠直肠癌等的检测及临床诊断[1]。从广义上讲,一切以微芯片为基础的生物分析过程,均可称为微阵列技术。
1 微芯片技术简介
微芯片,是近年来迅速发展的新技术,是一个跨学科的新领域,涉及生命科学、物理学、光学和微机电加工等技术。
根据结构特点和工作原理,可将微芯片分为微阵列芯片和微流控芯片两大类。
其中,微阵列芯片,也称基因芯片,相对发展较早,技术已经比较成熟,主要以生物技术为基础。在芯片表面,高密度地固定一系列可寻址的识别分子阵列,可以用来进行高通量的生物样品检测,获取大量的相关信息,其检测系统一般为高灵敏的荧光扫描系统[2~3]。
微流控芯片,主要是以微机电加工技术为依托,根据需要,可在玻璃、单晶硅、金属等材料基底上,刻蚀各种不同的微管道网络或设计各种开关、阀门等,在微小通道中进行生物样品的反应、分离、提纯等实验。
二者在核酸的检测方面,都发挥了很大的作用,是核酸检测一个非常重要的平台。但是,微阵列的制作和核酸的杂交过程,均需昂贵的设备和较长的时间[6],而基于微流控芯片的微阵列分析,由于密度低、探针数目少等,严重限制了其广泛的应用。
针对以上缺点,本研究提出了一种基于毛细管的微阵列分析技术为基础的核酸检测方法:将不同的探针通过自动进样系统引入到毛细管中[7],沿毛细管形成有机相间隔的一维液滴阵列,液滴中的探针,固定到毛细管的内壁上之后,将样品引入到毛细管中,并与探针阵列进行杂交反应,然后进行杂交检测。
通过实验表明,本方法能够显著减少制作成本,有效缩短分析时间,并降低对昂贵设备的依赖,为核酸检测提供了一个方便快捷的新方法。
2 试验方案原理
如1所示,为液滴阵列形成的装置图。

图1 在毛细管内形成液滴阵列的装置示意图
在CD形的圆片上,装有末端开口的小试管,由步进电机驱动做圆周转动。毛细管通过小试管的末端开口,插入到溶液内,毛细管的另一端,与一微量注射泵相连,将小试管内的溶液依次引入到毛细管中。
末端开口的小试管间隔,装有探针溶液和有机相载流,引入到毛细管内就形成了有机相间隔的探针液滴阵列。毛细管预先进行过醛基化处理,液滴内的探针分子会扩散并被固定到毛细管内壁上。经过清洗和还原后,将荧光标记的核酸样品引入到毛细管内,样品分子与探针阵列进行杂交反应。反应完成后,使用荧光扫描仪对毛细管进行扫描,并收集荧光信号进行分析。
3 不同有机相对探针固定的影响分析
本试验中,将不同种类的探针阵列固定于毛细管以及减少探针之间的交叉污染,是一项很重要的内容。因此,选取合适的载体,来实现探针之间的间隔,显得尤为重要。我们根据荧光信号背景强度、扩散速率、溶液粘性等因素,考察分析了3种有机相,试验数据如下:
靶控输注系统(target control infusion, TCI)采用药代动力学模型来控制全身麻醉期间镇静药和阿片类药物的血浆或效应部位浓度[1]。在成人中,最广泛使用的药代动力学模型由Marsh等和Schnider等开发;这些模型在健康的非孕人群中的使用已较为成熟,但是否适用于产妇目前尚不清楚[2]。
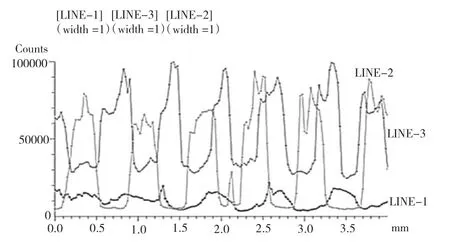
图2 不同浓度探针与样品在毛细管内杂交后的荧光信号强度图LINE-1为丁醇间隔;LINE-2为戊醇间隔;LINE-3为己醇间隔
图 2 为 5 μM(物质的量浓度 1 μM=1 μmol/L)浓度AD探针在200 μm内径的毛细管内用不同的有机相进行间隔固定一夜,然后用100 nM(物质的量浓度,1 nM=1 nmol/L)的D’Cy3样品进行杂交的荧光信号强度图。
LINE-1为丁醇间隔;
LINE-2为戊醇间隔;
LINE-3为己醇间隔。
结果表明:戊醇背景信号比己醇低,荧光信号比丁醇的高。丁醇因探针溶液随着时间的延长与丁醇相互扩散,从而荧光信号弱。与己醇相比,丁醇和戊醇粘性较大,在进行探针清洗后,有部分的己醇附着在毛细管内壁,而进行样品杂交后,附着在毛细管内壁上的己醇吸附部分带荧光的样品,使背景信号增强。
有机相在水中的溶解度越小,越不易使毛细管中液体发生相对移动,越有利于探针的固定。而丁醇在水中溶解度较大,达7.7%,戊醇、己醇相对较小,分别为1.7%与0.6%。综合考虑,选择戊醇作为间隔相。
4 结果分析与讨论
实验分别使用了两种不同的探针(AB和AD)和Cy3标记的核酸样品(B’Cy3和D’Cy3),其中AB(AD)分别与 B’Cy3(D’Cy3)所包含的碱基序列互补配对。碱基序列如下:
探针 AD:5'-NH2-(CH2)6-CGC CGA TTG GAC AAA ACT TAA A-3';
AB:5'-NH2-(CH2)6-CGC CAG AGA ATA CCA AAA CTC-3'。
核酸样品 B’Cy3:5'-Cy3-GAG TTT TGG TAT TCT CTG GCG-3';
Oligo sample D'Cy3:5'-Cy3-T TTA AGT TTT GTC CAA TCG GCG-3'。
将探针(AD)沿毛细管固定在毛细管内壁上,形成间隔的探针阵列后,在合适的温度下,将样品(D’Cy3)引入到毛细管中与一维的探针阵列杂交5 min。荧光扫描结果如图3(A)中的小图所示,沿毛细管方向黑色的矩形方块被灰色的背景间隔,其中黑色方块是杂交斑点,灰色的区域为背景(即固定时有机相载流所处的位置)。
沿着红线得到的连续4个杂交斑点的荧光强度如图 3(A)所示。在图 3(B)中,25 μM 的 AB 与 AD被引入到毛细管内并形成探针阵列,然后分别与不同浓度的样品进行杂交反应。可以看到,所得到的荧光信号随着样品浓度的增加而增强,样品的检测限达到10 pM(物质的量浓度,1 pM=1 pmol/L)。

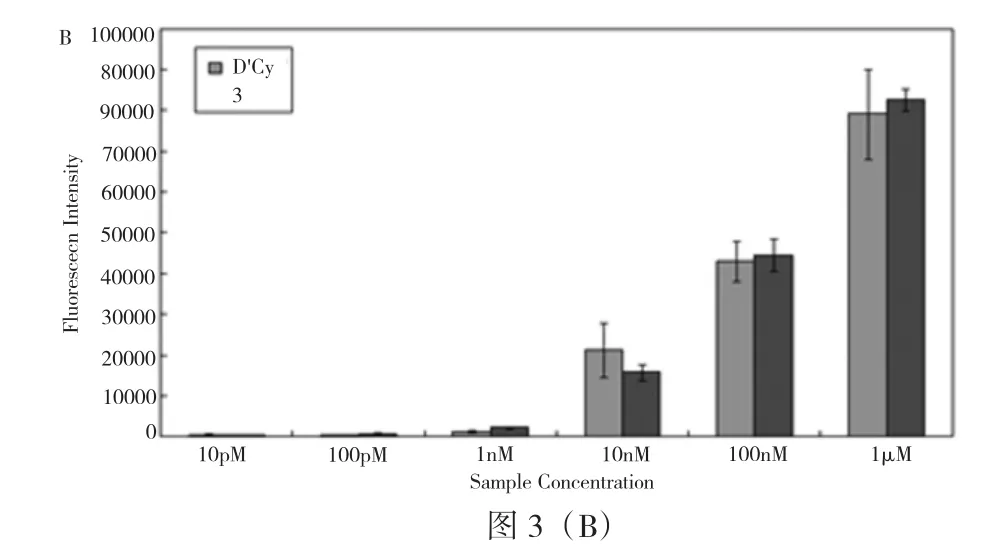
图3 探针阵列与样品杂交后的荧光信号效果
图3 (A)为固定在毛细管壁的探针阵列与荧光标记的样品杂交后,所得的荧光扫描结果(小图)和沿着红线的荧光强度变化(大图);
图3(B)为25 μM的探针探针阵列与不同浓度的样品杂交后所得的荧光信号强度。
试验表明,检测一个样品只需较短的时间(不到10 min),并且在毛细管密闭的环境中进行探针的固定和核酸的杂交,能够提供一致的反应条件,并有效排除外界的干扰和污染,实现稳定和一致的杂交。
5 结束语
本文提出了一种在毛细管内形成液滴阵列的方法,通过制作探针阵列,以进行核酸检测。这一方法,能够有效降低微阵列的制作和分析成本,实现快速和高灵敏度的检测,不仅能用于核酸检测,也能用于其他分析,如多肽、蛋白质、免疫、药物以及细胞等,有着广泛的潜在应用前景。
[1]Hashimoto,M.,Barany,F.,Soper,S.A.Polymerase chain reaction/ligase detection reaction/hybridization assays using flowthrough microfluidic devices for the detection of low-abundant DNA point mutations[J]Biosens.Bioelectron.2006,(21):1915-1923.
[2]邢婉丽,程 京.生物芯片技术[M].北京:清华大学出版社,2004.
[3]马立人,蒋中华.生物芯片(第二版)[M].北京:化学工业出版社,2002.
[4]林炳承,秦建华.微流控芯片实验室[M].北京:科学出版社,2006.
[5]Manz A,Graber N,Widmer H M.Miniaturized Total Chemical Analysis Systems:A novel Concept for Chemical[J].Sensing.Sensors and Actuators B:Chemical,1990,1(1-6):244-248.
[6]C.A.Koch,P.C.H.Li,R.S.Utkhede.Evaluation of thin films of agarose on glass for hybridization of DNA to identify plant pathogens with microarray technology[J].Anal.Biochem.,2005,(342):93-102.
[7]Du Wen-Bin,Sun Meng,Fang Qun,et al.Automated Microfluidic Screening Assay Platform Based on Drop Lab[J].Anal.Chem.,2010,(82):9941-9947.

