奥美拉唑的安全性评价及风险管理
张 婷,梁 伟,刘 芳(1.北京大学第三医院药剂科,北京 100191;.北京市药品不良反应监测中心,北京 10004)
奥美拉唑(omeprazole)是一种用于治疗消化性溃疡和胃食管反流病(GERD)等疾病的质子泵抑制剂,它选择性抑制胃壁细胞H+-K+-ATP酶,从而对各种刺激因素(组胺、乙酰胆碱、胃泌素等)引起的胃酸分泌都可产生强大的剂量依赖性抑制作用。奥美拉唑是国际上应用最广泛的处方药之一,并在部分国家已经作为非处方药使用。1979年由瑞典Astra(即现阿斯利康公司)的Ylva Ortengren初次合成,1983年发现其疗效,1987年上市,并于1989年通过美国食品药品管理局(FDA)批准首次在美国上市,商品名为Losec/Prilosec(洛赛克)[1],1991年在我国开始使用。
目前在我国市场上销售使用的奥美拉唑主要有肠溶片剂、肠溶胶囊、注射用冻干粉针制剂等剂型。除了其原研药品生产厂家阿斯利康之外,现有20多家企业生产仿制药。不同生产厂家药品说明书存在一定差异,同时,由于其使用广泛且不良反应较为明确,在临床中如何规范、安全使用该药品是值得医务人员关注并探讨的问题。本文从国内外药品说明书对比分析着手,通过查阅相关文献,分析奥美拉唑的药品不良反应(adverse drug reaction,ADR)和配伍禁忌的个案报道,最终制定风险管理策略,实现奥美拉唑的合理应用。
1 国内外奥美拉唑药品说明书对比分析
1.1 奥美拉唑药品说明书中标示的适应证
对比国内外奥美拉唑药品说明书发现,原研药品说明书中适应证的各种疾病及其病因描述详细准确。在美国和中国,奥美拉唑批准的适应证存在差异。
美国奥美拉唑(洛赛克)口服剂型批准适应证为主要用于治疗十二指肠溃疡、胃溃疡和反流性食管炎:与抗菌药物联合用药,治疗感染幽门螺杆菌的十二指肠溃疡;治疗非甾体抗炎药相关的消化性溃疡和胃十二指肠糜烂;预防非甾体抗炎药引起的消化性溃疡、胃十二指肠糜烂或消化不良症状;亦用于慢性复发性消化性溃疡和反流性食管炎的维持治疗;用于胃-食管反流病的烧心感和反流的对症治疗;用于卓-艾综合征的治疗。与之相比较,国产仿制药品的说明书内容较为简单和概括,且部分仿制药品的说明书批准适应证少于原研产品,如仅标注适用于胃溃疡、十二指肠溃疡、应激性溃疡、反流性食管炎和卓-艾综合征(胃泌素瘤),或用于胃酸过多引起的烧心和反酸症状的短期缓解。
而FDA批准的奥美拉唑(洛赛克)适应证人群包括了儿童,其适应证为治疗成人十二指肠溃疡和胃溃疡;治疗成人和儿童GERD和维持糜烂性食管炎愈合;但在<1岁的儿科患者应用中其安全性和效力尚未确定。
在奥美拉唑注射剂型方面,其适应证随厂家不同存在较大差异,国产仿制药适应证最少的为2种,而原研药适应证达5种。
由此可见,在使用奥美拉唑的过程中,应关注所用产品的生产厂家,不同厂家药品的适应证存在一些差异,为避免出现超说明书批准的适应证使用药品的情况,医师处方前应关注生产厂家及药品说明书,不能一概而论。
1.2 不同厂家口服剂型奥美拉唑说明书比较
对比不同厂家口服剂型奥美拉唑说明书发现,在药品性状描述、用法与用量、特殊人群用药等方面存在明显差异。在妊娠哺乳期用药、用药注意事项方面,不同厂家说明书之间差异不大,重要信息均有所体现;但是在药品性状描述、不良反应、肝肾功能不全患者和老年人群特殊用药方面,存在较明显差异,国产仿制药说明书信息有待完善;同时,在用法与用量方面,原研药说明书具体细致,这有助于医务人员开展治疗工作,但是由于其信息过多且繁杂,不利于患者自行阅读说明书理解,因此有必要通过采取信息设计等手段完善患者教育相关内容,见表1。

表1 不同厂家口服剂型奥美拉唑说明书对比情况Tab 1 Comparison among the package inserts of oral omeprazole from different manufacturers
1.3 不同厂家注射剂型奥美拉唑说明书比较
对比不同厂家注射剂型奥美拉唑说明书,重点关注与注射给药方式相关的信息。溶剂选择均为0.9%氯化钠注射液或5%葡萄糖注射液100 mL,但在是否配备专用溶剂、配置后稳定时间以及配伍禁忌方面,不同厂家说明书存在较大差异。对于配置后溶液稳定时间,不同厂家奥美拉唑存在较明显差异,因此临床使用中应关注药品生产厂家,并尽可能做到现配先用;对于部分厂家未提及配伍禁忌情况时,分析其可能未进行相关研究,因此仍应严格避免与其他药物混合使用的情况出现,见表2。
2 奥美拉唑的ADR监测情况
2.1 奥美拉唑(洛赛克)临床试验中观察到的ADR
来自全世界各地的3 096例(465例来自美国的研究,2 631例来自国际研究)[2]的奥美拉唑缓释胶囊临床试验中,最常见的ADR报告(即单一症状发病率≥2%)包括头痛(6.9%)、腹痛(5.2%)、恶心(4.0%)、腹泻(3.7%)、呕吐(3.2%)和胀气(2.7%);其他ADR发生率≥1%的包括酸反流(1.9%)、上呼吸道感染(1.9%)、便秘(1.5%)、头晕(1.5%)、皮疹(1.5%)、乏力(1.3%)、背部疼痛(1.1%)以及咳嗽(1.1%)。临床试验中>65岁患者的安全资料与65岁或以下的患者相似,在儿童患者服用奥美拉唑缓释胶囊的临床试验的安全性与成人患者是相似的。然而,儿童患者特有的不良反应报道为呼吸系统不良反应,同时在1至<2和2~16岁年龄组(分别为75.0%和18.5%)发生;同样,发热还经常在1~2岁年龄组(33.0%)中发生,意外伤害在2~16岁年龄组(3.8%)中有报道。与单独使用奥美拉唑相比,在与其他药物联合使用的疗法中,未见到观察到新的ADR;奥美拉唑的ADR多为轻度,集中在中枢神经系统和消化系统,见表3。

表2 不同厂家注射剂型奥美拉唑说明书对比情况Tab 2 Comparison among the package inserts of omeprazole for injection from different manufacturers
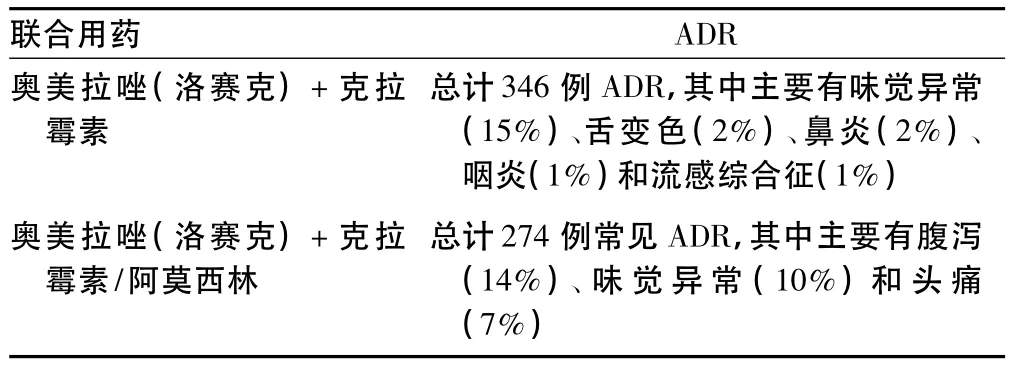
表3 奥美拉唑不同联合用药致ADR情况Tab 3 Adverse reactions induced by drug combination of omeprazole
2.2 奥美拉唑药品说明书中标示的ADR
查阅不同厂家奥美拉唑说明书发现其ADR通常是轻微和可逆的,与剂量无关,具体ADR及发生频率见表4。其中原研奥美拉唑说明书中所标示的ADR种类和仿制药说明书所标示的几乎相同,只是种类略多于国内,而且把ADR按照发生率分为常见、偶见和罕见3大类。
2.3 奥美拉唑国内ADR监测情况
2.3.1 资料来源:检索《中国期刊全文数据库》,时间为1991—2011年,为避免遗漏,采用篇名检索“奥美拉唑”,共检索出2 899篇文献,通过阅读题目和摘要除外基础研究和疗效研究以及重复文献后,选择国内ADR的个案报道103篇。对收集到的有关奥美拉唑ADR文献中的病例进行统计分析,共178例,统计分析ADR出现的时间、类型、累及器官和(或)系统、临床表现。
2.3.2 出现不良反应的时间:178例ADR报告中,首次用药即出现者23例(占12.9%);最快为首次用药后2 min即出现ADR[3]。

表4 奥美拉唑说明书中标示的情况Tab 4 Labeling of adverse reactions in package inserts of omeprazole
2.3.3 ADR的类型分布和临床表现:分析ADR发生的给药途径发现,除了2例联合静脉和口服给药,以及19例给药途径描述不详外,在剩余的157例中,静脉用药38例,占24.2%。在静脉用药发生的ADR中,又以过敏性休克和血液系统白细胞计数减少为主。奥美拉唑致ADR发生的类型、累及器官和(或)系统及主要临床表现见表5,从表中可知,血液系统ADR居首位,有48例,占26.97%,主要为白细胞计数减少;其次为过敏反应,有35例,占19.66%。
3 奥美拉唑的配伍禁忌
3.1 资料来源
检索《中国期刊全文数据库》,时间为1991—2011年,采用篇名检索,检索词为“奥美拉唑”、“洛赛克”和“配伍”。共检索出71篇文献,剔除4篇奥美拉唑治疗效果评价文献以及1篇药物相互作用文献。在剩余的66篇参考文献中,其中综述或总结型文献2篇;与奥美拉唑相关的配伍禁忌个案报道41篇,其中23篇文献对出现配伍禁忌的情况进行了验证实验;另外23篇文献为实验性研究,通过体外实验发现与奥美拉唑相关的配伍问题。

表5 奥美拉唑致ADR累及器官和(或)系统及临床表现Tab 5 Organs and(or)systems involved in the adverse reaction of omeprazole and its clinical presentation
3.2 与奥美拉唑存在配伍禁忌的药物
相关研究针对奥美拉唑的体外配伍情况进行了分析,同时结合个案报道,总结与奥美拉唑存在配伍禁忌的药物,见表6。侯晓青等[4]对奥美拉唑与9种常用注射剂的研究中分析了奥美拉唑与注射用甘草酸二铵(甘利欣)、参麦注射液、生脉注射液、利巴韦林注射液、清开灵注射液、注射用乙酰谷酰胺、注射用阿糖胞苷、注射用生长素、华蟾素注射液体外配伍稳定性,结果显示稳定性较好,但是由于该研究报道中未提及对溶液的外观观察情况,因此有待通过进一步分析确定其配伍的合理性。

表6 与奥美拉唑存在配伍禁忌的药品Tab 6 Drugs with incompatibility with omeprazole
3.3 奥美拉唑出现配伍禁忌情况的分析
在38例奥美拉唑相关的配伍禁忌个案报道中,对药品调配和给药方法进行分析,结果见图1,其中由于前后2组输液接续输注产生输液管内或莫菲管内的变色或浑浊现象占据比例最高,达58.54%。

图1 配伍禁忌情况分析图Fig 1 Analysis chart of compatibility
3.4 奥美拉唑的配置溶剂选择
多项研究均表明pH值对奥美拉唑钠溶液稳定性影响很大。尽管奥美拉唑的说明书中注明可选择0.9%氯化钠注射液或5%葡萄糖注射液,但陈玫红等[5]的研究结果显示5%葡萄糖注射液配伍3 h后溶液呈微黄色,5 h后呈淡黄色。10%葡萄糖注射液、葡萄糖氯化钠注射液、果糖注射液、复方氨基酸注射液均与奥美拉唑存在配伍禁忌,临床应用时不宜选为奥美拉唑的溶剂。在溶剂的体积方面,若选用250或500 mL的溶剂,由于液体容量增大,导致pH值降低,使药物与溶剂配伍稳定性变差,因此,临床上一般宜选用100 mL的溶剂与之配伍[6]。同时溶解该药时也不可与其他注射液共用注射器[7],并应严格按照使用说明操作,以避免出现重溶药液变质、降效。
4 奥美拉唑的风险管理建议
4.1 严格把握适应证
由于不同厂家不同剂型的奥美拉唑适应证存在明显差异,因此临床使用过程中,应严格把握适应证,避免超适应证用药情况出现。
4.2 关注特殊人群用药
由于大多数仿制药奥美拉唑说明书中对于特殊人群用药的描述较为含糊,即便是原研奥美拉唑,其中文说明书中的叙述也较为简单,因此在特殊人群,尤其是肝肾功能不全患者、妊娠期和哺乳期妇女以及儿童应用时,应在权衡利弊并有积极的证据支持的情况下使用。
奥美拉唑主要经CYP2C19代谢,由于CYP2C19具有基因多态性,因此不同基因型人群其奥美拉唑的药动学和药效学存在差异,针对中国人的研究亦显示CYP2C19基因多态性对奥美拉唑在中国人体内的药物动力学和药效学有明显影响[8,9]。
与此同时,FDA于2009年发出警告,奥美拉唑可通过抑制CYP2C19酶而降低氯吡格雷活性代谢物水平,从而导致氯吡格雷的活性降低[10]。因此,在临床中应充分考虑药物相互作用的潜在不良影响。
4.3 不良反应的监测
奥美拉唑的不良反应多较缓和,多数情况可自行缓解或经治疗后缓解。对于部分严重不良反应如过敏性休克,分析其多为静脉给药时出现,因此在首次给予奥美拉唑静脉用药时应密切关注患者情况,及时处置。对于少数罕见但严重的不良反应,如间质性肾炎,其往往出现在治疗后的2周至6个月,因此对于需长期服用奥美拉唑的患者,应定期监测肾功能。
4.4 静脉用药
推荐注射用奥美拉唑的溶剂选择为0.9%氯化钠注射液100 mL,同时采用单一注射器配置1袋奥美拉唑输液,避免交叉配置不同药品。患者宜采用静脉滴注的方式,在滴注奥美拉唑前后采用0.9%氯化钠注射液进行冲管,以避免输液器内产生配伍变化。在静脉滴注奥美拉唑时,避免通过莫菲管入壶给予其他药物。临床应用中应关注不同生产厂家输液配置后保存时间的差异,尽量做到现配现用。
[1] Ganfyd.Category:Proton pump inhibitors[EB/OL].http://www.ganfyd.org/index.php?title=Proton_pump _inhibitors,2009-08-07/20120502.
[2] FDA.Omeprazole[EB/OL].http://www.accessdata.fda.gov/ drugsatfda_docs/label/2010/019810s090,022056s005lbl.pdf.2010-08/20120502.
[3] 王津文.静脉注射奥美拉唑诱发心绞痛1例[J].中国临床药学杂志,2000,9(4):253-253.
[4] 侯晓青,谭广山,王凤华.注射用奥美拉唑钠与常用9种针剂的配伍稳定性[J].中国药物与临床,2004,4 (9):725-726.
[5] 陈玫芬,林宇星,林 凌.注射用奥美拉唑钠在4种输液中的配伍稳定性观察[J].海峡药学,2009,21(2): 14-15.
[6] 李旭梅,涂厉标.奥美拉唑的化学配伍禁忌及药物相互作用[J].中国临床药学杂志,2009,18(5):320-322.
[7] Ekpe A,Jacobesn T.Effect of various salts on the stability of lansoprazole,omeparzole,and pantoprazole as determined by high-performance liquid chromatography[J].Drug Dev Ind Pharm,1999,25(9):1057-1065.
[8] 马晶晶,李金恒,曹晓梅,等.CYP2C19基因多态性对奥美拉唑药动学与相对生物利用度的影响[J].中国药理学通报,2010,26(2):258-262.
[9] 胡祥鹏,许建明,胡咏梅.CYP2C19基因多态性对奥美拉唑在中国人体内的药物动力学和药效学的影响[J].中国药理学通报,2005,21(10):1210-1213.
[10] FDA Public Health Advisory:Updated Safety Information about a drug interaction between Clopidogrel Bisulfate (marketed as Plavix) and Omeprazole(marketed as Prilosec and Prilosec OTC)[EB/OL].http://www.fda.gov/Drugs/DrugSafety/Postmarket Drug Safety Information for Patients and Providers/DrugSafetyInformation for Heathcare Professionals/PublicHealth Advisories/ucm 190825.htm.2009-11-17/20120610.

