阻塞型睡眠呼吸暂停低通气综合征与颈动脉硬化、胰岛素抵抗的相关性研究
朱宏霞,王镇山,薛 欣
(大连医科大学附属第二医院呼吸内科,辽宁大连 116023)
阻塞型睡眠呼吸暂停低通气综合征与颈动脉硬化、胰岛素抵抗的相关性研究
朱宏霞,王镇山,薛 欣
(大连医科大学附属第二医院呼吸内科,辽宁大连 116023)
[目的]探讨阻塞型睡眠呼吸暂停低通气综合征(OSAHS)与颈动脉内膜中层厚度(IMT)、胰岛素抵抗(IR)之间的关系。[方法]以在大连医科大学附属第二医院就诊,经多导睡眠初筛仪检测,睡眠呼吸暂停低通气指数(AHI)≥5次/h的31例患者作为研究对象。选择同期在本院就诊,经多导睡眠初筛仪检测AHI<5次/h的31例患者作为对照组。两组受试对象性别比、年龄、血压、BMI、TC分布差异显著性意义(均P>0.05)。比较两组患者的稳态模型胰岛素抵抗指数(HOMA-IR)和颈动脉IMT的差异。再分别对HOMA-IR及颈动脉IMT与AHI、呼吸暂停及低通气的总时间、夜间最低脉搏血氧饱和度(SpO2)、平均SpO2进行Spearman相关分析。并分别以HOMAIR及颈动脉IMT为因变量,以年龄、体重指数(BMI)、总胆固醇(TC)、AHI、夜间最低SpO2、呼吸暂停及低通气的总时间为自变量,进行多元逐步回归分析。[结果]与正常对照组相比,OSAHS组患者的HOMA-IR及颈动脉IMT明显增高(均P<0.05)。Spearman相关分析显示颈动脉IMT及HOMA-IR均与AHI、呼吸暂停及低通气的总时间呈正相关,与夜间最低SpO2呈负相关。多元逐步回归分析显示,影响IMT的因素依次是夜间最低SpO2、AHI、年龄、呼吸暂停及低通气的总时间。影响HOMA-IR的因素依次是夜间最低SpO2、BMI、AHI、呼吸暂停及低通气的总时间。[结论]OSAHS是引起颈动脉硬化及胰岛素抵抗的危险因素,改善OSAHS患者的低氧血症对防治动脉粥样硬化及胰岛素抵抗有重要意义。
睡眠呼吸暂停;颈动脉;内膜中层厚度;胰岛素抵抗
阻塞型睡眠呼吸暂停低通气综合征(OSAHS)是以睡眠过程中频繁发生呼吸暂停和血氧饱和度下降为特征的临床综合征,是一种由多方面因素引起的可以影响身体多系统多器官的慢性疾病。OSAHS常常与代谢综合征大家族中的多种疾病,如高血压、糖尿病、肥胖等伴发或先后出现,其最终结果是导致心血管事件发生和死亡危险性增加[1]。胰岛素抵抗(insulin resistance,IR)是代谢综合征的核心,研究表明,IR在动脉粥样硬化(atherosclerosis,AS)及冠状动脉疾病中起重要作用。而颈动脉内膜中层厚度(intima-media thickness,IMT)增加是早期AS的标志,并与心血管危险因素显著相关[2],因此颈动脉IMT可作为了解AS的一个窗口。
本研究通过分析OSAHS患者和非OSAHS患者的颈动脉IMT及IR程度与睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI)、呼吸暂停及低通气的总时间、夜间最低脉搏血氧饱和度(pulse oxygen saturation,SpO2)等的相关性,探讨OSAHS患者夜间低氧血症与AS、IR的关系,认识OSAHS与心脑血管疾病及IR相关疾病的相关性,以期能及早诊断和治疗夜间低氧血症。
1 资料与方法
1.1 研究对象
OSAHS组:选择2008年12月—2009年12月在大连医科大学附属第二医院就诊的患者31例,有睡眠时打鼾、呼吸暂停、白天嗜睡等临床症状,经多导睡眠记录器检测AHI≥5次/h。
对照组:选择同期在本院就诊,年龄、性别、体重指数(bodymass index,BMI)、总胆固醇(total cholesterol,TC)、血压与之匹配,经多导睡眠监测仪检测AHI<5次/h的患者31例。
所有研究对象询问病史(包括慢性病史和生活方式),两组中均无心肌梗死、心力衰竭、脑卒中、肾功能衰竭等疾病。
1.2 多导睡眠初筛仪监测
全部研究对象均采用北京怡和嘉业技术研究中心制造的YH-1000C型多导睡眠记录器监测,记录时间在7 h以上。检测当天禁饮酒、咖啡及服用镇静剂、催眠药。监测项目包括体位、鼻气流、胸腹运动、SpO2等,次日对各指标进行分析。OSAHS诊断依据:(1)症状:患者通常有白天嗜睡、睡眠时严重打鼾和反复的呼吸暂停现象;(2)体征:检查上气道有狭窄因素;(3)睡眠监测:每夜7 h睡眠过程中呼吸暂停及低通气反复发作30次以上,或AHI≥5次/h。呼吸暂停以阻塞型为主。阻塞型呼吸暂停是指睡眠呼吸暂停过程中,口和鼻无气流通过,但胸腹式呼吸仍存在。
1.3 物理检查
受试者免冠、脱鞋,测量身高、体重,计算BMI=体重(kg)/身高2(m2)。休息15 min以上后测收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP),连续测2次,取其平均值。
1.4 颈动脉彩色多普勒超声检查
应用GE VIVID-7型彩色多普勒超声诊断仪,探头频率为10.0 MHz。病人取平卧头仰位,探头置颈部做纵、横扫查,分别显示左右两侧颅外颈总动脉、颈内动脉,注意避开斑块处。因后壁结构显示最清楚,故以后壁IMT为标准。左右两侧的平均值作为结果,IMT≥0.85 mm为颈动脉内膜中层增厚。
1.5 标本采集和测定
受试者接受睡眠呼吸监测后次日清晨(隔夜禁食12 h),抽取静脉血,采用日立7600型全自动生化分析仪检测空腹血糖(fasting blood glucose,FBG)、TC,采用罗氏2010电化学发光仪检测空腹胰岛素水平(fasting insulin,FINS)。
1.6 计算HOMA-IR
将FBG、FINS数据,输入软件(在http://www.ocdem.ox.ac.uk/下载),计算得出稳态胰岛素评价指数(HOMA-IR)。其中 FBG单位为 mmol/L,FINS单位为μU/mL。Matthews等曾将HOMA-IR的结果与钳夹法、MMM及短时胰岛素耐量试验等方法进行对比,认为有良好的相关性,故本文采用HOMA-IR作为胰岛素抵抗的评价指标。
1.7 统计学方法
采用SPSS17.0软件进行多元逐步回归分析。实验数值以±s表示,各组间均数比较采用非配对t检验或方差分析,P<0.05为差异有统计学意义。相关性分析采用Spearman相关检验,r≠0,且P<0.05为有统计学意义。
2 结果
2.1 各组受试对象临床资料比较
两组受试对象性别比、年龄、BMI、TC、SBP、DBP分布差异无显著性意义(P值均>0.05),IMT、HOMA-IR、AHI及夜间最低SpO2在两组间差异有显著性意义(P值均<0.05),见表1。
表1 两组患者的基本情况及检测指标比较Tab 1 Comparisons of characteristics and results of this study between the two groups (±s)

表1 两组患者的基本情况及检测指标比较Tab 1 Comparisons of characteristics and results of this study between the two groups (±s)
组别 例数 性别(男/女)年龄(岁)BMI(kg/m2)TC(mmol/L)SBP(mmHg)DBP(mmHg)IMT(mm)HOMA-IR AHI(次/h)夜间最低SpO2(%)OSAHS 31 12/19 49 ±11 26.7 ±1.5 2.6 ±0.4 148 ±10 86 ±6 0.88 ±0.28 4.2 ±2.7 23.1 ±14.6 79.19 ±10.41对照组 31 14/17 51 ±12 27.0 ±1.4 2.3 ±0.3 145 ±11 84 ±5 0.61 ±0.19 1.9 ±0.9 2.3 ±1.2 92.58 ±3.25 P>0.05 >0.05 >0.05 >0.05 >0.05 >0.05 <0.05 <0.05 <0.05 <0.05
2.2 IMT与各变量的Spearman相关分析
Spearman相关分析显示IMT与AHI、呼吸暂停及低通气的总时间呈正相关,与夜间最低SpO2呈负相关,见表2。
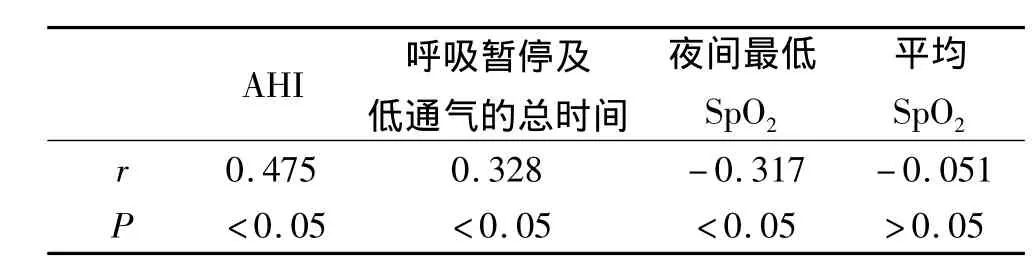
表2 睡眠监测指标与颈动脉IMT的Spearman相关分析Tab 2 Spearman correlation testbetween sleep study data and carotid IMT
2.3 HOMA-IR与各变量的Spearman相关分析
Spearman相关分析显示HOMA-IR与AHI、呼吸暂停及低通气的总时间呈正相关,与夜间最低SpO2呈负相关,见表3。

表3 睡眠监测指标与HOMA-IR的Spearman相关分析Tab 3 Spearman correlation test between sleep study data and HOMA-IR
2.4 IMT与各自变量的多元逐步回归分析
以 IMT 为因变量,以年龄、BMI、TC、AHI、夜间最低SpO2、呼吸暂停及低通气的总时间为自变量,进行多元逐步回归分析,得出影响IMT的因素依次是夜间最低SpO2、AHI、年龄、呼吸暂停及低通气的总时间,见表4。
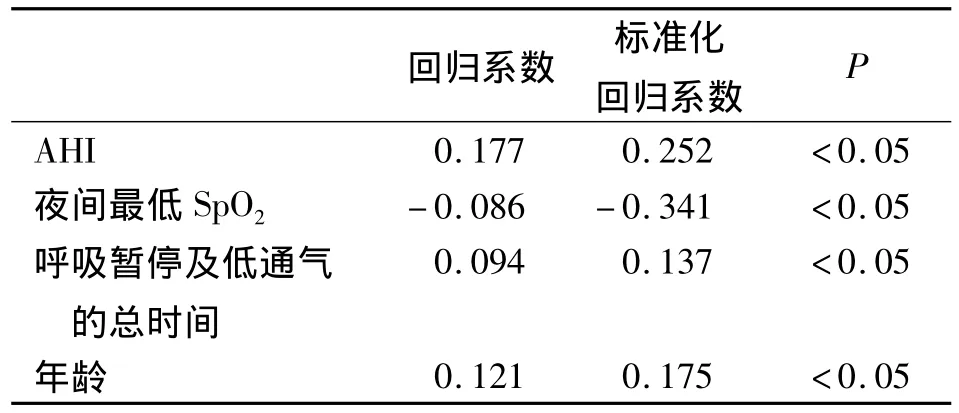
表4 影响IMT的多元逐步回归分析Tab 4 Multiple stepwise regression analysis of factors influencing IMT
2.5 HOMA-IR与各自变量的多元逐步回归分析
以HOMA-IR为因变量,以年龄、BMI、TC、AHI、夜间最低SpO2、呼吸暂停及低通气的总时间为自变量,进行多元逐步回归分析,得出影响HOMAIR的因素依次是夜间最低 SpO2、BMI、AHI、呼吸暂停及低通气的总时间,见表5。
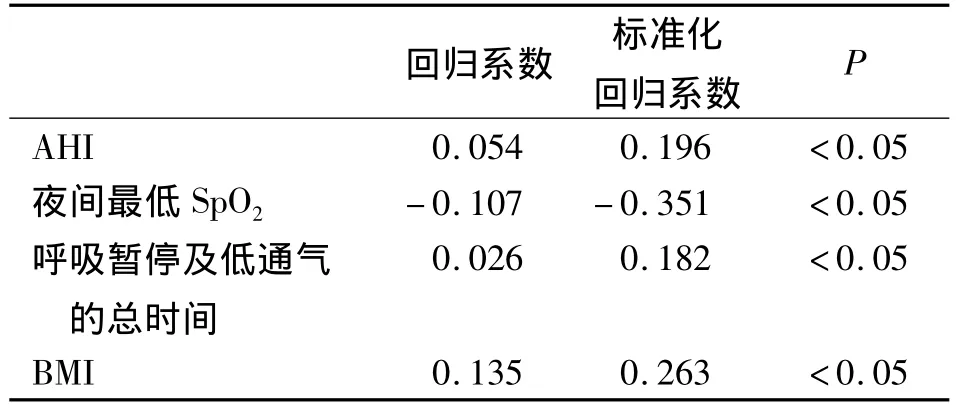
表5 影响HOMA-IR的多元逐步回归分析Tab 5 Multiple stepwise regression analysis of factors influencing HOMA-IR
3 讨论
OSAHS是常见的睡眠呼吸障碍性疾患,诊断OSAHS有价值的参数为AHI和夜间最低SpO2。但AHI仅反映患者发生呼吸暂停或低通气的频度,而不能反映患者夜间低氧血症的严重程度,故AHI在判断呼吸暂停或低通气对患者健康影响方面存在局限性,且AHI与患者的临床表现并不完全平行,因此近年来夜间最低SpO2越来越受到临床重视,成为另一个反映严重程度的参考指标。
近年来的研究发现OSAHS引起的慢性间歇性缺氧在动脉粥样硬化性疾病的发生发展中扮演了重要角色。有研究显示,OSAHS是动脉粥样硬化AS过程的一个易患因素,且独立于其他共存的血管危险因素[3]。OSAHS导致AS发生、发展的机制目前主要有氧化应激、炎症反应等。Lavie[4]提出OSAHS是一种氧化应激性疾病的概念。Dyugovskaya等[5]发现OSAHS患者单核细胞粘附分子的表达及氧化代谢升高。Suzukis等[6]亦证明反复的OSAHS呼吸暂停相关的低氧事件可启动氧化应激。关于OSAHS患者氧化应激状态形成的原因,推测可能与间断低氧、交感神经兴奋性增强及睡眠紊乱有关。其中最为引人注目的就是OSAHS的特征性低氧方式—慢性间歇性低氧。OSAHS患者睡眠中由于反复的上气道阻塞发生,会出现间断的缺氧和再氧合,这种缺氧/再氧合可能会出现某些类似于缺血/再灌注过程中产生过多的活性氧,从而引起机体氧化应激状态的改变,而氧化应激是导致血管内皮功能损伤的重要因素之一。血管内皮功能损伤使血管内膜平滑肌细胞增殖和组织损伤,由此引起一系列细胞因子的释放,这种细胞因子释放的瀑布效应触发动脉粥样硬化的形成,也是动脉粥样硬化的始动因素,并诱导心血管疾病的发生。Julien等[7]研究发现,间断缺氧14 d的小鼠血管内皮细胞出现损伤和功能紊乱,为AS的形成奠定了基础。长期慢性间歇性低氧还可激活化学感受器和交感神经,引起去甲肾上腺素水平升高,刺激内源性洋地黄样因子释放,由此造成血管平滑肌发生重构、增生并肥厚。同时,长期间断缺氧可启动体内一系列复杂的免疫反应,促使炎性细胞因子的产生,诱导慢性炎症反应。有些研究从不同角度证实OSAHS患者炎性因子水平增高,包括 C-反应蛋白、TNF-α、IL-6、IL-8及细胞粘附分子(ICAM)-1 等[8-9],提示 OSAHS 患者存在系统性炎症反应,而这些因子参与了动脉粥样硬化的形成过程。另外,OSAHS患者夜间呼吸暂停的反复发作导致低氧血症和高碳酸血症,刺激肾脏分泌促红细胞生成素,导致红细胞生成增多,血液粘稠度增加,脂肪代谢紊乱,血流缓慢,血小板易在受损内膜表面聚集,从而形成血栓,导致动脉粥样硬化的发生或早已存在的粥样硬化斑块的进一步发展。
本文结果提示OSAHS是产生IR的重要病因之一,其夜间反复出现呼吸暂停导致低氧血症是致病的重要因素。结合文献及本研究结果,推测OSAHS发生IR的可能机制:(1)反复的睡眠呼吸暂停和低通气导致低氧血症及高碳酸血症,从而引起交感神经兴奋,可破坏糖代谢平衡,通过增加糖原分解及诱导糖异生而引发IR[10];(2)OSAHS患者的睡眠期低氧血症、高碳酸血症和酸中毒状态下,胰岛素及其受体的亲和力下降,组织细胞对胰岛素的敏感性降低;(3)夜间交感神经兴奋性增高还可以刺激脂肪分解,使游离脂肪酸增多进而促进IR的发生;(4)除了上述机制外,脂肪组织的代谢紊乱和炎症因子在OSAHS致IR过程中的作用颇受关注。
本研究结果显示:OSAHS组与对照组在年龄、性别、BMI、TC、SBP、DBP 无明显差异的情况下,OSAHS组的颈动脉IMT及HOMA-IR明显高于对照组,Spearman相关分析显示颈动脉IMT及HOMA-IR均与AHI、呼吸暂停及低通气的总时间呈正相关,与夜间最低SpO2呈负相关。即夜间睡眠呼吸紊乱的程度越重则AS的程度越高,IR的程度也越重。夜间最低SpO2是影响颈动脉IMT及HOMA-IR的重要因素。上述结果提示治疗OSAHS导致的夜间低氧血症,对减少心脑血管疾病的发生率和IR有重要意义。
[1]Parish JM,Sommers VK.Obstructive sleep apnea and cardiovascular disease[J].Mayo Clin Proc,2004,79:1036 -1046.
[2]Pipitone S,Corrado E,Muratori I,et al.Extracoronary atherosclerosis in patients with chronic ischemic heart disease:relationeship with risk factors and the severity of coronary artery disease[J].International Angiology,2007,26:346 -353.
[3]Saletu M,Nosiska D,Kapfham mer G,et al.Structura1 and serum surrogate markers of cereorovascular disease in obstructive sleep apnea:association of mild 0SA with early athero sclerosis[J].Neurol,2006,253:746 - 752.
[4]Lavie L.Obstructive sleep apnea syndrome- an oxidative stress disorder[J].Sleep Med Rev,2003,7:35 -51.
[5]Dyugovskaya L,Lavie L.Increased adhesion molecules expression and production of reactive oxygen species in leukocytes of sleep apnea patients[J].Am JRespir Care Med,2002,165:934 -939.
[6]Suzuki,Nagai E,Taira Y,et al.In vitro wear of lndireet cornposite restoratives[J].JProsthet Dent,2002,88:431 -436.
[7]Julien C,Sam B,Patrick L.Vascular reactivity to norepinephrine and acetylcholine after chronic intermittenthypoxia in mice[J].Respir Physiol Neurobiol,2003,139:21 -32.
[8]Steiropoulos P,Tsara V,Nena E,et al.Effect of continuous positive airway pressure treatment on serum cardiovascular risk factors in patients with obstructive sleep apnea-hypopnea syndrome[J].Chest,2007,132(3):843 -851.
[9]Ryan S,Taylor CT,McNicholas WT.Predictors of elevated nuclear factor- κB -dependent genes in obstructive sleep apnea syndrome[J] .American Journal of Respiratory and Critical Care Medicine,2006,174(7):824 -830.
[10]谭敏,程立顺,杨静.阻塞型睡眠呼吸暂停低通气综合征与胰岛素抵抗研究进展[J].国际呼吸杂志,2009,29:958-600.
Study on the relationship between obstructive sleep apnea-hypopnea syndrome and carotid atherosclerosis,insulin resistance
ZHU Hong-xia,WANG Zhen-shan,XUE Xin
(Department of Respiratory Medicine,the Second Affiliated Hospital of Dalian Medical University,Dalian116023,China)
[Objective]To discuss the relationship between obstructive sleep apnea-hypopnea syndrome(OSAHS)and carotid intima-media thickness(IMT),insulin resistance(IR).[Methods]All subjectswere selected from the patients attending the second Affiliated Hospital of Dalian Medical University.After testby portable polysomnograph,patientswhose sleep apnea-hypopnea index(AHI)≥5 times/h(31 patients)were included in the research group.During the same period,patients whose AHI<5 times/h(31 patients)were included in the control group.There were no significant differences between sex ratio,age,BMI,TC of the two groups(P>0.05).Then the comparison of differencewasmade between HOMA -IR and carotid IMT of the2 groups.The relativity between HOMA -IR,carotid IMT and AHI,total time ofapne a and hypopnea,the lowest SpO2,average SpO2were respectively assessed by Spearman correlation test.Carotid IMT and HOMA -IR were respectively chosen as the dependent variables,and age,body mass index(BMI),total cholesterol(TC),AHI,the lowest SpO2,total time of apnea and hypopnea were chosen as the independent variables for multiple stepwise regression analysis.[Results]Compared with the normal group,HOMA - IR and carotid IMT in OSAHS group increased significantly(P<0.05).Spearman correlation analysis revealed that carotid IMT and HOMA -IR were both associated positively with AHI,total time of apnea and hypopnea,while they were both associated negatively with the lowest SpO2.Multiple stepwise regression analysis revealed that factors influencing IMTwere the lowest SpO2,which was followed by AHI,age,total time of apnea and hypopnea.Factors influencing HOMA - IRwere the lowest SpO2,which was followed by BMI,AHI,total time of apnea and hypopnea.[Conclusions]OSAHS is a risk factor of carotid artherosclerosis and insulin resistance.Treatment of hypoxemia has important role in preventing carotid artherosclerosis and insulin resistance.
sleep apnea;carotid artery;intima-media thickness;insulin resistance
R56
A
1671-7295(2012)03-0248-04
2011-12-27;
2012-04-01
朱宏霞(1980-),女,辽宁大连人,硕士研究生。E-mail:carol1024@sina.com
王镇山,教授。E-mail:WZSDL@yahoo.com
book=0,ebook=313

