Ad-hTIMP1感染对Hcy刺激人脐静脉内皮细胞MMP1、MMP9、TIMP1 mRNA表达的影响
李 汇,毛用敏,赵莉莉,崔让庄,王佩显
(1天津医科大学总医院,天津300052;2天津市胸科医院)
金属蛋白酶组织抑制剂(TIMPs)是基质金属蛋白酶(MMPs)的内源性特异性抑制剂,MMPs是降解细胞外基质(ECM)成分的主要酶系[1]。近年研究[2]发现,动脉粥样硬化(AS)的病理过程与MMPs/TIMPs的失衡密切相关,而高水平同型半胱氨酸(Hcy)可以通过影响血管内皮细胞MMPs的表达,促进ECM的降解,进而降低AS斑块的稳定性[3]。本研究利用腺病毒载体系统AdEasy System构建携带人 TIMP1基因片段的重组腺病毒Ad-TIMP1,用其感染体外培养的人脐静脉内皮细胞CRL-1730,观察该细胞MMP1、MMP9、TIMP1 mRNA的表达变化,探讨TIMP1基因转导对Hcy造成的内皮细胞损伤的保护作用,为基因治疗AS、稳定AS斑块提供理论依据。
1 材料与方法
1.1 材料 AdEasy复制缺陷型腺病毒载体系统(穿梭质粒pAd-Track-CMV和骨架质粒pAdEasy-1)以及包装细胞系人胚肾细胞(293T)购自北京大学实验室;pUCm-T载体质粒及BJ5183菌株、JM109菌株、DH5α菌株均为本实验室保存;TaqDNA聚合酶为本实验室提取保存,限制性内切酶BgⅢ、NotⅠ和DNA marker购自TakaRa生物工程(大连)有限公司,Pac I购自NEB公司;T4 DNA连接酶、高纯度质粒柱式提取试剂盒和脂质体购自INVITROGEN公司,胎牛血清(FBS)和DMEM高糖培养液购自美国GIBCO公司。
1.2.1 pUC-hTIMP1重组质粒的构建 在Genebank中搜索hTIMP1序列,设计上游引物为5'-AGA ACC CAC CAT GGC CCC CT-3',下游引物为5'-GAT TCA GGC TAT CTG GGA CCG-3'。从人心肌组织中提取总 RNA,采用 RT-PCR技术得到人 TIMP1 (hTIMP1)的基因片段,将其连接到pUCm-T载体质粒中,转化入感受态JM109细胞,含氨苄青霉素的LB培养基筛选阳性克隆,提取质粒,NcoI酶切鉴定正确后再次转化入JM109进行扩增,测序正确后提取质粒。
1.2.2 穿梭质粒AdTrack-CMV-hTIMP1的构建分别用BgⅢ和NotⅠ双酶切pUC-hTIMP1和穿梭质粒pAdTrack-CMV,用凝胶回收hTIMP1片段和开环质粒pAdTrack-CMV,T4 DNA连接酶连接二者并转化JM109感受态细胞,含卡那霉素的LB培养基筛选阳性克隆,提取质粒,酶切及测序鉴定正确后再次转化JM109感受态细胞扩增,提取质粒,命名为重组质粒AdTrack-CMV-hTIMP1。 1.2.3 细菌内同源重组产生重组腺病毒质粒AdEasy-GFP-hTIMP1 电穿孔法(2 500 V,5 ms)将PemI酶切线性化的1 μg的AdTrack-CMV-hTIMP1重组质粒和1 μg的pAdTrack-CMV(空载体阴性对照)分别转化到含有pAdEasy-1的电感受态大肠杆菌BJ5183中,通过卡那霉素LB培养基平板筛选(50 μg/mL)获得阳性腺病毒重组质粒,BamHⅠ和PacⅠ酶切鉴定,PCR进一步鉴定。选取重组正确的质粒(Ad-hTIMP1和Ad-Track)在DH5α菌中扩增,高纯度质粒柱式提取试剂盒提取质粒,Pac I酶切线性化后凝胶回收较大片段,冰乙醇沉淀,溶于无菌水中待用。
1.3 重组腺病毒在293T细胞中的包装和扩增
1.3.1 重组腺病毒质粒转染293T细胞并包装 采用阳离子脂质体法。用脂质体Lipofectamine 2000及Plus reagent将4μg的 pAd-hTIMP1和4μg的pAd-Track转染到2个60 mm培养皿中(细胞融合度为50%~60%)进行病毒包装,24 h后荧光显微镜下观察绿色荧光蛋白(GFP)的表达,倒置相差显微镜下观察细胞病变效应(CPE)。于转染后第9天收集细胞,反复冻融法得到重组腺病毒Ad-hTIMP1和Ad-Track上清。
1.3.2 包装好的重组腺病毒感染293T细胞并扩增
取病毒上清的1/3感染293T细胞(约90%融合),感染后第3天反复冻融法收集重组腺病毒上清,反复感染4次于293T细胞中扩增病毒到所需滴度。
1.3.3 重组腺病毒的纯化 用CsCl密度梯度离心法纯化重组腺病毒颗粒,用OD260法测定腺病毒的滴度。根据公式(病毒滴度=OD260×病毒稀释度×测定稀释度×1.1×1012)进行计算。用2%、pH 6.2的磷钨酸溶液对样品进行负染,透射电镜下观察。
1.4 腺病毒介导hTIMP1在内皮细胞中过表达对抗Hcy对内皮细胞刺激的观察
在开始实际的Milk-run设计之前,必须对实施Milk-run的条件进行调整,以确定是否满足了允许在工厂内使用Milk-run生产系统的3个要求:布局、安全和物料。
1.4.1 腺病毒感染细胞 将CRL-1730细胞分到6孔板中(2.4×105/孔)。24 h后,按6个感染复数(MOI)值(30,50,70,90,110,150)进行腺病毒感染,48 h后观察细胞及其荧光表达情况。
1.4.2 细胞分组及处理 根据加入重组腺病毒的不同将CRL-1730细胞分为三组,即空白对照组、Track对照组和基因治疗组。根据以上各组中加入Hcy的剂量不同各分成三个亚组:Hcy 0 mmol/L(空白对照)组,Hcy 0.01 mmol/L(生理浓度)组和Hcy 0.1 mmol/L(病理浓度)组。每个亚组均设8个复孔,Hcy刺激后6 h收集各复孔中的细胞培养液。
1.4.3 CRL-1730细胞MMP1、MMP9及TIMP1基因片段的扩增 采用RT-PCR法,以GAPDH为内参照。用UNIQ-10柱总RNA抽提试剂盒(上海生工)提取各组CRL-1730细胞中的总RNA,逆转录得到cDNA,PCR扩增MMP1、MMP9及TIMP1基因片段(PCR引物设计及实验条件见表1)。2%琼脂糖凝胶电泳检测PCR扩增产物。以电泳条带的灰度代表mRNA含量,目的基因与内参电泳条带的灰度比值反应目的基因的相对值。Gel-pro 3.1凝胶成像系统分析结果。

表1 PCR引物序列及实验条件
1.5 统计学方法 以每亚组的8个样品值中目的基因的mRNA相对值计算均数,数值以±s表示。多组间比较采用单因素方差分析(ANOVA),两组间比较采用LSD检验或Dunnett's t检验(方差不齐时)。P≤0.05为差异有统计学意义。
2 结果
2.1 心肌细胞中hTIMP1的扩增结果 扩增后得到637 bp的hTIMP1特异条带。
2.2 AdEasy-GFP-hTIMP1重组质粒PacⅠ酶切鉴定结果 在pAd-Track-CMV上有两个PacⅠ的酶切位点,可将重组子切为一个大片段和一个约4.5 kb的小片段,见图1。

图1 PacⅠ酶切Ad-hTIMP1和Ad-Track重组质粒
2.3 293T细胞中包装并扩增腺病毒结果 重组腺病毒转染293T细胞后,第4~5天荧光显微镜下可观察到GFP呈“彗星状”改变。转染第9天采用反复冻融法收集病毒液,并将之感染293T细胞,第3天可以观察到典型的CPE。反复感染、冻融收集3次后,CsCl密度梯度离心法纯化,OD260法测得重组腺病毒pAd-hTIMP1的滴度为1.9×1012VP/mL,对照重组腺病毒pAd-Track的滴度为0.6×1012VP/ mL。透射电镜下见病毒颗粒直径约90 nm,呈多面体形状,绝大多数病毒颗粒完整。
2.4 腺病毒裂解液hTIMP1的PCR扩增结果 扩增产物经 2%琼脂糖凝胶电泳可见 637 bp的hTIMP1特异条带(图2)。
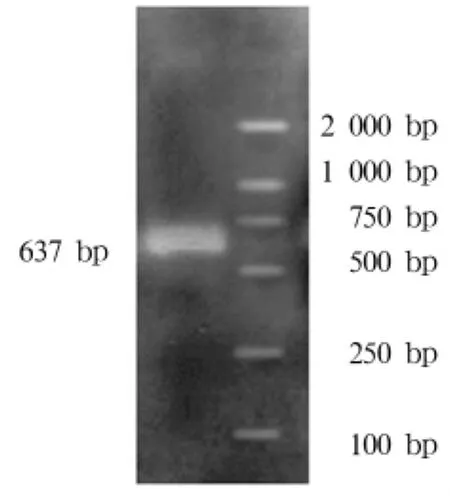
图2 腺病毒裂解液hTIMP1的PCR扩增片段(可见637 bp的特异条带)
2.5 重组腺病毒感染CRL-1730细胞后倒置荧光显微镜下的观察结果 重组腺病毒感染CRL-1730细胞后,倒置荧光显微镜下可见荧光表达强烈,且多数细胞均有荧光表达。
2.6 各组CRL-1730细胞的hTIMP1、MMP1、MMP9 mRNA表达比较 见表2。表2表明,病理剂量Hcy可以刺激CRL-1730细胞的MMP1、MMP9 mRNA表达升高;重组Ad-hTIMP1感染CRL-1730细胞后其hTIMP1 mRNA的高表达可抑制MMP1 mRNA的表达,并可对抗Hcy对CRL-1730细胞的损伤作用; hTIMP1 mRNA过表达对MMP 9的转录有一定的抑制作用。
3 讨论
AS斑块局部ECM降解增加而合成减少等因素增加了斑块的易损性,从而诱发急性冠脉综合征的发生。因此,如何降低AS斑块的易损性,防止AS斑块的破裂是当前AS防治研究的新方向。
表2 各组CRL-1730细胞的hTIMP1、MMP1、MMP9 mRNA表达比较(±s)

表2 各组CRL-1730细胞的hTIMP1、MMP1、MMP9 mRNA表达比较(±s)
注:与空白对照组相比,*P<0.05;与0 mmol/L浓度组相比,△P<0.05
?
研究表明,AS斑块损伤部位MMPs表达升高,包括间质胶原酶(即MMP1)、明胶酶(即MMP2和MMP9)以及基质降解酶(即MMP3),而TIMP1和TIMP2等表达减少。Johoson等[4]在冠状动脉的AS斑块中检测发现MMPs与TIMPs的比例失调,认为调节两者之间的比例可起到治疗AS的作用。Rouis等[5]报道,腺病毒介导 TIMP1过表达可以减轻ApoE-/-小鼠的颈动脉AS损伤程度,并推测此作用是由于TIMP1抑制MMPs活性,保护了ECM,进而抑制了平滑肌细胞的移行所致。该研究中,小鼠喂食6周高胆固醇食物后注射携带TIMP1的重组腺病毒,4周后AS斑块的损伤面积明显减小,与之前研究转基因过表达TIMP1抑制MMPs表达的结果相一致[6]。另外,感染携带TIMP1的重组腺病毒(Ad.TIMP1)使猪主动脉内皮细胞过表达TIMP1,可以减少细胞移行及对ECM的侵袭[7]。利用分子生物学技术使局部TIMPs过表达,为治疗AS带来了希望[8]。
已知遗传性高Hcy血症与早发AS有关,其机制可能与Hcy损伤血管内皮细胞,诱使平滑肌细胞肥大、增生及移行,促进ECM特别是胶原的降解等作用有关。研究[9]表明,高Hcy血症患者外周血单核细胞中MMP9 mRNA水平升高,表明Hcy可以通过调节MMPs的活性而导致AS。有报道ApoE缺失的小鼠高Hcy血症可增加AS面积,升高MMP9的表达,表明Hcy可以改变血管壁ECM的稳态。而腺病毒介导局部过表达TIMP1对不同浓度Hcy刺激的内皮细胞是否有保护作用目前未见报道。
本研究发现,病理浓度Hcy可以刺激人脐静脉内皮细胞中MMP1、MMP9 mRNA的表达增加,使MMPs/TIMP1升高,二者比例失衡。表明Hcy可以通过影响MMPs的表达,增加ECM的降解,这与之前的研究是一致的[10]。另外,重组Ad-hTIMP1感染内皮细胞后细胞内TIMP1 mRNA表达明显升高,即使在病理剂量Hcy刺激下,TIMP1 mRNA的表达仍处于高水平,说明外源性TIMP1可对抗Hcy的抑制作用。病理浓度Hcy可刺激CRL-1730细胞MMP1、MMP9 mRNA的表达增加。感染了 Ad-TIMP1的CRL-1730细胞在受到病理浓度Hcy刺激时MMP1、 MMP9 mRNA表达均减低,说明TIMP1 mRNA过表达对MMPs的表达有一定的抑制作用,从而对抗Hcy对内皮细胞的损伤作用,这为TIMP1作为靶基因用于稳定动脉粥样斑块的基因治疗奠定了基础。
目前,TIMP1的作用机理尚不完全清楚,有人推测可能通过其第17~19位上的亮氨酸—颉氨酸—异亮氨酸与MMP1的S1'-S2'-S3'区结合,使MMP1第16位上天冬氨酸残基的羧基作用于其活性中心的锌,从而抑制其活性。本研究发现,TIMP1mRNA过表达降低了MMP1、MMP9 mRNA水平。表明TIMPs过表达可能对MMPs的转录有抑制作用,但其机理尚需进一步研究。
[1]Fic P,Zakrocka I,Kurzepa J,et al.Matrix metalloproteinases and atherosclerosis[J].Postepy Hig Med Dosw,2011,1(65):16-27.
[2]Liu P,Sun M,Sader S.Matrix metalloproteinases in cardiovascular disease[J].Can J Cardiol,2006,2(22 Suppl B):25-30.
[3]Mujumdar VS,Aru GM,Tyagi SC.Induction of oxidative stress by homocyst(e)ine impairs endothelial function[J].J Cell Biochem,2001,82(3):491-500.
[4]Johnson JL,Jackson CL,Angelini GD,et al.Activation of Matrix Degrading Metallo proteinases by mast cell proteases in atherosclerotic plaques[J].Arterioscler Thromb Vasc Biol,1998,18(11): 1707-1715.
[5]Rouis M,Adamy C,Duverger N,et al.Adenovirus-mediated overexpression of tissue inhibitor of metalloproteinase-1 reduces atherosclerotic lesions in apolipo protein E-deficient mice[J].Circulation,1999,8(3):533-540.
[6]Watanabe M,Yakahashi Y,Ohta T,et al.Inhibition of metastasis in human gastric cancer cells transfected with tissue inhibitor of metalloproteinase-1 gene in nude mice[J].Cancer,1996,77(8): 1676-1680.
[7]Fernandez HA,Kallenbach K,Seghezzi G,et al.Inhibition of endothelial cell migration by gene transfer of tissue inhibitor of metalloproteinases-1[J].J Surg Res,1999,82(2):156-162.
[8]Papaspyridonos M,Smith A,Burnand KG,et al.Novel candidate genes in unstable areas of human atherosclerotic plaques[J].Arterioscler Thromb Vasc Biol,2006,26(8),1837-1844.
[9]Steed MM,Tyagi SC.Mechanisms of cardiovascular remodeling in hyperhomo cysteinemia[J].Antioxid Redox Signal,2011,15(7): 1927-1943.
[10]Hofmann MA,Lalla E,Lu Y,et al.Hyperhomocysteinemia enhances vascular inflammation and accelerates atherosclerosis in a murine model[J].J Clin Invest,2001,107(6):675-683.

