苏丹草种子醇溶蛋白提取和电泳条件优化
邓志瑞, 孙晶晶, 张文举, 陈 沁
(上海大学生命科学学院,上海200444)
苏丹草(Sorghum sudanense)原产于非洲北部的苏丹高原,在欧洲、北美洲及亚洲大陆的热带和亚热带均有栽培,是世界各国栽培最普遍的一年生禾本科牧草之一,被称为禾本科牧草中的“牧草之王”[1].由于种子质量管理技术和相关制度的缺失,我国苏丹草种子生产上的种质非常混乱,因此,对苏丹草品种真实性和纯度进行鉴定十分重要[2].种子醇溶蛋白是种子胚乳中的主要贮藏蛋白质,该蛋白质不受种植环境等的影响,是植物基因类型的表现特征之一[3],其指纹研究在品种真实性和资源鉴定评价中具有重要的应用价值[4].许多学者已经将醇溶蛋白分析技术广泛应用于植物种类鉴别、基因标记、种子纯度检验、远缘杂种鉴定、体细胞无性变异鉴定等方面[5-8].醇溶蛋白电泳图谱不仅可以表现植物种间的差异,也可表现种内类型的差异.建立每种植物的醇溶蛋白指纹图谱,可以为植物资源的广泛利用提供实验和理论依据[9-10].本实验通过研究影响醇溶蛋白提取和SDS-PAGE电泳效果的主要因素,优化了苏丹草种子醇溶蛋白提取和SDS-PAGE电泳条件,为苏丹草种子分子水平的鉴定奠定了研究基础.
1 材料与方法
1.1 实验材料
本实验所用的苏丹草(Sorghum sudanense)产自湖南,高粱(Sorghum bicolor)产自河北泊头,玉米(Zea may)产自美国,大麦(Hordeum vulgare)产自加拿大.
1.2 实验方法
1.2.1 不同提取剂对苏丹草醇溶蛋白提取的影响
用液氮研磨苏丹草种子至粉末状,称取100 mg转移到1.5 mL Eppendorf管中,分别加入600 μL 70%乙醇、70%正丙醇、70%异丁醇、70%异丙醇、70%叔丁醇和70%乙二醇,振荡混匀后,37℃水浴提取过夜.然后,8 000 r/min离心15 min,采用考马斯亮蓝G-250方法测定上清液蛋白浓度.把蛋白质浓度稀释至12 μg/μL,取5 μL蛋白溶液加入等体积的2×电泳上样缓冲液,95℃处理5 min后上样,以12%的分离胶进行电泳检测[11-16].
1.2.2 样品/提取剂比例对苏丹草种子醇溶蛋白提取的影响
分别按种子粉末质量与提取剂体积比(g/mL)为1∶2,1∶4,1∶6,1∶8,1∶10,1∶12,1∶15,1∶20加入提取剂提取醇溶蛋白,以12%的分离胶进行电泳检测.
1.2.3 还原剂DTT的浓度对苏丹草种子醇溶蛋白提取的影响
配制含不同终浓度DTT(0%,0.1%,0.2%,0.3%,0.4%,0.5%,1.0%,1.5%,3.0%)的70%正丙醇提取剂,以12%的分离胶进行电泳检测.
1.2.4 不同上样量、不同分离胶浓度对电泳的影响
分别使用8%,10%,12%,15%的分离胶,以上述最佳提取条件下得到的苏丹草种子醇溶蛋白为样品,稀释,使得不同上样孔在相同上样体积(10 μL)中含有的醇溶蛋白分别为10,20,30,35,40,50,60,70 μg.
1.2.5 优化条件对其他禾本科种子醇溶蛋白分析的可行性研究
根据上述实验得到的苏丹草种子醇溶蛋白提取和电泳优化条件,对几种常见的禾本科种子醇溶蛋白进行提取和电泳分析,检验所建立的优化条件是否适用于其他禾本科种子.
2 结果与分析
2.1 不同提取剂对苏丹草种子醇溶蛋白提取的影响
用不同提取剂提取的醇溶蛋白电泳图谱如图1所示,其中1为标准蛋白,2~7为分别用70%乙醇、70%正丙醇、70%异丁醇、70%异丙醇、70%叔丁醇和70%乙二醇提取的醇溶蛋白.可见,使用不同提取剂得到的醇溶蛋白电泳图谱存在差异,主要表现在谱带丰富度和带型不同,其中以乙醇、正丙醇和叔丁醇提取得到的电泳图谱丰富度最好,而用乙二醇和异丁醇只能得到少量的谱带.因此,本实验选择70%正丙醇作为苏丹草种子醇溶蛋白的提取剂.
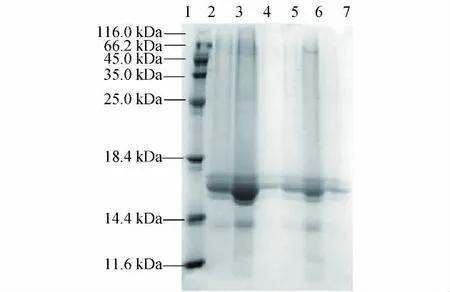
图1 不同提取剂对苏丹草醇溶蛋白提取的影响Fig.1 Effects of different extracting agents on prolamin extraction from Sorghum sudanense seeds
2.2 样品/提取剂比例对苏丹草种子醇溶蛋白提取的影响
提取剂用量不同对提取苏丹草种子醇溶蛋白有明显影响(见图2,其中1为标准蛋白,2~9分别为样品/提取剂比例为1∶2,1∶4,1∶6,1∶8,1∶10,1∶12, 1∶15,1∶20所提取的醇溶蛋白图谱).由图2可见,条带的强度随提取剂用量的增加而减弱,其中以1∶4~1∶8提取的醇溶蛋白具有丰富的谱带,而以1∶12和1∶15提取的蛋白谱带清晰度明显下降,当以1∶20提取时几乎看不到蛋白谱带.
图3为不同提取剂用量,相同蛋白含量对苏丹草种子醇溶蛋白提取的影响,其中1为标准蛋白; 2~9分别为样品/提取剂比例为1∶2,1∶4,1∶6,1∶8,1∶10,1∶12,1∶15,1∶20所提取的醇溶蛋白,调整使得每孔上样等量蛋白质(15 μg/加样孔).可见,取相同质量的醇溶蛋白为上样量,提取剂的比例越大,得到的图谱条带越丰富,提取效果越好.考虑到电泳图的清晰程度,蛋白浓度测定的结果,以及实验的操作性,本实验选择1∶8作为最佳提取剂比例.
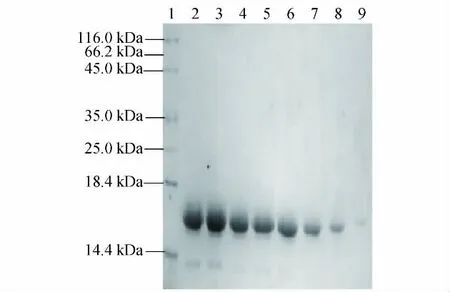
图2 不同提取剂用量(蛋白含量不同)对苏丹草种子醇溶蛋白提取的影响Fig.2 Effects of different reagent dosages(different prolamin quality)on prolamin extraction from Sorghum sudanense seeds

图3 不同提取剂用量(蛋白含量相同)对苏丹草种子醇溶蛋白提取的影响Fig.3 Effects of different reagent dosages(same prolamin quality)on prolamin extraction from Sorghum sudanense seeds
2.3 还原剂DTT浓度对苏丹草种子醇溶蛋白提取的影响
用含有不同浓度DTT的70%正丙醇作为提取剂,提取到的醇溶蛋白电泳图谱如图4所示,其中1为标准蛋白,2~10分别为加入还原剂DTT浓度为0%,0.1%,0.2%,0.3%,0.4%,0.5%,1.0%,1.5%,3.0%的70%正丙醇.由图可知,DTT可以提高醇溶蛋白的提取效率,且随着DTT浓度的升高,提取效率也相应地提高.但当DTT浓度超过0.2%后,已没有显著剂量关系.考虑到成本的因素,本实验选取0.2%DTT浓度的70%正丙醇作为最佳提取剂.
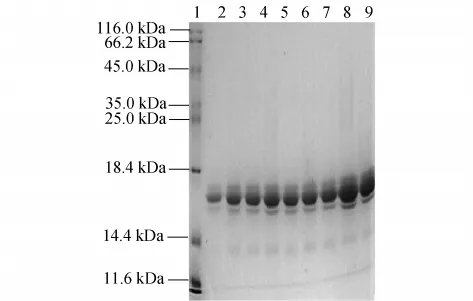
图4 DTT浓度对苏丹草种子醇溶蛋白提取的影响Fig.4 Effects of different reduction reagent concentrations on prolamin extraction from Sorghum sudanense seeds
2.4 上样量、分离胶浓度对苏丹草醇溶蛋白电泳的影响
随着分离胶浓度的提高,醇溶蛋白的谱带清晰度逐渐提高,并且不同浓度的分离胶得到的电泳条带的数目也不相同(见图5,其中1为标准蛋白;2~9分别为上样孔醇溶蛋白量为10,20,30,35,40,50,60,70 μg的蛋白图谱).同一分离胶,在一定的浓度范围内,随着上样蛋白含量的增多,电泳条带也逐渐清晰.但当醇溶蛋白的上样蛋白量达到一定程度时,蛋白条带开始堆积,谱带的清晰度也开始下降,以至于难以区分.由图5可知,12%或者15%的分离胶可以产生较好的分辨率,但当凝胶浓度高于15%时,胶片韧性较差,容易碎裂,因此,本实验选取12%作为最佳分离胶浓度.在本实验所用电泳条件下(胶板大小为73 mm×83 mm,胶厚度为0.75 mm,共15个上样孔),每孔最佳上样量为40 μg.
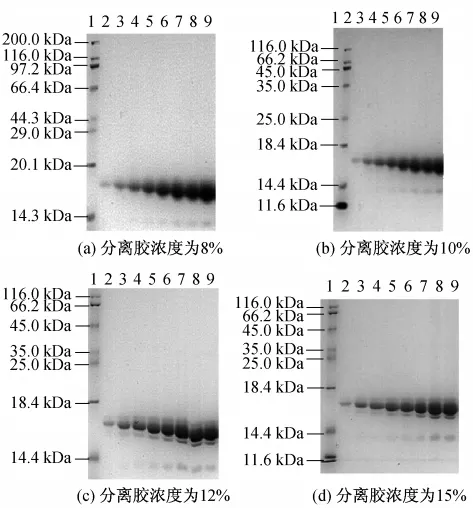
图5 上样量、分离胶浓度对电泳结果的影响Fig.5 Effects of prolamin amount per well volume and separation gel concentration on SDS-PAGE
2.5 优化条件对其他禾本科种子醇溶蛋白分析的可行性研究
取分离胶浓度为12%,大麦、玉米、苏丹草、高粱种子醇溶蛋白的上样量为每孔40 μg,进行电泳检测,结果如图6所示,其中1为标准蛋白,2~5分别为所提取的大麦、玉米、苏丹草、高粱的醇溶蛋白.可见,在该实验条件下,几种禾本科种子醇溶蛋白电泳图谱的谱带清晰,说明本实验所建立的条件不仅可以用于苏丹草醇溶蛋白的研究,也可以用于其他禾本科植物.
3 讨论
一般来说,醇类的极性随着碳链的增长而降低,但因为一个分子内羟基上的氧可以和另外一个分子上的氢形成氢键,所以容易造成极性的增加.种子醇溶蛋白提取剂的选择早期以乙醇为主,后来渐渐转变为正丙醇和叔丁醇[17].本实验除了选择上述3种试剂外,还同时研究了另外3种醇类试剂对苏丹草种子醇溶蛋白提取的影响.结果表明,不同的醇类试剂具有不同的提取效果,其中效果较好的是正丙醇、叔丁醇,这可能是由于组成苏丹草种子醇溶蛋白的氨基酸残基疏水性较强,相对于极性稍大的乙二醇和异丙醇,极性较弱的正丙醇和叔丁醇更有利于苏丹草种子醇溶蛋白的提取.
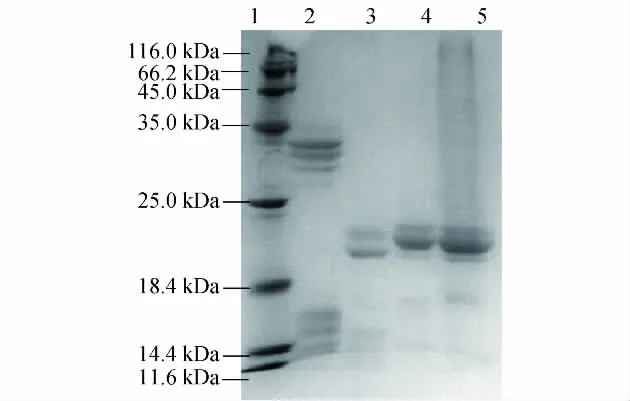
图6 几种禾本科种子醇溶蛋白电泳图Fig.6 Electrophoresis of prolamins of several common gramineae seeds
提取剂用量是影响醇溶蛋白提取的主要因素之一[14].司学芝等[15]在研究麦醇溶蛋白和谷蛋白的提取条件时,选择固液比在1∶6~1∶30之间.结果表明,随着提取剂的增加,提取的醇溶蛋白总量增高,但随后出现下降,说明提取剂的用量并非越多越好.本实验的结果也表明,随着提取剂的加入,提取到的醇溶蛋白总量增加,但提取效率呈现先上升后下降的趋势.综合考虑蛋白含量和浓度对SDS-PAGE条带的影响,最终选择固液比为1∶8.
研究表明,高粱属种子醇溶蛋白中含有较高水平的半胱氨酸残基和巯基[7,18].因此,还原剂的加入可增加醇溶蛋白的提取量,同时提高蛋白的多态性.DTT可用于蛋白质中二硫键的还原,阻止蛋白质中半胱氨酸之间形成的分子内或分子间二硫键.由本实验结果可知,加入DTT后谱带颜色加深,说明苏丹草种子醇溶蛋白的提取量变大.
传统的SDS-PAGE分离蛋白的方法较成熟,凝胶韧性好,易于剥离,电泳图谱较清晰[2,12].本实验结果表明,分离胶浓度对电泳图谱的影响较大.随着分离胶浓度的升高,醇溶蛋白特征谱带的清晰度也相应提高.12%和15%范围的凝胶可以得到比较清晰的电泳谱带,但在谱带的带型以及凝胶的后处理方面,12%的凝胶较好.根据苏丹草醇溶蛋白分子量大小,相对于8%浓度的分离胶,10%的凝胶谱带更加清晰可辨.10%凝胶的电泳时间虽短,但胶的牢固程度较低,易破裂;15%的凝胶的分辨效率较好,凝胶的质量也较好,但成胶的时间较长,实验时间跨度大.比较发现,可以根据不同的实验目的采用不同的分离胶浓度,如为了快速鉴定可采用10%的分离胶,若要准确分辨特征谱带可采用12%的分离胶.
醇溶蛋白的上样量也会影响电泳检测蛋白的结果.当蛋白量较小时,蛋白质各组分含量少,所结合的考马斯亮蓝少,着色浅,效果不好;相反,过高的上样量会使蛋白质含量过高,电泳条带颜色变深、带型变宽,相近的条带会出现重叠,不便识别.本实验结果表明,苏丹草醇溶蛋白的上样量以40 μg时合适.
本实验中的禾本科醇溶蛋白图谱表明,通过苏丹草种子优化的醇溶蛋白提取和电泳条件是可以应用于其他几种禾本科植物的,并可得到良好的分离效果.
[1] 王彦荣.我国牧草种子业的现状与发展[J].草业科学,1998,15(5):35-38.
[2] 兰海燕,李立会.蛋白质凝胶电泳技术在作物品种鉴定中的应用[J].中国农业科学,2002,35(8):916-920.
[3] 张彦萍,刘海河,马德伟,等.利用种子醇溶蛋白聚丙烯酰胺凝胶电泳鉴定洋葱品种类型[J].种子,2003 (2):16-20.
[4] WILLIAME W,JOHNE W,DONALDD K.Wheat varietal identification by capillary electrophoresisof gliadins and high molecular weight glutenin suhunits[J].Cereal Chem,1994,71(5):397-402.
[5] 张学勇,杨欣明,董玉深.醇溶蛋白电泳在小麦种质资源遗传分析中的应用[J].中国农业科学,1995,28 (4):25-32.
[6] QIP F,WEIY M,YUEY W,et a1.Biochemical and molecular charaeterization of gliadins[J].Mol Biol,2006,40:713-723.
[7] SHULLJ M,WATTERSONJ J,KIRLEISA W.Proposed nomenclature for the alcohol-soluble proteins(Kafirin)of Sorghum bicolor(L.Moench) based on molecular weight,solubility,and structure[J].J Agric Food Chem,1991,39:83-87.
[8] ZHANGX Y,YANGX M,DONGY C.Genetic analysis ofwheat germplasm by acid polyacrylamide gel electrophoresis of gliandins[J].Sci Agri Sin,1995,28 (4):25-32.
[9] 傅宾孝,于光华,王乐凯,等.小麦醇溶蛋白电泳分析的新方法[J].作物学报,1993,19(2):185-187.
[10] 王和平,张福耀,程庆军,等.高粱-苏丹草杂交草的研究与利用[J].杂粮作物,2000,20(4):20-23.
[11] 门中华,乌仁其木格,易津.不同类型苏丹草种子醇溶蛋白的研究[J].内蒙古草业,1999,5:28-30.
[12] 王伟,印丽萍,陈沁.高粱种子醇溶蛋白提取条件的研究[J].上海大学学报:自然科学版,2007,13(3):74-76.
[13] 王伟,印丽萍,刘许佳,等.种子醇溶蛋白提取及检测条件探索[J].西北植物学报,2007,27(1):21-27.
[14] 王祖华,杨瑞先,姬云波.小麦醇溶蛋白酸性聚丙烯酰胺凝胶电泳方法的优化及应用[J].中国农学通报,2009,25(20):54-57.
[15] 司学芝,李建伟,王金水,等.麦醇溶蛋白和麦谷蛋白提取条件的研究[J].郑州工程学院学报,2004,25 (3):33-39.
[16] 邵锦震,刘杏川.大麦醇溶蛋白酸性聚丙烯酰胺凝胶电泳条件的探索[J].湖北师范学院学报:自然科学版,2004,24(4):22-26.
[17] 颜启传,黄亚军,徐媛.试用1STA推荐的种子醇溶蛋白电泳方法鉴定大麦和小麦品种[J].作物学报,1992 (1):61-68.
[18] SHULLJ M,WATTERSONJ J,KIRLEISA W,et al.Purification and immunocytochemicallocalization of kafirins in Sorghum bicolor(L.Moench)endosperm[J].Protoplasma,1992,171(1/2):64-74.

