医疗器械不良事件统计分析系统开发的探讨
罗 亮
医疗器械不良事件是指获准上市的、合格的医疗器械在正常使用情况下发生的导致或可能导致人体伤害的任何与医疗器械预期效果无关的有害事件。由此可见,通过审批上市的医疗器械并不都是绝对安全的。因此,医疗器械不良事件监测是医院在医疗器械质控管理中的重要环节[1-3]。
以往医院通过填写纸质报告或在线报告的方式将情况上报至药监局后即完成了质检报告,医院自身缺乏对不良事件统计分析,达不到很好的监控效果,因此设计医疗器械不良事件统计分析系统具有实际价值和重要意义[4-6]。
1 统计分析系统开发工具
(1)应用程序部分:利用跟数据库结合较好的Power Builder软件进行系统主程序的开发工作[7-8]。(2)数据库部分:考虑到与在线不良事件上报系统导出数据的Excel表格连接的便捷性,笔者采用的是Office里的数据库软件Access。其他主流的数据库,如ORACLE、SQL Server也都可以采用。
1.1 数据库说明(见表1)
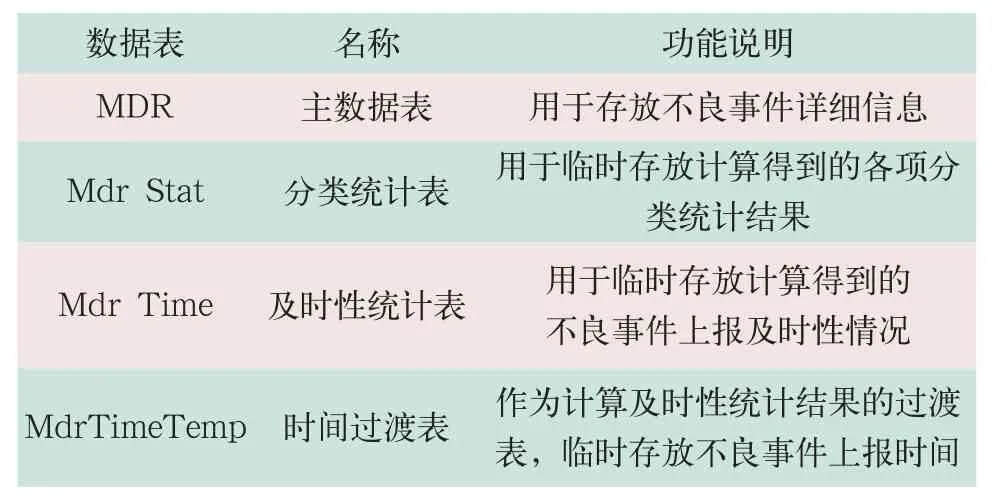
表1 数据库说明
1.2 数据导入
在使用系统对医疗器械不良事件进行统计分析前,需要先将相关数据进行导入。根据原有数据形式的不同,其相应导入的方式也有所不同。
(1)对于在线上报的电子版不良事件报告,可通过进入医疗器械不良事件上报系统(http://mdr2.8120.net),下载相应的数据Excel表格。完成后只需将表格导入到Access数据库相应的表中即可。
(2)对于通过纸质报告上报的不良事件,则需要手工将相应数据信息填写到数据库中。也可以通过系统新增功能模块完成。
2 系统功能介绍
本系统主要用于医院对所上报的医疗器械不良事件进行统计、查询、分析(如图1所示)。
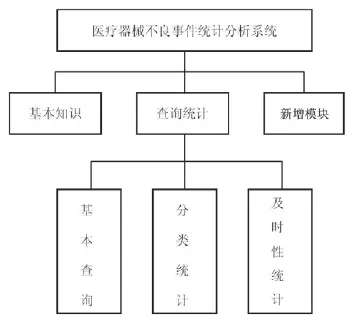
图1 功能模块介绍
如图2所示,用户在软件主界面点击选择相应的功能按钮即可进入对应的模块。
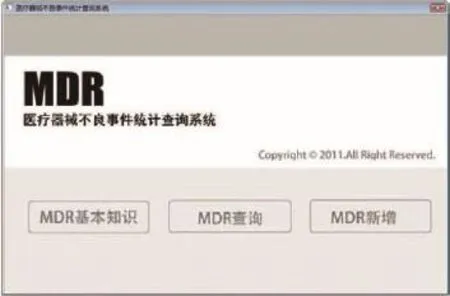
图2 软件主界面
2.1 基本知识
本模块存放医疗器械不良事件相关的基础知识,如:定义、报告原则等,便于使用者查阅(如图3所示)。
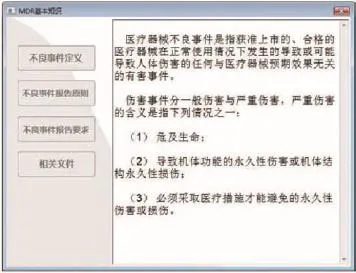
图3 基本知识模块界面
2.2 查询统计模块
使用者通过输入相应的搜索条件(如:年份、产品类别、产品属地等),点击“查询”按钮,系统即可筛选出符合条件的不良事件详细信息。同时,搜索条件及符合条件的事件总数也会显示在相应的窗口中以便于使用者查阅(如图4所示)。
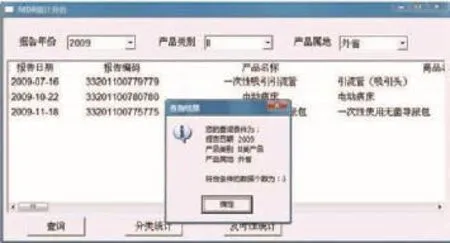
图4 基本查询结果
在该模块下还包含两个子功能模块,分别为分类统计模块和及时性统计模块。
(1)分类统计模块方便使用者对不良事件发生频率较高的医疗器械进行重点监管,以达到减少或避免同类不良事件在不同时间、地点的重复发生的目的。
使用者可以选择需要分类统计的条目(如:产品类别、产品分类等),医疗器械不良事件分类统计结果以百分比形式显示,并按比例从高到低进行排序。根据医疗器械不良事件报告要求,不同级别的事件要在规定的时限内及时上报(如图5所示)。
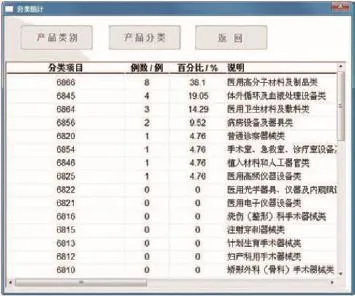
图5 按产品分类统计界面
(2)及时性统计模块便于使用者对医疗器械不良事件上报及时性进行监督,以保证能够及时有效的对不良事件进行处理和分析。系统会将每项医疗器械不良事件上报的时间进行汇总,形成报表(如图6所示)。
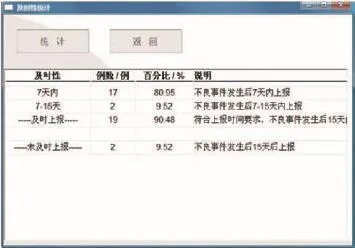
图6 及时性统计界面
2.3 新增模块
该模块是针对纸质报告设计,供使用者将纸质报告内容输入到系统数据库。
3 开发设想
为了提高医疗器械质控管理水平,还将对系统进行不断地完善,开发出具有风险预警功能和PDCA功能的新模块。
(1)风险预警功能:引入风险值概念,每种产品都有计算得到的一个风险值与其对应。
风险值 =∑(项目×权重)×发生频率系数
该项目对不良事件数据表中某些重要字段,如:产品类别、是否植入材料、事件后果等,根据不同风险值,系统会向用户提出处理或预警建议。
(2)PDCA循环功能:结合PDCA四阶段流程,系统定期汇总,并生成相应的PDCA报告。
(包括:事件报告、处理意见等内容)。
4 结语
目前,该系统能够对本院近年来上报的医疗器械不良事件进行较好的统计分析。为医院的医疗器械不良事件监测工作带来了便利[9-10]。随着系统功能的不断完善,作为医疗器械临床使用安全监督的重要环节本系统在日常工作中有较好的应用前景[11-12]。
[1]郑百华,乔静波.医疗器械不良事件的监测与管理[J].中国医药,2011,6(2):243-244.
[2]杨学军.完善我国医疗器械不良事件监测工作机制的思考[J].中国医疗器械信息,2011,17(3):24-26.
[3]刘斌,翟伟,马宁,等.医疗器械不良事件报告表质量评价方法探索[J].中国药物警戒,2011,8(3):165-168.
[4]王玲,王刚.医疗器械不良事件监测系统的建设与应用[J].中国医疗器械信息,2010,16(9):32-36,57.
[5]张小庄,罗坚,张国强.医院主动报告的不良事件特点分析及对策探讨[J].中华医院管理杂志,2009,25(8):544-546.
[6]曹德森,吴昊.医疗器械临床应用质量管理[J].中华医院管理杂志,2007,23(8):505-509.
[7]王凤英,崔国玮,邸建红.PowerBuilder数据窗口的创建和修改技巧[J].中国科技信息,2007(4):124-125.
[8]卢守东.PowerBuilder应用程序的数据库连接技术[J].科技情报开发与经济,2007,27(17):212-213.
[9]孟刚,王兰明,王亚东,等.对我国医疗器械不良事件监测技术体系工作机制和能力的初步调查[J].中国医疗器械信息,2006,12(4):24-26.
[10]海颖,孟刚,张素敏.医疗器械不良事件监测工作的信息化建设[J].中国药物警戒,2005,2(1):25-28.
[11]戴捷,冯璐琼,苏磊,等.医疗设备质量控制和标准化管理模式[J].中国医学装备,2011,8(1):32-34.
[12]黎明.综合性医院医疗设备应用质量控制问题及解决方法探讨[J].临床医学工程,2009,16(4):84-85.

