肝素通过TLR4减少脂多糖刺激的人内皮细胞IL-8表达*
李 旭, 李 鑫, 马晓春
(中国医科大学附属第一医院重症医学科,辽宁沈阳110001)
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性杆菌细胞壁外膜的一种成分,是导致脓毒症的主要因素[1]。LPS从细菌细胞膜脱落,与脂多糖连接蛋白(lipopolysaccharide-binding protein,LBP)相结合,连接到可溶型或膜型白细胞分化抗原(cluste of differentiation,CD)14,从而将其转运至 LPS/Toll样受体4(Toll-like receptor 4,TLR4)复合物,导致炎症介质的产生,如肿瘤坏死因子 α(tumor necrosis factor α,TNF- α),白细胞介素1β(interleukin-1β,IL-1β)、IL-6和IL-8,进而发生一系列炎症反应[2]。IL-8是一种典型的趋化因子,属于CXC类趋化性细胞因子家族,主要由单核细胞和巨噬细胞产生,成纤维细胞、上皮细胞、树突细胞和内皮细胞等也可以产生[3]。IL-8的主要功能是在炎症过程中促进中性粒细胞的募集、游走、趋化至炎症部位,释放多种炎症介质,引起炎症反应和组织损伤,在脓毒症过程中发挥重要作用[3]。近年来越来越多的研究表明内皮细胞在LPS引起的脓毒症多器官功能障碍等病理过程中起到关键作用[4]。内皮细胞是机体的主要炎症反应细胞,亦是LPS作用的靶细胞,它们衬覆于血管内壁构成血管通透性的主要屏障,能合成和分泌调节凝血-纤溶系统的物质,调节血管张力的因子以及细胞因子等,从而在创伤愈合及炎症反应中起到重要作用[5]。肝素(普通肝素,或称未分级肝素,unfractionated heparin,UFH)在临床应用中降低脓毒症患者发生弥散性血管内凝血、急性肾衰竭和多器官功能障碍的比率,并降低28 d病死率[6],但具体机制并不清楚,因此,本研究旨在探讨肝素对脂多糖刺激人内皮细胞IL-8水平的影响,并研究TLR4可能的影响,寻求肝素在临床脓毒症患者中应用的理论依据。
材料和方法
1 材料
人肺微血管内皮细胞株(HPMECs)购自上海拜力生物技术有限公司;胎牛血清(HyClone);DMEM培养基(HyClone);LPS(O55∶B5,Sigma);Trizol(Invitrogen);TaKaRa 反转录试剂盒(大连宝生物工程公司);人 IL-8 ELISA试剂盒购于R&D。其余均为国产分析纯试剂。
2 方法
2.1 细胞培养 HPMECs细胞培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2饱和湿度培养箱中培养,每隔1~2 d换液1次。
2.2 细胞处理及分组 按照1×109cells/L密度将HPMECs接种于6孔板,每孔2 mL。实验分为4组:正常对照组、LPS刺激组、LPS+普通肝素100 U/L组和LPS+普通肝素103U/L组。肝素作用组提前15 min应用既定浓度肝素,后加入10 mg/L浓度的LPS刺激;正常对照组应用相同剂量PBS。各组分别在培养2、6和12 h后收集细胞上清,测定上清中IL-8水平。于2、6和12 h收集细胞提取RNA,于-80℃保存。
2.3 细胞上清中IL-8水平测定 各组细胞分别在LPS作用2、6和12 h收集细胞上清,4 000 r/min离心20 min去除细胞碎屑,应用ELISA方法分析上清中IL-8的表达。操作严格按照试剂盒说明书进行,每组样本作3个复孔。
2.4 IL-8、CD14和 TLR4 mRNA表达测定 应用 Trizol提取细胞总RNA,紫外分光光度计测定总RNA浓度和纯度。应用反转录试剂盒进行反转录。采用real-time PCR测定。反应总体积:25 μL,加入 cDNA 2 μL。IL -8:上游引物 5’-CAC CGG AAG GAA CCA TCT CA -3’,下游引物5’-AGA GCC ACG GCC AGC TT -3’,各 1 μL,反应条件:95 ℃ 30 s,95℃ 15 s,60℃ 1 min,40个扩增循环。CD14:上游引物5’-CCC TAG CGC TCC GAG ATG -3’,下游引物 5’-GAA CGA CAG ATT GAG GGA GTT CA -3’,各1 μL,反应条件:95℃ 30 s,95 ℃ 5 s,52 ℃ 45 s,35 个扩增循环。TLR4:上游引物CCG AAG CCT TGG CGT TCT,下游引物 TCC CGG TAG TAC AGG CAG ATG,各1 μL,反应条件:94 ℃ 50 s,94 ℃ 5 s,72℃ 50 s,30个扩增循环。选取 β-actin作为内参照,IL -8、CD14 和 TLR4 mRNA 的相对表达量采用 2-ΔΔCt计算。
3 统计学处理
结 果
1 肝素对IL-8蛋白水平的影响
脂多糖刺激后IL-8蛋白表达明显增加,随着时间的延续逐渐上调,12 h达到高峰,肝素减少IL-8蛋白的表达,见图1。
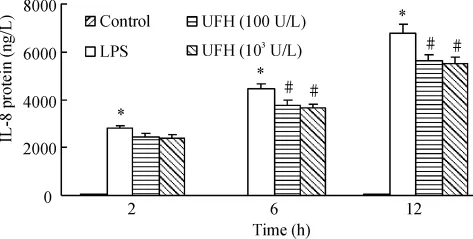
Figure 1.Effect of unfractionated heparin(UFH)on the expression of IL-8 protein induced by LPS in HPMECs.±s.n=3.*P <0.05 vs control group;#P <0.05 vs LPS group.图1 肝素对LPS刺激的HPMECs IL-8蛋白水平的影响
2 肝素对IL-8 mRNA水平的影响
脂多糖刺激后2 h IL-8 mRNA表达增高,随着时间的延续逐渐上调,在6 h达到高峰,肝素减少IL-8 mRNA的表达,见图2。F
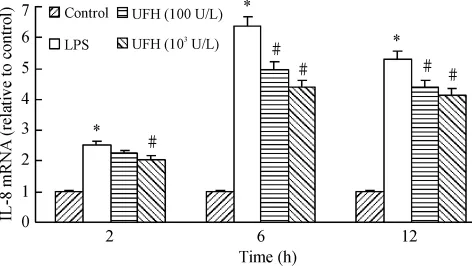
igure 2.Effect of UFH on the expression of IL-8 mRNA induced by LPS in HPMECs.±s.n=3.*P<0.05 vs control group;#P <0.05 vs LPS group.图2 肝素对LPS刺激的HPMECs IL-8 mRNA水平的影响
3 肝素对TLR4 mRNA水平的影响
脂多糖刺激后2 h TLR4 mRNA表达增高,随着时间的延续逐渐上调,在6 h达到高峰,肝素减少TLR4 mRNA的表达,见图3。
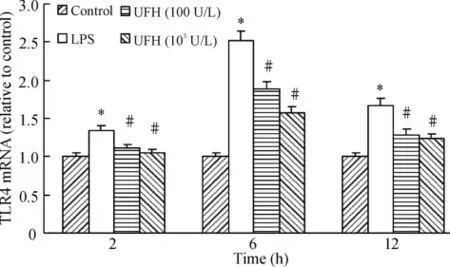
Figure 3.Effect of UFH on the expression of TLR-4 mRNA induced by LPS in HPMECs.±s.n=3.*P<0.05 vs control group;#P <0.05 vs LPS group.图3 肝素对LPS刺激的HPMECs TLR4 mRNA水平的影响
4 肝素对CD14 mRNA水平的影响
脂多糖刺激后没有检测到CD14 mRNA的表达。
讨 论
TLR4是目前最为广泛研究的TLR家族成员之一,迄今为止在人类共鉴定出了11种TLR(TLR1~TLR11),不同的TLR识别不同的配体,TLR4识别革兰氏阴性菌的 LPS[7]。CD14是锚定在单核细胞、巨噬细胞和多形核白细胞细胞膜表面的一种糖蛋白,分子量55 kD,其主要作为革兰氏阴性菌的LPS高亲和受体,介导细胞识别并捕获LPS,同时将信号向细胞内转导,激活细胞应答,在机体免疫、防御系统引起的一系列病理反应中起关键作用[8]。CD14以2种方式存在,膜型CD14(membrane-bound CD14,mCD14)和可溶型CD14(soluble CD14,sCD14),其中sCD14主要存在于血清和尿液中[9]。通常认为mCD14主要表达于单核细胞、巨噬细胞和中性粒细胞等骨髓细胞,非骨髓细胞则通过上清液中sCD14与LPS结合[10]。根据目前的研究,LPS可通过2条途径激活损伤的血管内皮细胞:一条途径是LPS与血清中的LBP和sCD14结合,再通过内皮细胞上TLR4-MD-2复合物将LPS信号转导至胞内,直接激活内皮细胞;另一条途径是LPS先激活单核细胞、T细胞等免疫活性细胞,使其释放TNF-α、IL-1β等细胞因子,间接激活血管内皮细胞[11]。本研究中,应用胎牛血清培养内皮细胞,其中含有sCD14,加入LPS刺激后,内皮细胞产生TLR4增加,并促进IL-8的表达,说明LPS通过TLR4信号途径促进内皮细胞发生炎症反应,与前期研究结果相一致。
肝素是一种天然形成的氨基葡聚糖,作为一种有效的抗凝剂在临床应用已超过半个世纪的时间。肝素的抗凝作用得到大家的公认,近年来,一系列临床和基础研究表明肝素还可以通过多种途径调节炎症反应。肝素抑制促炎因子的释放,包括 IL -1β、IL -6和 TNF - α[12]。肝素抑制缺血再灌注损伤中NF-κB介导的炎症反应,并通过增加一氧化氮和前列环素的生成减少了内皮细胞功能障碍[13]。在高动力性脓毒症中,肝素改善内皮细胞功能和血管反应性[14]。肝素减少了内毒素鼠TNF-α和IL-1β的表达,降低中性粒细胞集聚,减少肝血管中微血栓形成和纤维蛋白(原)沉积,并降低死亡率[15]。本研究中肝素减少了LPS刺激下内皮细胞IL-8的mRNA及蛋白表达,同时减少了TLR4 mRNA的表达,提示肝素可能通过调节TLR4信号途径发挥在脓毒症中的抗炎作用。
[1]Schletter J,Heine H,Ulmer AJ,et al.Molecular mechanisms of endotoxin activity[J].Arch Microbiol,1995,164(6):383-389.
[2]Nau GJ,Schlesinger A,Richmond JF,et al.Cumulative Toll-like receptor activation in human macrophages treated with whole bacteria[J].J Immunol,2003,170(10):5203-5209.
[3]Baggiolini M.Chemokines in pathology and medicine[J].J Intern Med,2001,250(2):91-104.
[4]Hack CE,Zeerleder S.The endothelium in sepsis:source of and a target for inflammation[J].Crit Care Med,2001,29(7 Suppl):S21-S27.
[5]Aird WC.Vascular bed-specific hemostasis:role of endothelium in sepsis pathogenesis[J].Crit Care Med,2001,29(7 Suppl):S28-S34.
[6]赵 聪,章志丹,张晓娟,等.小剂量肝素治疗脓毒症的临床分析[J].中华内科杂志,2009,48(7):566-569.
[7]Takeda K,Akira S.Microbial recognition by Toll-like receptors[J].J Dermatol Sci,2004,34(2):73 - 82.
[8]Haziot A,Chen S,Ferrero E,et al.The monocyte differentiation antigen,CD14,is anchored to the cell membrane by a phosphatidylinositol linkage[J].J Immunol,1988,141(2):547-552.
[9]Bazil V,Horejsí V,Baudys M,et al.Biochemical characterization of a soluble form of the 53-kDa monocyte surface antigen[J].Eur J Immunol,1986,16(12):1583 -1589.
[10]Malamed SF,Gagnon S,Leblanc D.Efficacy of articaine:a new amide local anesthetic[J].J Am Dent Assoc,2000,131(5):635-642.
[11]Issekutz AC,Lopes N.Endotoxin activation of endothelium for polymorphonuclear leucocyte transendothelial migration and modulation by interferon - gamma[J].Immunology,1993,79(4):600-607.
[12]Tyrell DJ,Kilfeather S,Page CP.Therapeutic uses of heparin beyond its traditional role as an anticoagulant[J].Trends Pharmacol Sci,1995,16(6):198 -204.
[13]Harada N,Okajima K,Uchiba M.Dalteparin,a low molecular weight heparin,attenuates inflammatory responses and reduces ischemia-reperfusion-induced liver injury in rats[J].Crit Care Med,2006,34(7):1883 -1891.
[14]Morrison AM,Wang P,Chaudry IH.A novel nonanticoagulant heparin prevents vascular endothelial cell dysfunction during hyperdynamic sepsis[J].Shock,1996,6(1):46-51.
[15]Ding R,Zhao D,Guo R,et al.Treatment with unfractionated heparin attenuates coagulation and inflammation in endotoxemic mice[J].Thromb Res,2011,128(6):e160-e165.

