c-Src在卵巢癌组织中的表达及其临床意义
薛 敏,周 玲
(1徐州医学院,江苏徐州221000;2徐州市妇幼保健院)
卵巢癌是女性生殖系统常见恶性肿瘤之一,也是病死率最高的妇科恶性肿瘤。其中卵巢上皮癌最为多见[1~3]。具有酪氨酸蛋白激酶活性的c-Src家族成员已被证明在调控细胞生存、增生、黏附、运动和细胞信号转导等方面发挥重要作用[4]。在肺癌、乳腺癌、结肠癌和胰腺癌等很多肿瘤组织中都存在c-Src蛋白的过表达[5]。c-Src在信号转导过程中起着枢纽作用,可以被多条信号通路活化,同时也可以激活多条信号通路,其中和肿瘤生成密切相关的信号通路 PTEN/PI3K/Akt/GSK-3β一直倍受关注。我们于2009年1月~2010年8月进行本研究,拟探讨c-Src蛋白对人卵巢癌SKOV-3细胞活性的影响及其可能作用机制,主要观察c-Src基因敲除对SKOV-3细胞c-Src蛋白表达、细胞增殖、细胞活性及血管生成相关蛋白血管内皮生长因子(VEGF)表达的影响,为进一步阐明卵巢癌发生发展机理提供理论基础和实验资料。
1 材料与方法
1.1 主要试剂、药品和设备 人卵巢癌细胞SKOV-3购自中科院上海细胞库,接种在含10%灭活胎牛血清的DMEM培养基中。胎牛血清购自杭州四季青生物工程材料研究所。流式细胞仪(Coulter Epics XL):美国 Beckman-Coulter公司。CO2培养箱(MCO-15AC):日本三洋公司。脂质体LipofectamineTM2000为美国Invitrogen公司产品;c-Src siRNA由上海吉玛制药公司合成;总RNA提取试剂TRIzol购自Invitrogen公司;十二烷基磺酸钠(SDS)购自Fluka公司;兔抗人c-Src蛋白多克隆抗体、辣根过氧化物酶(HRP)标记的羊抗兔IgG为Santa Cruz公司产品;增强化学发光试剂(ECL)为上海生工生物工程技术服务有限公司产品。
1.2 细胞培养和转染 卵巢癌细胞系SKOV-3接种于含10%灭活新生牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养液中,置于37℃、5%CO2、饱和湿度条件下培养,混合度达85%左右时,用1.25 g/L的胰酶消化传代。c-Src mRNA的siRNA的转染:细胞3×105个/孔接种于6孔板内,次日细胞融合度为40%~60%时,吸弃上清液,终体积为2 mL,将siRNA-LipofectamineTM2000复合体(复合体的配制按说明书操作)加到培养板中,转染体系为500 μL,siRNA终浓度为50 nmol/L,同时设立空白对照组和阴性对照组。继续放入37℃、5% CO2、饱和湿度培养箱中培养。
1.3 siRNA的设计制备 由WMG和Qigen两种siRNA在线设计软件设计针对c-Src mRNA的siRNA,c-Src mRNA序列来自NCBI(NM_001127190.1,GI:187475372),siRNA满足G/C含量<50%,且在正、反义3'端分别有2个TT游离碱基。以上siRNA序列均通过Blast比对,证实与人类基因外显子没有同源性。所有 siRNA均由上海吉玛公司合成和PAGE纯化,c-Src siRNA序列如下:正义链:5'-CAAGAGCAAGCCCAAGGAUTT-3',反义链:5'-AUCCUUGGGCUUGCUCUUGTT-3';阴性对照siRNA序列如下:正义链:5'-UUCUCCGAACGUGUCACGUTT-3',反义链:5'-ACGUGACACGUUCGGAGAATT-3'。
1.4 real-time PCR检测c-Src基因mRNA的表达①引物的设计:应用Primer Premier5.10软件设计,扫描人类基因库中未发现的其他同源。②Src:上游引物:5'-CACTCGCTCAGCACAGGACAG-3',下游引物:5'-AGAGGCAGTAGGCACCTTTCG-3',产物片段为196 bp;β肌动蛋白(β-actin):上游引物:5'-GTGGTGGTGAAGCTGTAGCC-3',下游引物:5'-GAGACCTTCAACACCCC-3',产物片段为230 bp。③RNA含量及纯度测定:收集实验各组细胞及对照组细胞,分别提取总RNA,测定RNA含量及纯度。④RT反应:20 μL反应体系,按照RT试剂盒操作步骤进行,合成cDNA。⑤PCR反应:20 μL反应体系,95℃预变性3 min;94℃ 45 s,55℃30 s,72℃ 45 s,共30个循环;72℃充分延伸7 min,结束温度为4℃。⑥结果与计算:各样品的目的基因和管家基因分别进行real-time PCR反应。根据绘制的梯度稀释DNA标准曲线,各样品目的基因和管家基因的浓度结果直接生成。每个样品的目的基因浓度除以其管家基因的浓度,即为此样品此基因的校正后的相对含量。
1.5 流式细胞术检测细胞生长周期 人卵巢癌细胞SKOV-3以3×105个/孔细胞数接种于6孔板中,37℃5%CO2培养,次日更换不含10%FBS的纯培养基,进行血清饥饿使细胞同步化,16~18 h后更换含10%FBS的完全培养基恢复细胞,14~16 h后进行转染,分别于转染后48 h,常规胰酶消化后,预冷的PBS(pH 7.4)洗涤2次,75%乙醇固定,PBS再次洗涤,加入1%Triton X-100 1 mL作用10 min,0.01%RNA酶1 mL处理10 min,最后以0.25%碘化丙啶(PI)染色20 min后,用流式细胞仪进行细胞周期的分析。
1.6 酶联免疫吸附法(ELISA)检测上清中VEGF的分泌 卵巢癌细胞SKOV-3细胞转染后48 h后收集细胞上清,ELISA检测VEGF蛋白分泌。VEGFELISA试剂盒购于Bender Med-Sytems公司,采用双抗体夹心ELISA法,严格按说明书操作。应用BIORAD3550-UV型酶标仪在波长450 nm条件下读取光密度值(OD值),计算机自动绘制标准曲线,并得出各组的VEGF的水平。
1.7 Western blot检测c-Src蛋白以及VEGF蛋白表达情况 卵巢癌细胞SKOV-3细胞转染后48 h收集细胞后提取总蛋白,常规胰酶消化,收集细胞沉淀,按每1×105细胞加200 μL细胞裂解液,混匀,置冰上充分裂解,12 000 r/min离心5min,取上清,考马斯亮兰法测定蛋白含量。取待测样品与6×蛋白上样缓冲液按1∶5混匀后煮沸5 min冷却,每个泳道加入20 μg样品,进行SDS-PAGE凝胶电泳,湿转法转移至PVDF膜上,1%BSA液封闭,4℃过夜,一抗室温孵育2 h,TBST液漂洗,二抗室温孵育1 h,TBST液漂洗3次,避光条件下加入碱性磷酸酶显色液进行显色,经图像分析系统进行光密度扫描分析。
1.8 统计学方法 采用SPSS13.0统计软件进行数据处理,数据以±s表示,行t检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 c-Src基因表达 real-time PCR显示:在干扰48 h后,转染 siRNA-Src组细胞 SKOV-3内 c-Src mRNA表达减弱明显,为0.017±0.006,与空白对照组(0.053±0.008)及阴性对照组(0.061± 0.008)比较,差异有统计学意义(P<0.05);空白对照组和阴性对照组中c-Src mRNA表达水平比较差异无统计学意义(P>0.05),表明转入阴性对照siRNA不会影响c-Src mRNA的表达。
2.2 流式细胞术检测结果 转染siRNA-Src组细胞S期(9.72%)低于阴性对照组(15.30%)和空白对照组(16.33%),表明c-Src能够一定程度地促进SKOV-3的细胞周期向S期转换,验证c-Src在卵巢癌细胞SKOV-3细胞增殖中发挥一定作用。
2.3 ELISA及Western blot检测结果 转染siRNASrc组的卵巢癌细胞SKOV-3上清中VEGF的表达明显下降,为 3.087±1.458,低于阴性对照组(9.125+1.703,P<0.01)和空白对照组(9.183± 2.965,P=0.021 7)。Western blot结果见图1,显示转染siRNA-Src组的细胞除了c-Src蛋白表达量明显下降外,VEGF的表达量也明显下降。
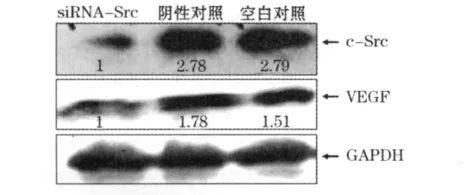
图1 Western blot检测结果
3 讨论
RNAi技术是内源或外源双链RNA(dsRNA)进入细胞后降解为2l~25个核苷酸组成siRNA,诱导同源特异性mRNA降解,使特异性蛋白合成减少,从而导致特定基因沉默(PTGS)[6]。目前RNAi已逐渐应用于基因功能检测、细胞信号转导途径分析、冗余基因确定和基因治疗等研究。
c-Src蛋白作为众多信号转导通路过程中的枢纽,参与许多调节细胞增生和浸润以及生长因子受体信号通路。目前发现的已有9个,即由Src、yes、lyn、fyn、lck、blk、fgr、hck和yrk原癌基因编码的产物组成,这些产物都有酪氨酸蛋白激酶活性。其编码的非受体蛋白酪氨酸激酶,分子量为60 kD。Src蛋白质产物由N端、Src同源域(SH)、激酶域和C端组成,SH从羧基端至氨基端依次命名为SH1、SH2、 SH3、SH4,其中SH1为酪氨酸蛋白激酶功能域,酶活性中心,有典型的酪氨酸蛋白激酶结构,ATP结合区和自身磷酸化位点;SH2和SH3是c-Src家族参与大分子之间作用和传递信号的分子基础;SH4与Src细胞膜内侧面的定位密切相关。
目前,c-Src基因在恶性肿瘤发生发展中分子机制的研究很少。虽然有研究发现,在乳腺癌中c-Src基因mRNA表达水平的上调与p53基因的静息有关,可能通过影响p53基因的功能在恶性肿瘤的进展中发挥作用;c-Src能和内皮细胞表面的VEGF受体相互作用,刺激内皮细胞增生;在肺腺癌A549细胞中,抑制c-Src酪氨酸激酶能够抑制体外增殖和浸润。然而,c-Src基因确切的分子作用机制还很不清楚。而肿瘤在生长过程中,由于生长速度过快,缺氧是卵巢上皮性癌血管生成拟态的主要诱导因素之一。在缺氧状态下,正常内皮细胞增殖抑制,无法为肿瘤生长提供足够血供,因此能为肿瘤的生长提供养分和转移途径的肿瘤血管成为治疗肿瘤的重要靶点之一,也越来越受到更多的学者的研究和重视。为了进一步研究抑制c-Src酪氨酸激酶对卵巢癌细胞血管生成能力的影响,本研究通过卵巢癌细胞转染siRNA-Src后,ELISA检测上清中VEGF的表达明显下降;免疫印迹法检测发现,转染siRNA-Src后,卵巢癌细胞SKOV-3细胞中随着c-Src蛋白表达量的下降,VEGF的表达也明显降低。而使用流式细胞术检测细胞周期亦发现,转染siRNA-Src明显抑制了卵巢癌细胞SKOV-3向S期的转化,抑制细胞的增殖。以上结果均表明:在卵巢癌细胞SKOV-3的增殖与血管生成过程中,c-Src蛋白起着至关重要的作用。
[1]Iorio MV,Visone R,Di Leva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Res,2007,67(18):8699-8707.
[2]Taylor DD,Gercel-Taylor C.MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J].Gynecol Oncol,2008,110(1):13-21.
[3]Zhang L,Volinia S,Bonome T,et al.Genomic and epigenetic alterations deregulate microRNA expression in human epithelial ovarian cancer[J].Proc Natl Acad Sci USA,2008,105(19): 7004-7009.
[4]Aleshin A,Finn RS.SRC:a century of science brought to the clinic[J].Neoplasia,2010,12(8):599-607.
[5]Masaki T,Igarashi K,Tokuda M,et al.pp60c-src activation in lung adenocarcinoma[J].Eur J Cancer,2003,39(10): 1447-1455.
[6]Agami R.RNAi and related mechanisms and their potential use for therapy[J].Curr Opin Chem Biol,2002,6(6):829-834.

