miR-205对黑色素瘤A375细胞增殖、黏附和迁移的影响及机制探讨
孙慧娟,胡纯婷,吴共发
(1中山市阜沙医院,广东中山510632;2南方医科大学基础医学院;3中山大学附属博济医院)
黑色素瘤是皮肤癌中最具侵袭性的肿瘤。虽然近年来检查手段及治疗方法均有进步,但死于黑色素瘤的人数约占所有因皮肤癌死亡人数的70%,且恶性黑色素瘤患者5年生存率只有15%,目前对黑色素瘤的治疗还是缺乏有效的方法。近年来微小RNA(miRNA)在黑色素瘤发生发展过程中的作用越来越被人们重视。2011年11月~2012年4月,我们通过研究miR-205对黑色素瘤细胞生物学行为的影响及可能机制,探讨黑色素瘤的发病机制。
1 材料与方法
1.1 材料 人类皮肤恶性黑色素瘤细胞系A375购自中国科学院上海生命科学研究院,总RNA提取试剂盒——RNAisoTMPLUS购自日本TaKaRa公司; miRNA qRT-PCR试剂盒购自美国GeneCopoeiaTM公司;miR-205的引物及内参U6的引物由杰特伟公司设计合成;miR-205 mimics及对应的阴性对照由上海吉玛公司设计并合成;胎牛血清及RPMI 1640培养基、阳离子脂质体LipofectamineTM2000及Opti-MEM培养基购自美国Invitrogen公司;Cell Counting Kit-8(CCK-8)试剂盒购自日本同仁化学有限公司;纤维连接蛋白购自美国Sigma公司;小牛血清白蛋白购自华美生物工程公司;多克隆兔抗人PTEN、p-AKT(ser473)、AKT为美国Bioworld产品;多克隆兔抗人β-actin为美国Santa Cruz Biotechnology产品;抗体稀释液、SDS-PAGE凝胶配制试剂盒、ECL反应检测试剂盒、总蛋白提取试剂盒购自碧云天生物技术;蛋白浓度检测试剂盒、胰酶购自南京凯基公司; PVDF膜为美国Millipore产品;辣根酶标记抗兔IgG购自北京中杉金桥公司。各种规格培养板购自美国Corning公司。
1.2 实验方法
1.2.1 细胞瞬时转染 待培养瓶中的A375细胞生长状态良好,铺满瓶壁90%时,胰酶消化细胞,吹打,制备成细胞悬液,3.0×105/孔的细胞数铺6孔板,铺板后20 h,细胞生长状态良好,通过瞬时转染上调miR-205表达,转染方法按照说明书进行,转染miR-205 mimics的细胞为实验组,转染 miR-205 mimics negative control的细胞为阴性对照组,另设置不做任何处理的细胞为空白对照组。转染48 h收集细胞RNA检测转染效率及收集蛋白用于Western blot实验。
1.2.2 转染效率检测 细胞总RNA的提取及逆转录反应按照说明书进行,荧光定量PCR反应体系为:2×All-in-OneTMQ-PCR Mix 10 μL,All-in-OneTMmiRNA Q-PCR Primer(2 μmol/L)2 μL,Universal Adaptor PCR Primer(2 μmol/L)2 μL,1ststrand cDNA (diluted 1∶5)2 μL,RNase/DNase free ddH2O 4 μL,终体积20 μL。在PCR反应管中充分混匀反应体系,短暂离心,置入ABI 7500荧光定量PCR仪中进行反应。反应条件为:95℃预变性10 min,95℃变性10 s,60℃退火20 s,72℃延伸10 s,40个循环,检测荧光信号;溶解曲线分析:95℃ 15 s,60℃ 1 min,95℃ 30 s,60℃ 15 s。以Folds=2-ΔΔCt表示目的miRNA在实验组与对照组中表达的倍比关系,采用如下计算公式:ΔΔCt=[Ct(miRNA)-Ct (U6)]实验组-[Ct(miRNA)-Ct(U6)]对照组,重复3次实验。阴性对照组为对照组,其余2组与之进行比较,
1.2.3 CCK-8检测细胞增殖变化 细胞0.5×104/孔均匀接种于96孔板,终体积100 μL/孔,每组6个复孔,铺板后20 h转染。转染48 h,每孔加10 μL CCK-8,置37℃,50 mL/L CO2培养箱避光孵育2 h后,用酶联免疫检测仪于450 nm测定吸光度值(OD值),每组设4个复孔取平均值。
1.2.4 细胞黏附能力检测 将浓度为50 μg/mL的纤维黏连蛋白75 μL加入96孔培养板中,用37℃预热的PBS小心冲洗2次,加入10 g/L缓冲液稀释的小牛血清白蛋白(100 μL/孔),以封闭非特异性位点。PBS冲洗2次,3组细胞用RPMI 1640培养基制成细胞悬液,浓度均为1×105/mL,以100 μL/孔的量将肿瘤细胞悬液加入96孔培养板中置37℃,50 mL/L CO2培养箱中孵育2 h。培养结束后,倒置显微镜观察,之后缓慢吸出培养液,PBS冲洗未黏附的细胞2次,加入含2%胎牛血清的 RPMI 1640培养基200 μL,每孔加20 μL CCK-8,置37℃,50 mL/L CO2培养箱避光孵育2 h后,用酶联免疫检测仪于450 nm测定OD值,每组设4个复孔取平均值。
1.2.5 细胞划痕实验 预先在6孔板板底作3条标记线,细胞转染18 h后,取出6孔板,用10 μL移液器枪头轻轻地沿直尺垂直于标记线呈“丨”划过板底,PBS清洗细胞2次以洗去漂浮细胞,然后换上2%的胎牛血清培养基,减少细胞增殖对实验结果造成的影响。在划痕后的不同时间点拍照,动态观察3组细胞的迁移情况。
1.2.6 Western blot检测 转染48 h时PBS洗细胞3次,细胞刮刀将细胞刮下离心收集,-80℃冰箱保存备用。按全蛋白提取试剂盒说明书提取蛋白并测蛋白浓度,每泳道加40 μg蛋白进行SDS-PAGE电泳,湿转将蛋白转至PVDF膜,印迹膜在含5%脱脂奶粉的PBST缓冲液内室温封闭1 h,加入一抗(PTEN、磷酸化 AKT、AKT、β-actin稀释度分别为1∶500、1∶200、1∶1 000、1∶1 000)4℃过夜孵育,洗膜,加人辣根酶标记抗兔IgG(1∶5 000稀释),室温孵育1 h,PBST洗膜,ECL化学发光法检测,β-actin为内对照。
1.3 统计学方法 采用SPSS13.0统计软件,数据用±s表示,转染效率采用两独立样本t检验分析,其余数据采用one-way ANOVA分析,多重比较采用LSD法,方差不齐则采用Dunnett's法,以P≤0.05为差异有统计学意义。
2 结果
2.1 miR-205上调效率 实验组miR-205表达是阴性对照组的(213.770±12.577)倍,差异具有统计学意义(t=29.301,P=0.000),阴性对照组和空白对照组间miR-205表达无显著差异(t=-0.804,P=0.506),说明在A375细胞中成功上调miR-205表达。
2.2 细胞增殖变化 实验组、阴性对照组、空白对照组OD值分别为0.748±0.083、1.241±0.057、1.225±0.054,3组比较差异有统计学意义(F= 139.007,P=0.000)。实验组OD值较阴性对照组及空白对照组均减少(P=0.000,P=0.000),而后2组差异无统计学意义(P=0.305)。说明上调miR-205的表达能减低A375细胞的增殖能力。
2.3 各组细胞黏附能力的改变 实验组、阴性对照组、空白对照组OD值分别为0.29±0.24、0.58± 0.32、0.59±0.21,3组比较差异有统计学意义(F= 166.349,P=0.000)。结果显示实验组的黏附能力减低(P<0.05)。
2.4 划痕实验结果 在A375细胞上调miR-205表达后,实验组细胞在36 h和60 h时间点的划痕愈合程度均低于空白对照组和阴性对照组,后两者的划痕愈合程度无显著差别,见插页Ⅰ图6。
2.5 Western blot结果 在A375细胞上调miR-205表达后,PTEN蛋白表达增加,磷酸化AKT蛋白表达减少,但对非磷酸化的AKT蛋白没有影响,空白对照组和阴性对照组各蛋白表达均无差异,见图1。
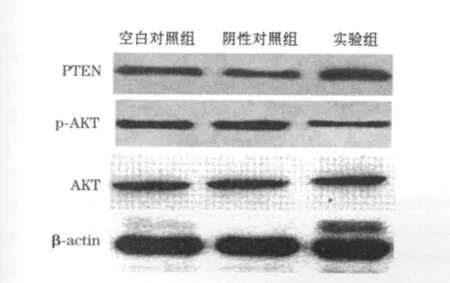
图1 miR-205对PTEN/AKT通路蛋白影响
3 讨论
黑色素瘤是一种高度恶性肿瘤,常见于皮肤,其进展迅速,极易转移,临床预后极差,严重危害人类健康。黑色素瘤的发生经历一个多步骤的过程,包括从正常色素细胞—色素痣—原位癌—扩大生长—浸润生长。在对黑色素瘤分子形成机制的大量研究中,miRNA起着至关重要的作用。目前关于miRNA在黑色素瘤中的作用相比于其他肿瘤的报道较少,且大部分研究来源于其他肿瘤。miRNA是一类广泛存在于真核生物中,大小约21~25个核苷酸的非编码单链小分子RNA,它通过与靶基因mRNA特异性结合,导致mRNA降解或蛋白质翻译的抑制,从而在转录后水平调控基因的表达,参与生物复杂生命过程的调控。已证实miRNA在肿瘤的发生和发展过程中扮演着重要角色。
miR-205是在多种物种间高度保守的一个miRNA,2007年被证实存在于人类[1]。随后研究证实miR-205在多种肿瘤中起抑癌基因的作用,在多种肿瘤中表达下调,通过恢复其表达后,能抑制肿瘤细胞生长、侵袭和转移[2~4]。在黑色素瘤中,过表达miR-205能抑制黑色素瘤细胞增殖、多克隆形成和动物体内肿瘤形成等,被认为是黑色素瘤的抑癌基因,并且miR-205通过调节AKT磷酸化水平影响细胞增殖能力[5]。在小鼠乳腺上皮细胞中,已证实抑癌基因PTEN是小鼠miR-205的靶基因[6]。PTEN是否为人类miR-205的直接靶基因未见文献报道。我们通过多种生物信息学软件预测发现(http:// www.targetscan.org/,http://www.microrna.org/microrna/home.do,http://cbio.mskcc.org/mirnaviewer/),PTEN是人miR-205的潜在靶基因。这可能与miR-205在多个物种间具有高度保守性有关。虽然miR-205通过调控AKT通路活性影响黑色素瘤细胞增殖[5],但黑色素瘤中miR-205与PTEN/AKT通路之间的关系未见报道。
本研究通过在人皮肤黑色素瘤细胞系A375中瞬时转染上调miR-205,观察细胞增殖、黏附、迁移能力的变化及PTEN/AKT通路之间的关系,进一步阐明黑色素瘤的病因机制。研究结果显示,上调miR-205表达后细胞增殖、黏附和迁移能力均显著减低,而Western blot结果显示上调miR-205表达能增加PTEN蛋白表达,减低磷酸化AKT蛋白水平,但对非磷酸化的AKT蛋白表达无影响。PTEN是公认的肿瘤抑制基因,它通过对细胞内蛋白质磷酸化水平的精细调节,影响细胞生长、增殖、分化、凋亡、黏附和迁移等重要生物学行为。大量研究证实PTEN通过干扰一些信号通路能控制肿瘤细胞生长,抑制肿瘤黏附和迁移[7]。PTEN能使PI3K的3-磷酸化位点去磷酸化和负向调节AKT信号通路,使AKT磷酸化水平下降,已知AKT信号通路调节肿瘤细胞存活、增殖和运动能力[8,9],其磷酸化水平即活性减低能抑制肿瘤细胞的增殖、黏附、迁移和侵袭转移能力。结合本研究结果,提示在黑色素瘤中,上调miR-205能减弱肿瘤细胞增殖、黏附和迁移能力,这些生物学行为的改变时通过调控增强PTEN蛋白和减低AKT活性水平介导实现的。但由于miRNA具有广泛生物学调控功能,miR-205影响黑色素瘤细胞生物学行为的机制仍然有待进一步研究。
[1]Landgraf P,Rusu M,Sheridan R,et al.A mammalian microRNA expression atlas based on small RNA library sequencing[J].Cell,2007,129(7):1401-1414.
[2]Wu H,Zhu S,Mo YY.Suppression of cell growth and invasion by miR-205 in breast cancer[J].Cell Res,2009,19(4):439-448.
[3]Gandellini P,Folini M,Longoni N,et al.miR-205 Exerts tumorsuppressive functions in human prostate through down-regulation of protein kinase Cepsilon[J].Cancer Res,2009,69(6):2287-2295.
[4]Gregory PA,Bert AG,Paterson EL,et al.The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1[J].Nat Cell Biol,2008,10(5):593-601.
[5]Dar AA,Majid S,de Semir D,et al.miRNA-205 suppresses melanoma cell proliferation and induces senescence via regulation of E2F1 protein[J].J Biol Chem,2011,286(19):16606-16614.
[6]Greene SB,Gunaratne PH,Hammond SM,et al.A putative role for microRNA-205 in mammary epithelial cell progenitors[J].J Cell Sci,2010,123(Pt 4):606-618.
[7]Stewart AL,Mhashilkar AM,Yang XH,et al.PI3 kinase blockade by Ad-PTEN inhibits invasion and induces apoptosis in RGP and metastatic melanoma cells[J].Mol Med,2002,8(8):451-461.
[8]Testa JR,Bellacosa A.AKT plays a central role in tumorigenesis[J].Proc Natl Acad Sci U S A,2001,98(20):10983-10985.
[9]Chen RH,Chang MC,Su YH,et al.Interleukin-6 inhibits transforming growth factor-beta-induced apoptosis through the phosphatidylinositol 3-kinase/Akt and signal transducers and activators of transcription 3 pathways[J].J Biol Chem,1999,274(33): 23013-23019.

