胃癌细胞系幽门螺杆菌感染对HIF-1α、HIF-2α及VEGF表达的影响
吴海滨 张乐鸣
胃癌是常见的恶性肿瘤,位居肿瘤死因和常见肿瘤的第2位和第4位[1]。目前,外科手术和抗肿瘤治疗未能改善胃腺癌的不良预后,5年生存率仅是5% ~17%,其浸润和转移是影响预后的主要因素[2]。幽门螺杆菌(Helicobacter pylori,H.pylori)已经被确认为胃癌的重要病因之一,其与胃癌的不良预后相关。研究显示幽门螺杆菌阳性的胃癌易发生转移,且动物实验表明幽门螺杆菌能促进胃癌的肺转移[3,4]。长期随访研究显示根除幽门螺杆菌可逆转胃癌癌前病变,提示幽门螺杆菌有促进胃癌浸润转移的作用[5]。魏军等发现H.pylori-L型感染增强了胃癌细胞的侵袭和转移能力[6]。目前H.pylori与胃癌侵袭转移的确切机制尚不完全清楚。而血管内皮生长因子(vascular endothelial growth factor,VEGF)是促进肿瘤侵袭和转移重要因子,HIF-1α和 HIF-2α可调控VEGF的表达,是恶性肿瘤诱导新生血管形成的主要调控因子。因此,我们把H.pylori与人胃腺癌细胞株BGC-823共培养,观察BGC-823细胞增殖情况并对HIF-1α、HIF-2α及VEGF表达情况进行检测,以探讨幽门螺杆菌感染对胃癌侵袭转移能力的影响及可能诱导胃癌血管生成机制。
材料与方法
1.材料:RPMI1640培养基、胰蛋白酶均购自(GIBoC公司);胎牛血清(FCS,杭州四季青公司);5%四甲基偶氮唑蓝(MTT溶液,上海华美生物工程公司),总RNA提取试剂Trizol(北京天根公司);MMIV第1链cDNA合成试剂盒及PCR扩增试剂盒(fermentas);1000bp DNA ladder及PCR引物由上海生物工程公司合成。微需氧产气袋(oxoid公司);哥伦比亚血平板(梅里埃公司);兔抗人HIF-1α和HIF-2α抗体(Genetex公司);VEGF多克隆抗体(北京博奥森公司);HRP标记的羊抗兔二抗购自(北京博奥森公司);ECL试剂盒购自美国Thermo公司;RIPA蛋白裂解液及BCA蛋白定量试剂盒购自江苏碧云天公司。H.pylori国际标准菌株(NCTC11637)由浙江大学医学院馈赠,人胃腺癌细胞株BGC-823购自杭州泽衡生物科技有限公司。
2.方法:(1)细胞培养:选用人胃腺癌细胞株BGC-823,在含10%FCS的RPMI1640细胞培养基中加青霉素100U/ml及链霉素100mg/ml,37℃,5%CO2及饱和湿度培养。(2)H.pylori菌悬液的制备:在无菌条件下,以划线培养方式将H.pylori接种于哥伦比亚血平板,置于37℃微需氧袋中培养,3~5天后收集针尖样透明菌落,用PBS制成悬液,于分光光度计上调节 H.pylori浓度至1×108CFU/ml(A660=l×108CFU/ml),并将H.pylori菌液连续4次作10倍稀释调节至(1×103CFU/ml、1 × 104CFU/ml、1 × 105CFU/ml、1 × 106CFU/ml和 1 ×107CFU/ml)。(3)MTT法检测细胞存活率:BGC-823细胞接种于5×105每孔含洁净小盖玻片的24孔培养板中,每个样本做3个复孔,过夜,待细胞贴壁后,加入不同浓度的H.pylori悬液,其中加入 1 ×103CFU/ml、1 ×104CFU/ml、1 ×105CFU/ml、1 ×106CFU/ml和 l×107CFU/ml的 H.pylori活菌悬液分别称为试验组1、试验组2、试验组3、试验组4和试验组5,对照组加稀释用培养液,每种细胞重复3孔。与BGC-823细胞共孵育12、24、36和48h后弃培养液,每孔加MTT 20μl(浓度为5mg/ml),放置孵箱内4h后弃上清加入10%的SDS 200μl,过夜。震荡15min,用全自动酶标仪(美国Biorad公司)检测570nm处的吸光度值(A值)。计算细胞存活率(%)=实验组A值/对照组A值。(4)H.pylori悬液和BGC-823细胞共培养:①取对数生长期的BGC-823细胞用含0.2g/L EDTA和1.5g/L胰蛋白酶消化后计数,接种于5×105每孔含洁净小盖玻片的12孔培养板中,过夜;②将稀释好的H.Pylori活菌悬液加入过夜后贴壁的BGC-823细胞中,加入1×103CFU/ml、1 ×104CFU/ml、1 ×105CFU/ml的 H.Pylori活菌悬液分别称为试验组1、试验组2和试验组3,对照组加稀释用培养液,每种细胞重复3孔;③培养24h后收集细胞,分别进行RTPCR、Western blotting检测。(5)RT-PCR 检测 HIF-1α,HIF-2α和VEGFmRNA的表达:用RNA提取试剂Trizol提取总RNA,紫外分光光度计测样品浓度,琼脂糖凝胶电泳鉴定RNA完整性,用MMLV第1链cDNA合成试剂盒反转录合成cDNA,按说明书操作。取反转录产物进行PCR反应(95℃预变性 3min,94℃变性 1min,55℃复性 1min,72℃延伸 1min,30 个循环,72℃延伸10min)。HIF-1α的引物上游为;5'AGCCGCTGGAGACACAAT-3'和下游为5'-TCGGAAGGACTAGGTGTCTGA-3',扩增长度为302bp;HIF-2α的引物上游为;5'-CCCTTCCTCCTGGACAAGTTTC-3',下游为 5'-CCCTGAGGTTCTTCATCCGTTT-3',扩增长度为490bp;VEGF的引物上游为:5'GCCTTGCTGCTCTACCTC-3',下游为5'GGCACACAGGATGGCTTG-3',扩增长度为200bp;内对照β-actin的引物上游为:5'-ACGGCATCGTCACCAACT-3'和下游为5'-CAATGCCAGGGTACATGGT-3',扩 增 长 度 为 710bp。PCR扩增产物用1.5琼脂糖凝胶电泳,溴化乙锭染色显示,用Quantity One凝胶图像分析系统分析,以 HIF-1α、HIF-2α mRNA/β-actin mRNA电泳带的吸光度比值作为HIF-1α、HIF-2α及VEGF mRNA的相对表达量指标。(6)Western blotting检测HIF-1α,HIF-2α和VEGF蛋白表达:弃培养液后PBS冲洗细胞3次,加入预冷的RIPA裂解液150μl,RIPA裂解液预先加PMSF 1.5μl使终浓度为1mmol/L。操作于冰上进行,4℃下10000r/min(离心半径为4cm)离心5min取上清液,BCA法测蛋白浓度后,99℃ 变性10min。取50μg蛋白行10%SDSPAGE电泳,半干法电转移法100V恒压电泳1h,将蛋白转印到PVDF膜上。室温下用脱脂奶粉封闭1h后加一抗(兔抗人HIF-1α、HIF-2α,和 VEGF多克隆抗体,工作浓度是1∶1000),4℃孵育过夜,洗膜;加HRP标记的二抗(羊抗兔 IgG抗体,工作浓度1∶1000),37℃,孵育 1h,ECL 试剂于暗室自显影。Western blotting图像存入计算机,用ImageJ 1.44p图像分析软件包进行光密度计算。
3.统计学方法:本研究采用SPSS 13.0统计软件进行分析,数据用均数±标准差(±s)表示,进行ANOVA检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
结 果
1.MTT法检测细胞存活率:MTT法检测细胞存活率见图1,表1,BGC-823细胞与低浓度的H.pylori悬液(1×103CFU/ml、1×104CFU/ml和 1×105CFU/ml)共孵育 12、24、36、48h 后,实验组细胞存活率较对照组显著增高,差异均有统计学意义(P<0.05)。与高浓度的 H.pylori悬液(1 ×106CFU/ml和1 ×107CFU/ml)共孵育 12、24、36、48h 后,实验组细胞存活率较对照组显著降低,差异均有统计学意义(P <0.05)。
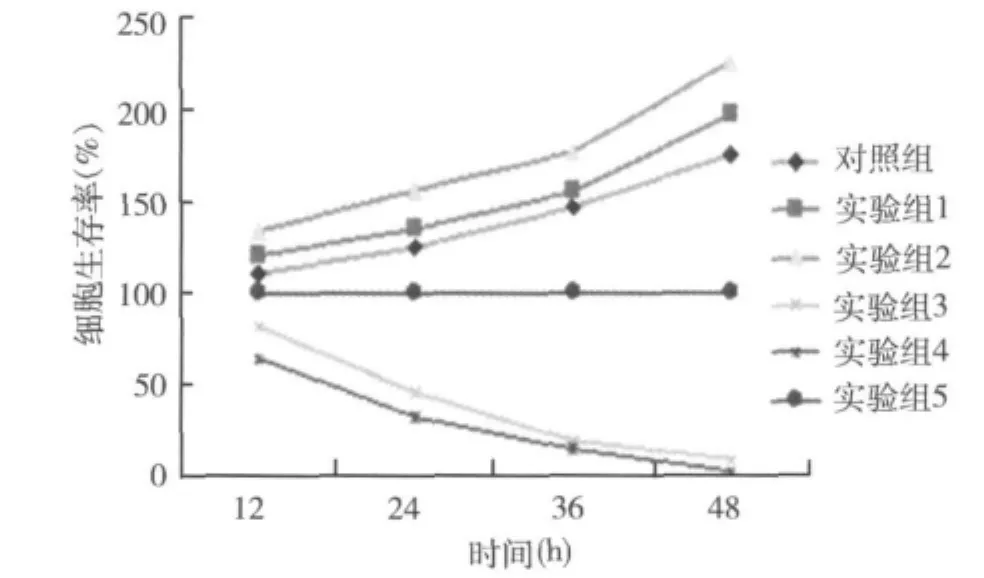
图1 BGC-823细胞与不同浓度的H.pylori悬液共孵育后细胞存活曲线(MTT法)
2.BGC-823细胞 HIF-1α 、HIF-2α 及 VEGF mRNA的表达:RT-PCR电泳结果见图2,mRNA相对表达量见表2。表2显示,H.pylori刺激24h后,对照组和试验组比较,试验组1、试验组2和试验组3与对照组比较条带明显变宽,试验组1、试验组2、试验组3与对照组之间差异均有统计学意义(P<0.05)。随着试验组H.pylori浓度的增加,条带逐渐变宽。
表1 MTT法检测细胞存活率(%,±s,n=3)
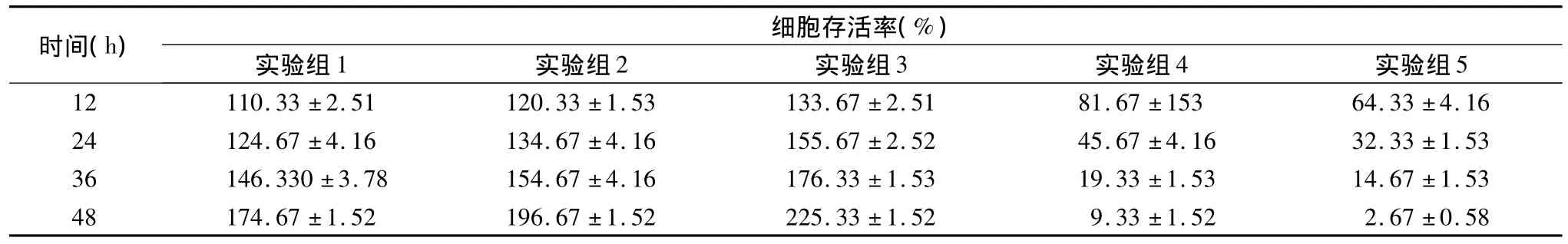
表1 MTT法检测细胞存活率(%,±s,n=3)
时间(h)细胞存活率(%)实验组1 实验组2 实验组3 实验组4 实验组5 12 110.33 ±2.51 120.33 ±1.53 133.67 ±2.51 81.67 ±153 64.33 ±4.16 24 124.67 ±4.16 134.67 ±4.16 155.67 ±2.52 45.67 ±4.16 32.33 ±1.53 36 146.330 ±3.78 154.67 ±4.16 176.33 ±1.53 19.33 ±1.53 14.67 ±1.53 48 174.67 ±1.52 196.67 ±1.52 225.33 ±1.52 9.33±1.52 2.67 ±0.58
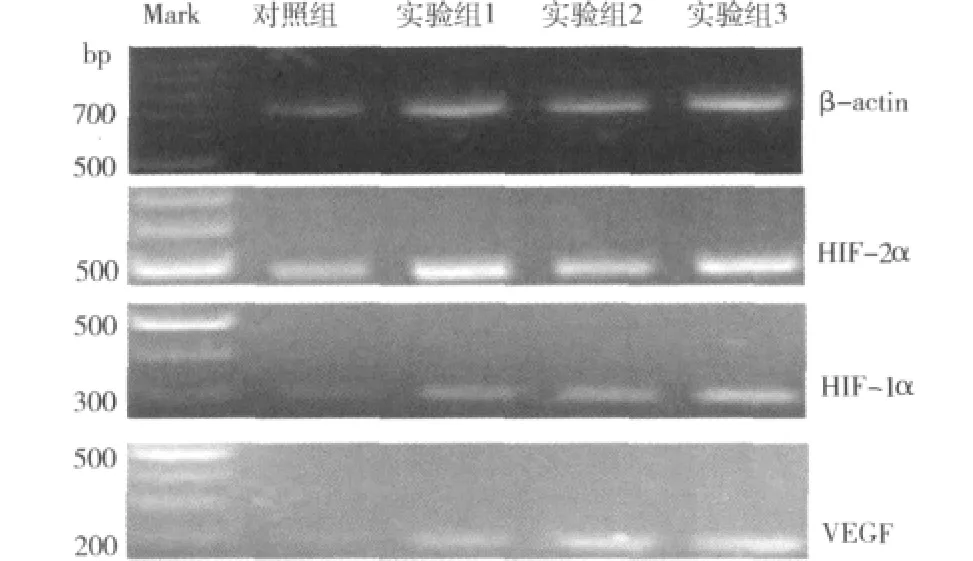
图2 RT-PCR检测
表2 HIF-1α、HIF-2α及VEGF mRNA相对表达量(±s,n=3)

表2 HIF-1α、HIF-2α及VEGF mRNA相对表达量(±s,n=3)
VEGF对照组组别 n HIF-1α HIF-2α 3 0.43 ±0.04 2.07 ±0.02 1.31 ±0.11实验组1 3 0.79 ±0.04 2.41 ±0.02 1.67 ±0.04实验组2 3 0.99 ±0.05 2.84 ±0.05 2.06 ±0.04实验组3 3 1.28 ±0.05 3.14 ±0.09 2.39 ±0.06
3.BGC-823细胞 HIF-1α 、HIF-2α 及 VEGF蛋白的表达:Western blotting检测结果见图3、表3。表3显示H.pylori刺激24h后,对照组和试验组比较,试验组1、试验组2和试验组3与对照组比较条带明显变宽,试验组1、试验组2、试验组3和对照组之间差异均有统计学意义(P<0.05)。随着试验组H.pylori浓度的增加,条带逐渐变宽。
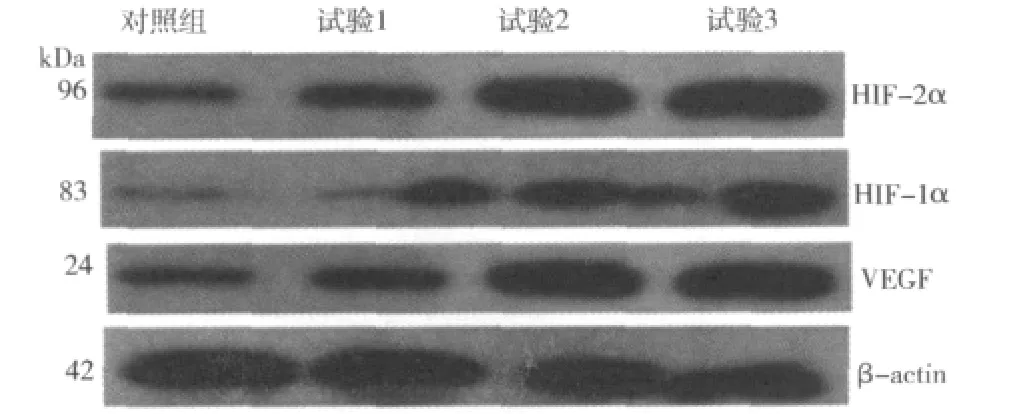
图3 Western blotting检测BGC-823细胞HIF-1α、HIF-2α及VEGF蛋白的表达
表3 各组BGC-823细胞HIF-1α、HIF-2α及VEGF蛋白的表达(±s,n=3)
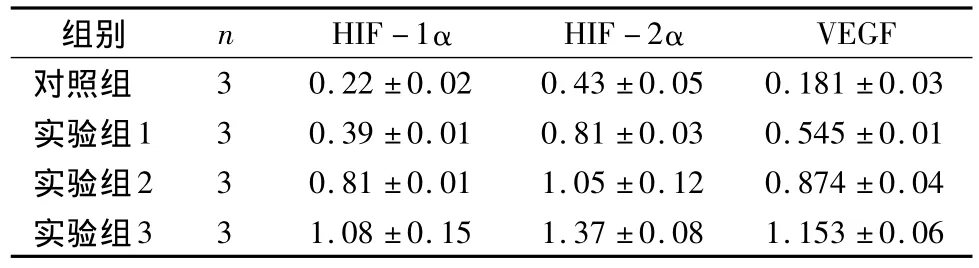
表3 各组BGC-823细胞HIF-1α、HIF-2α及VEGF蛋白的表达(±s,n=3)
VEGF对照组组别 n HIF-1α HIF-2α 3 0.22 ±0.02 0.43 ±0.05 0.181 ±0.03实验组1 3 0.39 ±0.01 0.81 ±0.03 0.545 ±0.01实验组2 3 0.81 ±0.01 1.05 ±0.12 0.874 ±0.04实验组3 3 1.08 ±0.15 1.37 ±0.08 1.153 ±0.06
讨 论
有研究报道AGS细胞与H.pylori活菌上清活菌体破裂物共培养后,其增殖速度加快,表明H.pylori活菌与胃癌增殖具有相关性。吴海波等研究发现H.pylori-L型作用BGC-823细胞后,细胞分裂增多,增殖旺盛,瘤巨细胞增多,出现明显的生长加速现象[7]。吴莺等[8]研究发现 H.pylori超声提取液可诱导胃癌细胞BGC-823细胞出现蜂鸟表型,凋亡抑制基因Survivin mRNA表达上调、凋亡基因caspase-3 mRNA表达下降,表明H.pylori可能通过上调凋亡抑制基因survivin、下降凋亡基因caspase-3的表达来促进BGC-823细胞的增殖。本研究发现,当H.pylori悬液浓度在低浓度(1×103CFU/ml、1×104CFU/ml和1×105CFU/ml)时能显著促进BGC-823细胞的增殖,且随着浓度的增加和作用时间的延长,BGC-823细胞的增殖呈增高趋势,而高浓度的H.pylori悬液(1×106CFU/ml和1×107CFU/ml)显著抑制BGC-823细胞的增殖,且随着浓度的增加和作用时间的延长,BGC-823细胞的抑制呈增高趋势,说明H.pylori感染浓度和时间可能对胃癌的生长起重要作用。因此,我们选择低浓度的H.pylori悬液与BGC-823细胞共培养24h后,检测 HIF-1α、HIF-2α及VEGF表达情况。
有研究发现,H.pylori阳性的胃癌细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)比H.pylori阴性的胃癌细胞过表达,并表现出更强的侵袭和转移能力[9,10]。而肿瘤侵袭转移的过程与新生血管生成密切相关,肿瘤的生长和浸润转移依赖于血管生成,VEGF是肿瘤诱导产生新生血管的最重要的细胞因子。本实验结果显示H.pylori感染人胃癌细胞BGC-823 24h后VEGF过表达,差异有统计学意义(P<0.05),并且随着 H.pylori浓度的增加,VEGF呈增高趋势,提示H.pylori感染可能通过刺激VEGF表达而影响肿瘤新生血管的生成,从增加胃癌细胞的浸润转移能力。
肿瘤血管的生成需要促血管生成因子的作用,研究发现HIF-1α和HIF-2α是重要的促血管生成因子,HIF-1α和HIF-2α可调控VEGF的表达。研究证实缺氧或某些基因突变可活化HIF-1α与VEGF基因的调控序列相结合,从而启动VEGF的转录。而本研究中,H.pylori感染人胃腺癌细胞BGC-823 24h后可显著提高HIF-1α mRNA和蛋白的表达,差异有统计学意义(P<0.05),并且随着H.pylori浓度的增加,HIF-1α表达呈增高趋势。提示VEGF的表达可能是H.pylori通过HIF-1α途径来调控的。冯玉光等在尼美舒利对氯化钴诱导的BGC-823细胞HIF-1α及VEGF表达的影响是发现,氯化钴刺激BGC-823细胞24h,可显著提高细胞HIF-1α蛋白、VEGF mRNA和蛋白的表达(P<0.01),但对 HIF-1αmRNA 表达无影响[11]。而本实验证实 H.pylori可能通过HIF-1α在基因水平和蛋白水平调控VEGF表达。
Song等[12]在研究胃癌血管生成和糖代谢相关的靶基因的调节时发现,增强缺氧时胃癌血管内皮生长因子和葡萄糖代谢相关基因表达的是HIF-1α和HIF-1β,而不是 HIF-2α。本实验发现 H.pylori感染人胃癌细胞BGC-823 24h后可显著提高HIF-2αmRNA和蛋白的表达,差异有统计学意义(P<0.05),并且随着 H.pylori浓度的增加,HIF-2α 呈增高趋势。提示H.pylori增强VEGF的表达也可能是通过增加HIF-2α来调控的,且HIF-2α可能是在基因水平和蛋白水平调控VEGF表达。
本实验发现低浓度的H.pylori悬液可显著增加胃癌细胞BGC-823的增殖,并能提高HIF-1α、HIF-2α和VEGF表达,这可能是H.pylori促进胃癌的侵袭和转移的机制之一。本研究结果为临床上针对H.pylori抗阳性的胃癌病人,根除H.pylori降低胃癌细胞增殖速度,减少HIF-1α、HIF-2α和VEGF表达,对控制胃癌细胞增殖速度和胃癌的侵袭转移有一定的指导意义。也为针对HIF-1α、HIF-2α和VEGF等抗胃癌血管生成的靶向治疗提供初步的理论依据。目前,已提出了针对HIF-1α转录翻译、上游信号活化、信号传导通路、下游效应分子等新靶向HIF-1α转录因子治疗胃癌的新思路[13]。由于HIF-2α在肿瘤组织和血管内皮的表达比HIF-1α更强烈,以HIF-2α为靶点的抗血管生成治疗与HIF-1α和传统细胞毒药物、肿瘤免疫疗法相结合的治疗方法,有望在H.pylori阳性的胃癌患者在治疗上有所突破。
1 Jemal A,Tiwari RC,Murray T,et al.Cancer statistics[J].CA Cancer J Clin,2004,54(1):8-29
2 Keighley MR.Gastrointestinal cancers in Europe[J].Aliment Pharmacol Ther,2003,,18(13):7-30
3 Morgner A,Miehlke S,Fischbach W,et al.Complete remission of primary high-grade B-cell gastric lymphoma after cure of Helicobacter pylori infection[J].J Clin Oncol 2001,7(19):2041-2048
4 李新华,张桂英,罗非君,等.胃癌细胞系幽门螺杆菌感染对金属蛋白酶表达的影响[J].世界华人消化杂志,,2003,11(6):544-546
5 周丽雅,林三仁,丁士刚,等.根除幽门螺旋杆菌对胃癌患病率及胃黏膜组织变化的8年随访研究[J].中华消化杂志,2005,25(6):324-327
6 魏军,于东红.幽门螺杆菌L型感染与胃癌BGC-823细胞侵袭、转移关系的研究[J].蚌埠医学院学报,2010,35(3):226-229
7 吴海波,于东红,唐素兰.幽门螺杆菌L型感染对胃癌BGC-823细胞增殖的影响[J].现代肿瘤医学,2011,19(2):229-234
8 吴莺,李翔,周红,等.幽门螺杆菌对胃癌细胞BGC-823形态及凋亡相关基因表达的影响[J].世界华人消化杂志,2011,19(17):1767-1772
9 Wang TB,Deng MH,Qiu WS,et al.Association of serum vascular endothelial growth factor-C and lymphatic vessel density with lymph node metastasis and prognosis of patients with gastric cancer[J].World J Gastroenterol,2007,28,13(12):1794-1797
10 Xiao WM,Ding YB,Shi RH,et al.Correlation of Helicobacter pylori infection with the expression of COX-2 and EGFR and VEGF in human gastric carcinoma[J].Zhonghua Zhong Liu Za Zhi,2008,30(9):668-671
11 冯玉光,李建生,宗红,等.尼美舒利对氯化钴诱导的BGC-823细胞HIF-1α及VEGF表达的影响[J].郑州大学学报:医学版,2006,41(3):486-489
12 Song IS,Wang AG,Yoon SY,et al.Regulation of glucose metabolism-related genes and VEGF by HIF-1 alpha and HIF-1 beta,,but not HIF-2 alpha,in gastric cancer[J].Experimental and Molecular Medicine,2009,41(1):51-58
13 Cairns RA,Papandreou I,Sutphin PD,et al.Metabolic targeting of hypoxia and HIF1 in solid tumors can enhance cytotoxic chemot herapy[J].Proc Natl Acad Sci USA,2007,104(22):9445-9450
