瑞舒伐他汀钙通过下调血管内皮生长因子的表达抑制斑马鱼血管发育
吕 慧,王国坤,刘 博,李松华,秦永文(第二军医大学长海医院心血管内科,上海200433)
经皮冠状动脉介入术(percutaneous coronary intervention,PCI)对心绞痛及心肌梗死的再血管化治疗具有重要作用,但术后支架内再狭窄(in-stent restenosis,ISR)一度成为支架植入的障碍。曾有文献报道可明显减少ISR的药物洗脱支架的再狭窄率在糖尿病病人中高达20.9%,即使在非糖尿病病人中也达到14.6%[1]。他汀类药物可抑制人体胆固醇生物合成,在心血管疾病中广泛应用于治疗高胆固醇血症,发挥稳定斑块、抗炎等作用。既往已有研究表明,他汀类药物可明显减少PCI后再狭窄率的发生[2],而内皮细胞的活化及血管新生在ISR的病理生理过程中发挥了重要作用[3],推测他汀类药物可能影响血管新生过程发挥心血管保护作用。
为能实时活体观察他汀类药物对血管新生的影响,作者使用转基因斑马鱼作为实验对象。通过研究瑞舒伐他汀钙对斑马鱼血管发育的影响,间接揭示他汀类药物影响血脂之外的作用,为血管新生相关PCI后再狭窄的治疗提供新的参考。
1 材料和方法
1.1 材料和仪器 动物模型为转基因斑马鱼Tg(flk1:EGFP),系中国科学院上海生命科学研究院馈赠;Trizol试剂(美国Invitrogen公司);PrimeScript RT试剂盒(日本Takara公司);雷鸟定量PCR试剂(日本Toyobo公司);体视荧光显微镜(德国莱卡仪器有限公司)。瑞舒伐他汀钙片(10mg/片,批号113651,阿斯利康制药公司)。
1.2 药物溶液制备 根据Westerfield[4]方案配制鱼卵水(egg water,137mmol/L NaCl,5.4mmol/L KCl,0.13mmol/L CaCl2,0.1mmol/L Mg2+,pH 7.2),将瑞舒伐他汀钙片研磨成粉后溶入二甲亚砜(DMSO)终浓度为0.5%的鱼卵水中,药物浓度梯度为0.01、0.02、0.04、0.08、0.10nmol/L。
1.3 胚胎处理 根据Westerfield[4]方案饲养,28.5℃下照明14h/黑暗10h为一个周期,饲养水连续充氧气,水为半自动更新,定时给予饲料草履虫。取卵前1d,雌雄斑马鱼以1/2的比例放入交配缸内,交配缸底部有产卵托盘,中间放置隔板,过夜,次日晨照明后去掉隔板1h内取胚胎。使用24孔板,每孔中至少20个胚胎,加入不同浓度的药物,形成药物的不同浓度梯度。从受精卵形成后0.5h开始刺激,持续24h。受精后24h观察斑马鱼的血管发育情况。实验组每孔加入上述不同浓度药物2ml,对照组每孔加入含0.5%DMSO的鱼卵水。
1.4 定量聚合酶链反应 使用实时定量逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR),检测不同时期胚胎血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)的表达量。以管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,根据斑马鱼GAPDH和VEGF-A基因序列,利用Primer 5.0软件设计引物进行扩增。GAPDH及VEGF-A的引物分别为:VEGF-A F:5′-CGAAACGTCACTATGGAGGTG-3′;VEGF-A R:5′-GCAAGGCTCACAGTGGTTTT-3′;GAPDH F:5′-CAGGCATAATGGTTAAAGTTGGTA-3′;GAPDH R:5′-CATGTAATCAAGGTCAATGAATGG-3′。按Trizol试剂说明书操作,分别提取0、6、12和24h斑马鱼胚胎总RNAs,使用PrimeScript RT试剂盒将总RNAs反转录为cDNA。将所得的cDNA产物置于-20℃保存。以反转录所得cDNA体积的1/20为模板,使用雷鸟定量PCR试剂行定量PCR。扩增条件为:95℃预变性1min,94℃变性20s,58℃退火20s,72℃延伸15s,40个循环,最后72℃温育10min。建立PCR产物的溶解曲线,以鉴定产物是否单一。扩增产物以1%琼脂糖凝胶电泳进行检测,采用Rotor Gene 6软件进行VEGF-A与GAPDH基因条带的相对密度分析。数据分析采用2—△△ct的方法。
1.5 统计学处理 计算被抑制的节间血管的数目,应用统计分析软件SPSS14.0对实验组和对照组中节间血管异常的斑马鱼进行统计学分析,实验结果以均数±标准差表示,采用t检验计算组间差异,P<0.05表明差异具有统计学意义。
2 结 果
2.1 瑞舒伐他汀钙可抑制斑马鱼血管发育 使用0.01、0.02、0.04、0.08、0.10nmol/L 5个不同浓度的瑞舒伐他汀钙处理斑马鱼胚胎,发育至受精后24hours post fertilization(hpf)。使用荧光显微镜观察5个药物浓度下胚胎的新生节间血管(intersegmental vessels,ISVs)生长情况,发现0.08nmol/L的药物处理后ISVs较对照组生长速度明显受到抑制,多数表现为节间血管长度较对照组明显减少或缺失(如图1所示)。通过软件计算上述5个浓度组药物处理后胚胎的ISVs长度分别为:(0.045±0.002)、(0.042±0.001)、(0.041±0.001)、(0.028±0.002)、(0.031±0.001)mm,与对照组(0.050±0.001)mm相比,5个浓度药物处理后的胚胎节间血管长度均有减少,差异均具有统计学意义(P<0.01)。
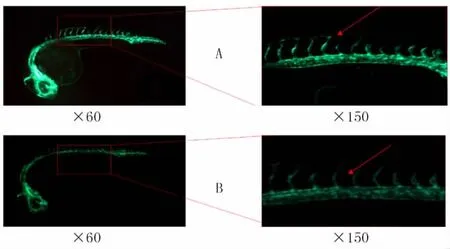
图1 两组斑马鱼胚胎在受精后24h时节间血管生长情况Figure 1 The growth of intersegmental vessels of zebrafish embryos at 24hours post fertilization in the two groups
2.2 瑞舒伐他汀钙可抑制受精后24h胚胎VEGF-A的表达 选取斑马鱼胚胎最初生长的4个时期,即受精后0、6、12和24hpf,观察药物对血管抑制效果最强的浓度,即0.08nmol/L的瑞舒伐他汀钙处理胚胎后4个时间点VEGF-A的表达变化。结果显示,随着时间延长,对照组及实验组胚胎VEGF-A表达量均呈现增加趋势,同时,与同时期对照组相比,0、6、12hpf实验组的VEGF-A表达量未见明显降低,而在24hpf的表达量明显减少,差异具有统计学意义(P<0.05)。结果见表1。
表1 两组不同时期斑马鱼胚胎血管内皮生长因子A的相对表达量Table 1 Relative expression quantity of vascular endothelial growth factor A at different time of zebrafish embryos in the two groups(n=4,±s)

表1 两组不同时期斑马鱼胚胎血管内皮生长因子A的相对表达量Table 1 Relative expression quantity of vascular endothelial growth factor A at different time of zebrafish embryos in the two groups(n=4,±s)
*P<0.05,与相同时间点的对照组比较
组别 0hpf 6hpf 12hpf 24hp f对照组 1.062± 0.0050.002实验组 1.071± 0.007 1.341± 0.002 2.282± 0.006 3.315± 1.349± 0.001 2.171± 0.011 2.607± 0.020*
3 讨 论
ISR是PCI后的主要不良事件,它与手术引起的血管损伤相关,多种因素如血栓形成、炎症、内皮细胞增殖及细胞外间质形成等均参与其病理生理过程[5]。既往数十年,已有多项随机的回顾性研究表明,他汀类药物较对照组可显著减少PCI后6个月血管再狭窄的发生率[6,7]。本研究结果表明,瑞舒伐他汀钙可明显抑制斑马鱼胚胎血管新生,与Walter等[6]的研究结果一致,从一定程度上反映出他汀类药物对PCI后再狭窄的预防作用。
斑马鱼作为研究脊椎动物发育生物学的理想实验动物,具有胚胎透明、产卵量大、便于观察等特点,同时其血管生成过程与脊椎动物具有高度保守性。目前使用的转基因斑马鱼携带特定启动子与绿色荧光蛋白(green fluorescent protein,GFP)基因相连,方便使用荧光显微镜观察血管发育。
瑞舒伐他汀钙抑制血管增生的作用通路尚不明确,通过行实时定量RT-PCR,作者检测了斑马鱼整胚VEGF-A的相对表达量。对照组可见VEGF-A呈明显上升趋势,早期(0~6hpf)VEGF-A没有明显升高,且本身表达量较少,12hpf后斑马鱼VEGF-A表达量增多,表明在斑马鱼血管发育期间,VEGF-A发挥了重要作用,与Liang等[8]的研究结果一致。本研究发现,药物处理后的胚胎VEGF-A的表达量虽呈上升趋势,但较对照组在24hpf时的表达量明显减少,表明药物可能影响整个胚胎VEGF-A的表达,而节间血管作为血管发育的明显标志,表现为长度的明显减少。既往研究表明,斑马鱼的VEGF-A基因与人类相似[9],因此可合理推测临床使用瑞舒伐他汀钙可减少病人VEGF-A的表达而发挥预防支架内再狭窄的作用。但是,目前的研究结果仅为药物作用的初步研究,同时研究结果表明,瑞舒伐他汀钙抑制血管新生后可能影响PCI后血管损伤后的新生血管修复,或影响早期动脉粥样硬化表面纤维帽的稳定性而导致斑块易破裂。目前的数据仍然支持他汀类药物应用于预防斑块形成及支架内再狭窄[10]。本研究可为他汀类药物抗动脉粥样硬化及抗肿瘤作用提供一定的理论依据,同时为他汀类药物在抗血管新生方面的争议提供依据。
[1] Hong S J,Kim M H,Ahn T H,et al.Multiple predictors of coronary restenosis after drug-eluting stent implantation in patients with diabetes[J].Heart,2006,92(8):1119-1124.
[2] Kamishirado H,Inoue T,Sakuma M,et al.Effects of statins on restenosis after coronary stent implantation[J].Angiology,2007,58(1):55-60.
[3] 汤学超,秦永文.经皮冠状动脉介入术前他汀类药物预治疗:消炎与心肌保护[J].药学服务与研究,2010,10(5):364-367.
Tang XueChao,Qin YongWen.Pretreatment with statins before percutaneous coronary intervention:anti-inflammatory effect and cardioprotection[J].Pharm Care Res,2010,10(5):364-367.In Chinese with English abstract.
[4] Westerfield M,Doerry E,Douglas S.Zebrafish in the net[J].Trends Genet,1999,15(6):248-249.
[5] Rajagopal V,Rockson S G.Coronary restenosis:a review of mechanisms and management[J].Am J Med,2003,115(7):547-553.
[6] Walter D H,Schächinger V,Elsner M,et al.Effect of statin therapy on restenosis after coronary stent implantation[J].Am J Cardiol,2000,85(8):962-968.
[7] Bunch T J,Muhlestein J B,Anderson J L,et al.Effects of statins on six-month survival and clinical restenosis frequency after coronary stent deployment[J].Am J Cardiol,2002,90(3):299-302.
[8] Liang D,Chang J R,Chin A J,et al.The role of vascular endothelial growth factor(VEGF)in vasculogenesis,angiogenesis,and hematopoiesis in zebrafish development[J].Mech Dev,2001,108(1-2):29-43.
[9] Gong BaiWei,Liang Dong,Chew TingGang,et al.Characterization of the zebrafish vascular endothelial growth factor A gene:comparison with vegf-Agenes in mammals and Fugu[J].Biochim Biophys Acta,2004,1676(1):33-40.
[10] Katsiki N,Tziomalos K,Chatzizisis Y,et al.Effect of HMGCoA reductase inhibitors on vascular cell apoptosis:beneficial or detrimental?[J].Atherosclerosis,2010,211(1):9-14.

