经鼻给予TGF-β1对匹罗卡品诱导的癫痫持续状态大鼠海马内炎症反应的影响
刘益民, 韩远远, 张慧敏, 王 玉
癫痫是神经系统第三大慢性脑功能障碍疾病[1],严重影响患者的生活质量。诸多因素参与了癫痫发生、发展过程,近年来越来越多的实验和临床研究表明炎症反应和免疫调节为癫痫的重要病理机制[1~3]。转化生长因子-β1(TGF-β1)是一种多功能的细胞生长因子,参与调节细胞生长、分化和细胞损伤的修复,并可以抑制中枢神经系统内的炎症反应和免疫反应[4,5]。癫痫形成的过程中,TGF-β1 可能具有潜在的神经保护及抗炎作用。由于内源性TGF-β1在脑中含量较低,在癫痫形成的超早期,补充TGF-β1可能发挥神经保护及抑制中枢炎症反应,防治癫痫的作用。本实验在匹罗卡品诱发的癫痫持续状态(SE)后,采取可以绕过血脑屏障直接进入脑内的经鼻给药方式给予TGF-β1,动态监测海马炎性因子白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)的表达水平及小胶质细胞活化物CD11b的改变,探讨TGF-β1在癫痫形成过程中对神经炎症的影响及可能的机制。
1 材料和方法
1.1 实验动物
选用清洁级健康雄性Sprague-Dawley大鼠84只(安徽医科大学动物实验中心提供),6~8周龄,体重160~240g。实验动物均在安静的室温下饲养1w以适应环境,自由进食饮水,适宜湿度及温度,自然昼夜节律光照。
1.2 化学试剂
重组人TGF-β1蛋白购自美国Peprotech公司,盐酸匹罗卡品购自美国Sigma公司,Elisa试剂盒均购自美国Invitrogen公司,免疫组化用小胶质细胞标志物CD11b/integinαM多克隆兔抗及二抗试剂盒购自北京博奥森公司。
1.3 实验方案、匹罗卡品癫痫模型的建立及分组
实验一:为检测TGF-β1能否经滴鼻顺利进入大脑中枢,动物分为 TGF-β1组和对照组(control组),每组3只。滴鼻方法:25μg TGF-β1重组人蛋白(Peprotech,USA)溶于 40μl消毒 PBS(pH7.4,0.5μg/μl)中。给药方法参照 Jiang 等人[6]的方法稍有改变:大鼠用戊巴比妥钠腹腔麻醉(200mg/kg),取仰卧位,头颈背用4×4cm的纱布卷稍垫高以有利于药物进入后鼻腔,应用移液枪经鼻滴入TGF-β1(2μl/只)。当一侧鼻孔给药时,大鼠的另一侧鼻孔被轻轻的堵住。对照组应用相同方法滴入等容量的PBS。
实验二:匹罗卡品动物癫痫模型的建立及分组:大鼠接受单次的匹罗卡品腹腔注射(380mg/kg),致痫前30min皮下注射了甲基-东莨菪碱1mg/kg以减弱匹罗卡品胆碱能反应。大鼠行为学观察参照Racine[7]六级评价标准:Ⅰ级:出现面部抽搐伴咀嚼动作,偶尔的“湿狗样动作”;Ⅱ级:出现点头运动,一侧前肢阵挛、频繁的“湿狗样动作”;Ⅲ级:出现双侧前肢阵挛、流涎、站立;Ⅳ级:全身阵挛,失去平衡跌倒;Ⅴ级;痫性发作持续。周期性重复的Ⅲ级及以上级别、持续达30min界定为SE发作。匹罗卡品注射后约20min,所有动物均出现SE发作。在SE后90min,腹腔注射地西泮10mg/kg后SE逐渐终止。死亡率被统计于癫痫持续状态后6h,24只动物死于癫痫持续状态(死亡率约30%)。此时把动物随机分为3组:正常对照组(Control组,n=18)、匹罗卡品+PBS滴鼻组(Pilo组,n=18)、匹罗卡品+TGF-β1滴鼻组(TGF组,n=18)3组,各组又随机分为1d、3d、7d 3 个亚组,每组6 只。
1.4 组织处理
实验一部分,实验动物滴鼻后1h,10%水合氯醛麻醉后(350mg/kg,腹腔注射)快速断头取脑,完整脑组织被取出后存于液氮罐中备Elisa定量检测。
实验二部分,各实验组动物分别于SE后1d、3d、7d,10%水合氯醛麻醉后断头取脑,冰盘内沿矢状线直切成对半,一侧半球的海马组织被离断,存于液氮罐中备细胞因子Elisa定量检测;另一侧半球放入4%甲醛溶液中固定72h,之后组织脱水、石蜡包埋,连续的海马冠状切面进行切片,片厚4μm。
1.5 Elisa定量测定
液氮罐中取出标本,保持低温条件下,各组标本称重后按一固定比例生理盐水稀释,匀浆后移入离心管,4℃低温离心20min(3000r/min),离心后取上清液测定。Elisa法分别检测实验一部分的重组蛋白TGF-β1及实验二部分的细胞因子IL-1β、TNF-α蛋白的检测,具体方法按说明书进行:配标准品,留空白孔,分组加样品及标准品,洗板,加生物素化抗体工作液,洗板,加酶结合物工作液,洗板,加洗涤液,洗板,加显色液,加终止液等;测量 OD450值(10min内);通过Curve Expert 1.3分析软件绘制标准曲线:由标准方程求出 TGF-β1、IL-1β 及 TNF-α蛋白的含量。
1.6 免疫组织化学反应
按SP三步法法进行免疫组化染色,切片常规脱蜡至水,抗原热修复后依次加入3%H2O2、10%山羊血清闭液,之后加 CD11b/integinαM 抗体(1∶1000),于4℃冰箱过夜后,滴加二抗工作液及辣根酶标记物,DAB显色。阴性对照用PBS代替一抗。
1.7 图像采集及免疫组化图像分析
图像采集在Olympus公司提供的自动聚焦显微镜下完成,采用同一曝光度,高倍镜下随机抽取每张切片的CA1区5个不同高倍视野用于摄片及分析,分析使用IPP 6.0图像分析软件(Media Cybernetics MD,USA)自动分析每张图片的平均光密度。
1.8 统计学处理
2 结果
2.1 滴鼻检测
实验一中,TGF-β1组滴鼻后1h处死动物,对脑组织匀浆液进行Elisa定量检测。结果显示TGF-β1组和对照组有明显差异(n=3,3.24 ±0.31 Vs 0.17±0.04ng/g,P<0.01),表明 TGF-β1 滴鼻后 1h,蛋白在脑内明显聚集。
2.2 IL-1β、TNF-α 蛋白检测结果
各实验组 IL-1β、TNF-α蛋白的含量具体见表1、表2。对照组大鼠海马IL-1β、TNF-α蛋白含量甚微;SE 后 1d、3d、7d,TGF 组较 Pilo 组 IL-1β、TNF-α含量均有减少,差异有统计学意义(P<0.05或P<0.01)。通过 Pilo组和 TGF组 IL-1β、TNF-α 蛋白组内各时间点比较发现,随SE后时间的延长,Pilo组这两种细胞因子蛋白含量呈先上调后下降趋势,3d为高峰,7d含量明显高于1d含量(P<0.05或P<0.01),TGF组各时间点细胞因子含量变化趋势与Pilo组相一致。
2.3 CD11b形态及平均光密度值比较
各组大鼠海马区CD11b阳性表达见图1。对照组大鼠海马CD11b阳性细胞表达较少,胞体呈圆形或椭圆形,突起较少。Pilo组和TGF组阳性细胞着色较深,部分细胞胞体演变成狭长状及梭状,突起增多、增粗,以致痫后7d最为明显。平均光密度值比较(见表3),Pilo组随SE后各时间点的延长,呈快速增加趋(P<0.01),TGF组的变化趋势与Pilo组相一致(P<0.05或P<0.01)。TGF组与 Pilo组比较,在1d平均光密度无明显差异(P>0.05),3d有明显差异(P<0.05),7d存在显著差异(P<0.01)。
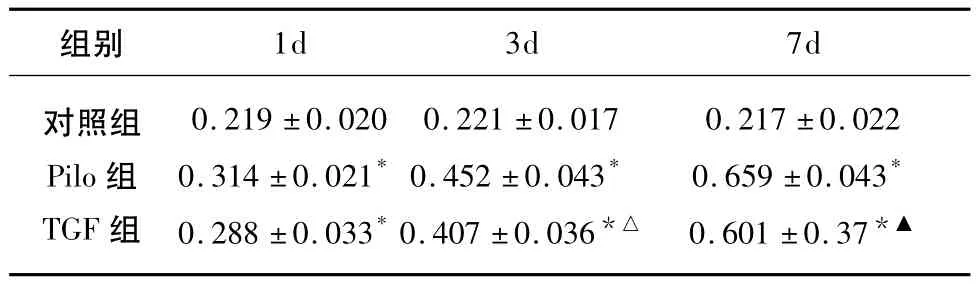
表3 各组大鼠不同时间海马CD11B表达的平均光密度值(χ ± s,n=6)

图1 癫痫持续状态后各组大鼠海马CA1区CD11b的表达
3 讨论
TGF-β1是一种多功能细胞因子,可以通过细胞表面的受体信号转导,参与细胞的增殖分化、炎症反应和细胞损伤的修复等[8]。内源性的神经营养因子,包括TGF-β1,由于在体内的含量较低,对机体的各种创伤的修复和免疫调节作用并不明显[9]。近年来的研究表明,TGF-β1 对帕金森病[10]、阿尔茨海默病[11]、亨廷顿病[12]、脑缺血[13]等中枢神经变性疾病有一定的脑保护作用。并且大量研究表明TGF-β1可以抑制中枢内的炎症反应[4,5,14]。外源性 TGF-β1的补充可能具有神经保护及抑制中枢炎症反应的作用,为癫痫的防治带来新的希望,然而TGF-β1作为一种大分子多肽类物质,周围用药很难通过血脑屏障,用药途径制约着包括TGF-β1在内的神经营养因子的研究和应用。近年来,大量研究证实滴鼻可以使一些大分子多肽类物质或某些药物绕过血脑屏障快速到达中枢[15,16]。较多实验证实这条路径是沿嗅觉和三叉神经传导通路进行传导[17]。本实验中,在TGF-β1滴鼻后1h,脑内即有很高的聚集,提示鼻腔给药可使药物快速到达中枢,这与Ma YP等报道相一致[18]。滴鼻成为中枢神经系统疾病实验研究和潜在的的临床治疗应用策略,有效的使药物绕过血脑屏障,靶向递送到脑部,比其他中枢给药具有较多的优势[15]。
癫痫的发生、发展与炎症反应和免疫调节密切关联[1,2]。IL-1β 是急性应激反应和损伤的重要炎性介质之一,脑内局部IL-1β增高可加重脑组织的炎症引起惊厥[19]。IL-1β还可以激活血管内皮细胞、中性粒细胞等,增强粘附分子表达,促进其他细胞因子如IL-6、IL-8、粒细胞-巨噬细胞集落刺激因子等释放,与TNF-α一起引起各种炎症反应,进而诱发或加重惊厥。TNF-α是一种经典促炎细胞因子,在正常脑组织中表达甚微,当各种中枢神经系统疾病如脑缺血、癫痫等发生时会出现快速上调。TNF-α能够调整突触的传递,尤其是胶质细胞释放的TNF-α,可以通过调整神经元表面的AMPA受体,加快突触的传递;并且通过与不同受体结合,调整与谷氨酸能系统相互作用,影响神经兴奋性,进而影响癫痫发生的敏感性[20,21]。本实验中各时间点,TGF组较Pilo组促炎细胞因子IL-1β、TNF-α的分泌表达减少明显,不仅提示TGF-β1可能减弱了海马内炎症反应的强度,更提示TGF-β1可能具有潜在的抗癫痫作用。
包括癫痫在内的中枢神经系统疾病中,区域性的星形胶质细胞和小胶质细胞的活化是其重要的病理特征,并且这些细胞是炎症介质产生的主要来源[1]。在颞叶癫痫手术切除的海马组织中就存在活化的星形胶质细胞、小胶质细胞及相关的炎性介质[22]。脑内的胶质细胞,尤其是小胶质细胞,为中枢神经系统免疫信号转导的主要细胞类型,为中枢疾病研究的热点[8]。在 SE 后 3d和 7d,TGF-β1滴鼻处理组较Pilo组小胶质细胞平均光密度值有明显差异,提示TGF-β1抑制了SE引起的小胶质细胞的活化。关于TGF-β1抑制中枢内小胶质细胞活化、减轻脑内炎症的作用,曾见于以前的报道[4,5]。本实验中,外源性的 TGF-β1抑制了细胞因子 IL-1β、TNF-α蛋白的合成,并抑制了小胶质细胞的活化,提示应用TGF-β1处理,减弱海马部位的炎症应答。SE后1~3d为匹罗卡品癫痫模型的急性期,3~7d为癫痫形成期或称潜伏期[22]。在癫痫形成的关键期内海马区的炎症反应得到抑制,尤其是促炎细胞因子 IL-1β、TNF-α 的分泌表达减少,提示 TGF-β1处理可能会对癫痫脑损伤具有保护作用。
综上所述,经鼻给予TGF-β1可以减少癫痫持续状态大鼠海马炎性因子IL-1β、TNF-α的表达,抑制了小胶质细胞的活化,减轻海马内的炎症反应,可能具有脑保护及抗癫痫的作用。具体的机制仍有待于进一步研究。
[1]Vezzani A,French J,Bartfai T,et al.The role of inflammation in epilepsy[J].Nature reviews,2011,7(1):31 -40.
[2]Friedman A,Dingledine R.Molecular cascades that mediate the influence of inflammation on epilepsy[J].Epilepsia,2011,52(Suppl 3):33-39.
[3]Vezzani A,Granata T.Brain inflammation in epilepsy:experimental and clinical evidence[J].Epilepsia,2005,46(11):1724 -1743.
[4]Makwana M,Jones LL,Cuthill D,et al.Endogenous transforming growth factor beta 1 suppresses inflammation and promotes survival in adult CNS[J].J Neurosci,2007,27(42):11201 -11213.
[5]Qian L,Wei SJ,Zhang D,et al.Potent anti-inflammatory and neuroprotective effects of TGF-beta1 are mediated through the inhibition of ERK and p47phox-Ser345 phosphorylation and translocation in microglia[J].J Immunol,2008,181(1):660 -668.
[6]Jiang Y,Wei N,Lu T,et al.Intranasal brain-derived neurotrophic factor protects brain from ischemic insult via modulating local inflammation in rats[J].Neuroscience,2011,172:398 -405.
[7]Racine RJ.Modification of seizure activity by electrical stimulation.II.Motor seizure[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[8]李良勇,李家林,王 玉.经鼻给予TGFβ1对癫痫持续状态大鼠海马神经元的保护作用[J].中风与神经疾病杂志,2012,29(2):109-112.
[9]Simonato M,Tongiorgi E,Kokaia M.Angels and demons:neurotrophic factors and epilepsy[J].Trends Pharmacol Sci,2006,27(12):631-638.
[10]Gonzalez-Aparicio R,Flores JA,Fernandez-Espejo E.Antiparkinsonian trophic action of glial cell line-derived neurotrophic factor and transforming growth factor beta1 is enhanced after co-infusion in rats[J].Exp Neurol,2010,226(1):136 -147.
[11]Caraci F,Battaglia G,Bruno V,et al.TGF-beta1 Pathway as a new target for neuroprotection in alzheimer’s disease[J].CNS Neuroscience & Therapeutics,2011,17(4):237 -249.
[12]Battaglia G,Cannella M,Riozzi B,et al.Early defect of transforming growth factor beta1 formation in Huntington’s disease[J].Journal of Cellular and Molecular Medicine,2011,15(3):555 -571.
[13]Ma M,Ma Y,Yi X,et al.Intranasal delivery of transforming growth factor-beta1 in mice after stroke reduces infarct volume and increases neurogenesis in the subventricular zone[J].BMC Neurosci 2008,9:117.
[14]Mishra L,Derynck R,Mishra B.Transforming growth factor-beta signaling in stem cells and cancer[J].Science(New York,NY),2005,310(5745):68 -71.
[15]Alcala-Barraza SR,Lee MS,Hanson LR,et al.Intranasal delivery of neurotrophic factors BDNF,CNTF,EPO,and NT-4 to the CNS[J].J Drug Target,2010,18(3):179 -190.
[16]Jiang Y,Wei N,Zhu J,et al.A new approach with less damage:intranasal delivery of tetracycline-inducible replication-defective herpes simplex virus type-1 vector to brain[J].Neuroscience,2012,201:96-104.
[17]Thorne RG,Frey WH.Delivery of neurotrophic factors to the central nervous system:pharmacokinetic considerations[J].Clin Pharmacokinet,2001,40(12):907 -946.
[18]Ma YP,Ma MM,Ge S,et al.Intranasally delivered TGF-beta1 enters brain and regulates gene expressions of its receptors in rats[J].Brain Res Bull,2007,74(4):271 -277.
[19]Vezzani A,French J,Bartfai T.The role of inflammation in epilepsy[J].Nat Rev Neurol,2011,7(1):31 - 40.
[20]Balosso S,Ravizza T,Pierucci M,et al.Molecular and functional interactions between tumor necrosis factor-alpha receptors and the glutamatergic system in the mouse hippocampus:implications for seizure susceptibility[J].Neuroscience,2009,161(1):293 -300.
[21]Stellwagen D,Beattie EC,Seo JY.Differential regulation of AMPA receptor and GABA receptor trafficking by tumor necrosis factor-alpha[J].J Neurosci,2005,25(12):3219 -3228.
[22]Ravizza T,Gagliardi B,Noe F,et al.Innate and adaptive immunity during epileptogenesis and spontaneous seizures:evidence from experimental models and human temporal lobe epilepsy[J].Neurobiol Dis,2008,29(1):142 -160.

