醋艾叶饮片炮制工艺研究
张甜甜,周倩,吴晓文,孙立立
(山东省中医药研究院,山东济南250014)
艾叶为菊科植物艾Artemisia argyi Levl.et Vant.的干燥叶,为妇科常用药。其味苦、辛,性温有小毒。具有散寒止痛,温经止血的功效[1]。现代药理研究表明,艾叶还可抗菌抗病毒、增强免疫,并具有对呼吸系统、中枢神经系统和对心血管系统多方面的作用[2-6]。艾叶有小毒,必须经过炮制加工处理方能降低或消除毒副作用。艾叶历代炮制方法包括炒、制炭、焙干、醋炙、糯米制、制绒、酒制、盐炙等。沿用至今并被全国及各地炮制规范所收载的炮制方法主要为艾叶炭、醋艾叶和醋艾炭[7-9]。《中国药典》2010年版仅收载了醋艾炭一种炮制规格,然而在现代应用中醋制法应用也比较多[10-11],但目前缺乏对醋艾叶炮制工艺相关研究。1988年版《全国中药炮制规范》[7]中仅规定了用醋量,无具体工艺参数。为优化和规范其炮制工艺,本实验对醋艾叶的炮制工艺进行了优选,以保证醋艾叶饮片的质量。
1 仪器与试药
1.1 仪器十万分之一电子天平(Sartorius R200D,德国);岛津UV—265FM紫外分光光度计;B3200S—T超声机(必能信超声有限公司,250F,50 Hz),中药炮制控温炉(哈尔滨测电器厂)。YXQG02型电热式提取罐;RE—2000型旋转蒸发器(上海亚荣生化仪器厂)。
1.2 试药与试剂艾叶(产地安徽,购自安徽沪谯中药饮片厂),经本院李英霞研究员鉴定为《中国药典》收载品种。芦丁对照品(购自中国食品药品检定研究院,批号100080-200306);乙醇,亚硝酸钠,硝酸铝等均为分析纯。辅料醋为龙门米醋(北京王致和味滋康食品有限公司)。
2 正交试验法优选醋艾叶炮制工艺
2.1 因素水平设计采用L9(34)正交试验对影响醋艾叶饮片质量主要因素(加醋量、炒炙温度与炒炙时间)进行考察,优选最佳醋炙工艺,具体设计见表1。
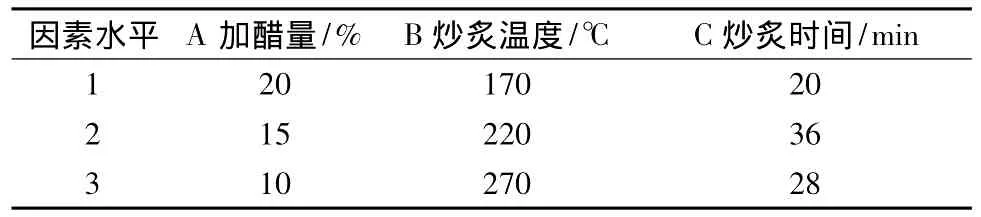
表1 因素水平Tab.1 Factors and levels
2.2 试验方法照正交设计方案,取一定量辅料醋,与适量水混匀后,加入到50 g净艾叶饮片中拌匀,闷润,置中药炮制控温炉中,照设定温度和时间进行炮制,取出晾凉,即得。
2.3 考察指标及指标选择依据
2.3.1 传统质量评价指标的选择依据和标准饮片的传统质量评价是以饮片外观性状为主要指标,是中医药宝贵经验的总结,可在相当程度上提示饮片质量。
外观性状评分标准:根据《全国中药炮制规范》对醋艾叶的性状要求,邀请老药工通过审查醋艾叶的表面颜色(满分40分)、着色均匀情况(满分30分)、有无醋气(满分30分)等进行打分,计算三项得分总和。
2.3.2 内在质量评价指标的选择依据和标准黄酮是艾叶的主要成分[12-13],且是主要有效成分之一。因此选用总黄酮含有量作内在质量评价指标。2.3.2.1对照品溶液的制备取120℃干燥至恒定质量的芦丁对照品约28 mg,精密称定,置50 mL量瓶中,加乙醇适量,超声处理使溶解,放冷,加乙醇至刻度,摇匀。精密量取20 mL,置50 mL量瓶中,加乙醇至刻度,摇匀,即得(每mL含芦丁0.225 mg)。
2.3.2.2 供试品溶液制备取醋艾叶样品粉末约0.5 g,精密称定,置100 mL圆底烧瓶中,精密加入40%乙醇50 mL,称定质量,回流提取1 h,放凉,称定质量,用40%乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3.2.3 方法学考察
测定波长的选择分别对对照品溶液和供试品溶液进行波长扫描,结果在504 nm处有最大吸收。
标准曲线的制备精密吸取芦丁对照品溶液1、2、3、4、5、6 mL,分别置25 mL量瓶中,各加入40%乙醇至6 mL,然后分别加入5%亚硝酸钠溶液1 mL,摇匀,放置6 min;加入10%硝酸铝溶液1 mL,摇匀,放置6 min;加入1 mol/L氢氧化钠溶液10 mL,加40%乙醇至刻度,摇匀,放置15 min,以相应试剂为空白,于504 nm处测定吸光度。以对照品质量浓度(mg/mL)为横坐标,吸光度为纵坐标进行回归,得回归方程为A=9.514 3C+0.038 1,r=0.999 9。表明芦丁在0.009~0.054 mg/mL范围内线性关系良好。
精密度试验精密吸取对照品溶液4 mL,供试品溶液1 mL,分别照上述方法连续测定6次。结果,对照品溶液及供试品溶液吸光度的RSD分别为0.13%和0.11%,表明仪器精密度良好。
稳定性试验精密吸取芦丁对照品溶液4 mL,供试品溶液1 mL,分别于10、20、30、40、50、60 min测定。结果,对照品和供试品溶液在60 min内均稳定性良好,RSD均小于3%。
重复性试验取艾叶粉末6份,分别照上述方法制备供试品溶液,并依法进行测定,结果测得总黄酮平均质量分数为11.02%,RSD为1.2%。说明本法重复性良好。
回收率试验采用加样回收法试验。取含有量已知的艾叶样品粉末6份,每份约0.25 g,在每份样品中精密加入芦丁对照品适量,依法制备供试品溶液进行测定,计算回收率。结果见表2,结果表明该测定方法回收率良好。
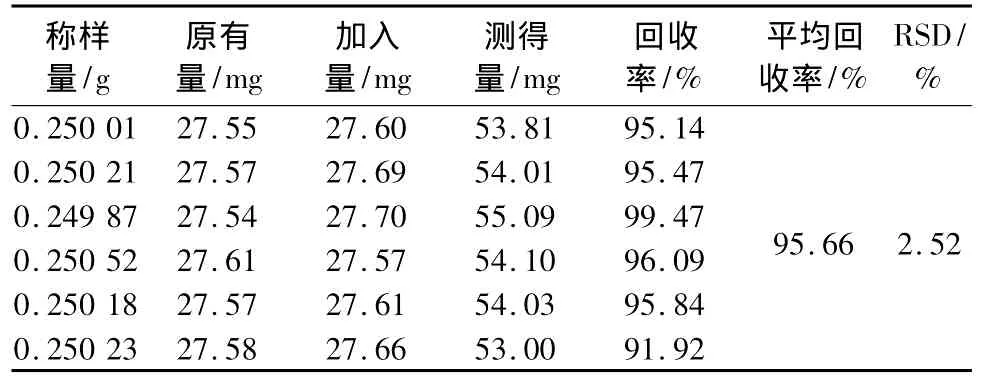
表2 回收率试验结果Tab.2 Results of recovery tests
综上,该方法测定结果准确、稳定性好,可作为艾叶总黄酮的定量测定方法。
2.3.3 综合评分标准以综合加权评分的方法对各炮制品进行评价,两指标加权系数分别为0.5。计算方法如下:综合评分=(样品性状得分×50/9份样品最高分)+(样品总黄酮含有量×50/9份样品最高含有量);以综合评分为评价指标,对结果进行分析。结果见表3和表4。

表3 正交试验结果计算表Tab.3 Results of orthogonal tests
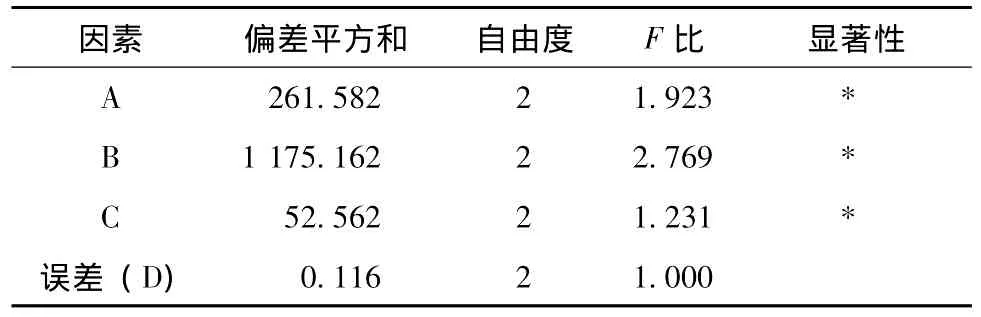
表4 方差分析Tab.4 Analysis of variance
2.4 结果分析直观分析:由极差(R)可以看出:对综合评分影响大小依次为B>A>C。其中A因素>>,B因素>>,C因素>>。
方差分析:A、B和C因素均对实验结果有显著性影响。
综合直观分析和方差分析结果,将醋艾叶最佳炮制工艺确定为A2B2C3,即取辅料醋,每100 g艾叶加醋15 g,与适量水混匀后,加入到净艾叶饮片中拌匀,闷润,220℃炒制28 min,取出,晾凉。
3 工艺验证
取生艾叶饮片(每份500 g),照确定的最佳工艺参数制备醋艾叶饮片,对其进行性状评分和总黄酮测定,结果见表5。

表5 验证结果Tab.5 Results of confirmatory experiment
由表5可见,制备得到的醋艾叶饮片性状均符合要求,总黄酮含量RSD小于3%,表明该工艺稳定可行,得到的成品质量稳定。
4 毒性比较
艾叶醋炙的目的为降低毒性,保证临床用药安全。实验室前期研究证实艾叶毒性部位为挥发油和甲醇提取部位,为验证优选的工艺是否达到了减毒的目的,分别提取生、醋艾叶挥发油和甲醇部位,进行了急性毒性比较研究。
4.1 动物及条件昆明种SPF级小鼠(20±2)g,雌雄各半,由山东大学实验动物中心供应,许可证号:SCXK(鲁)20090001。实验环境:山东省中医药研究院实验动物中心,许可证号:SYXK(鲁)20050052,SPF级。
4.2 饮片提取物制备挥发油:照《中国药典》2010年版一部附录ⅩD挥发油测定法甲法提取挥发油,用时以玉米油稀释。
甲醇提取部位:采用索氏提取法,石油醚脱脂、并用乙酸乙酯提取后,弃去提取液,药渣挥干溶剂,用甲醇进行提取和富集,作为甲醇提取部位,用时以1%CMC-Na混悬,浓度均以生药计算。
4.3 试验方法照急性毒性试验要求先进行急性毒性预试验,确定生、醋艾叶油致小鼠100%死亡的最小剂量,初步摸索r值,然后设计不同剂量组进行试验。采用孙瑞元等制定的新药最新统计软件Ver1.0DAS Bliss计算LD50。
4.3.1 艾叶及醋艾叶挥发油毒性比较预试验结果,生艾叶油致小鼠100%死亡的最小剂量为5.24 mL/kg,醋艾叶为20.00 mL/kg,以此为据,分别设计6个剂量组,进行试验。结果见表6。
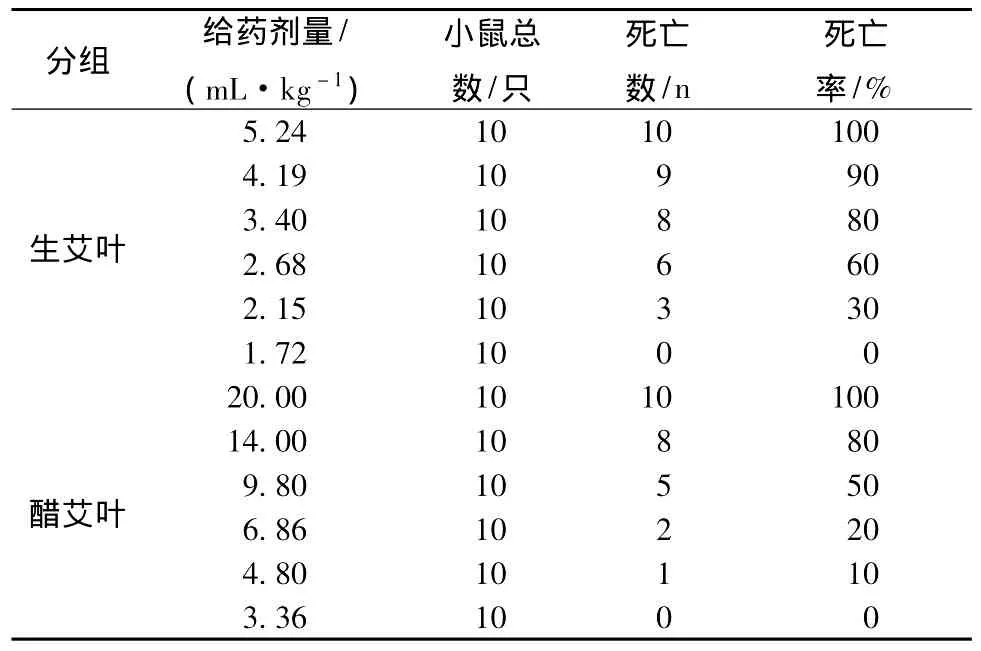
表6 挥发油部位试验结果Tab.6 Results of volatile oil fraction
通过统计,生艾叶油LD50=2.62 mL/kg,95%的可信度区间为2.30~2.99 mL/kg。醋艾叶油LD50=9.43 mL/kg,95%的可信度区间为7.74~11.5 mL/kg。
4.3.2 艾叶与醋艾叶甲醇部位急性毒性比较预试验结果,生艾叶甲醇部位致小鼠100%死亡的最小剂量为216 g/kg。醋艾叶甲醇部位以1%CMC-Na混悬至最大质量浓度4.8g/mL,ig给药0.4 mL/10 g,未发现小鼠死亡。结果见表7。
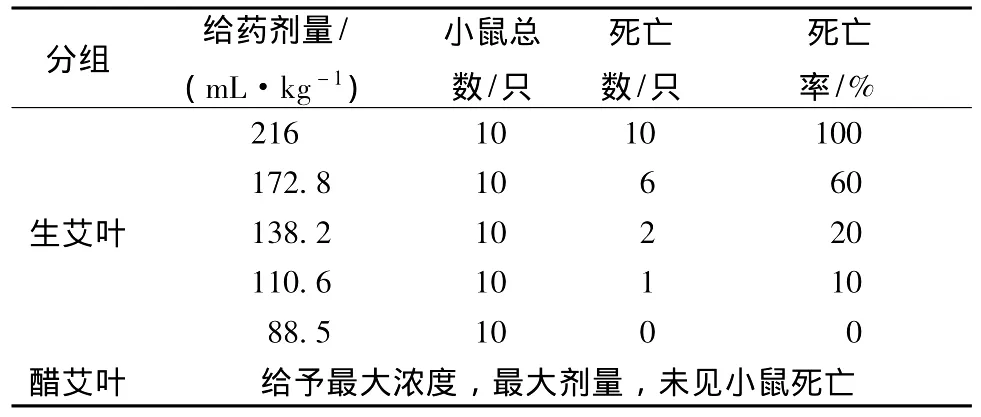
表7 甲醇部位试验结果Tab.7 Results of methanol fraction
通过统计,生艾叶甲醇部位LD50=157.5 g/kg,95%的可信度区间为140.7~176.3 g/kg。醋艾叶甲醇部位未见毒性。
4.4 结果通过急性毒性试验比较,可见采用本实验优选工艺制备的醋艾叶与生艾叶相比,挥发油部位毒性明显降低,甲醇部位醋品未见毒性。
5 小结与讨论
采用综合评分法对实验结果进行分析,可以兼顾到传统质量评价和内在质量评价双重指标,能够更加客观全面的反映各因素水平对醋艾叶质量的影响。经过试验,在加醋量、炒炙温度和炒炙时间方面确定了具体参数,具体为:取辅料醋(每100 g艾叶加醋15 g),与适量水混匀后,加入到净艾叶饮片中拌匀,闷润,220℃炒制28 min,取出,晾凉。验证实验结果表明,优选的醋艾叶炮制工艺稳定可行。
急性毒性试验结果表明,艾叶经醋炙后,其毒性明显降低,表明确定的炮制工艺制备的醋艾叶可明显降低艾叶毒性,达到了炮制减毒的目的,
本实验可规范醋艾叶的炮制工艺,保证醋艾叶饮片的质量以及临床用药安全有效。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:82.
[2]Hwang Y C,Jenkins E M.Effect of acupuncture on young pigswith induced entropathogenic Escherichia coldarrhea[J].Am J Vet Res,1998,49(9):1641.
[3]孙红祥.一些中药及其挥发性成分抗霉菌活性研究[J].中国中药杂志,2001,26(2):9.
[4]谢强敏,卞如濂,杨秋火,等.艾叶油的呼吸系统药理研究Ⅰ—支气管扩张、镇咳和祛痰作用[J].中国现代应用药学杂志,1999,16(4):16.
[5]朱文莲,赵连珠,王佩.艾灸对小鼠巨噬细胞吞噬功能影响的实验观察[J].针刺研究,1999,24(2):143.
[6]李慧.艾叶的药理研究进展及开发应用[J].基层中药杂志,2002,16(3):51.
[7]中华人民共和国卫生部药政管理局.全国中药炮制规范[S].北京:人民卫生出版社.1988:249-250.
[8]江西省卫生厅药政管理局.江西省中药炮制规范[S].上海:上海科学技术出版社,1991:168.
[9]山东省药品监督管理局.山东省中药炮制规范[S].山东:山东友谊出版社,2002:330.
[10]肖培根,李大鹏,杨世林,等.新编中药志:第三卷[M].北京:化学工业出版社,2002:431.
[11]宋立人,洪恂,丁绪亮,等.现代中药学大辞典:上册[M].北京:人民卫生出版社,2001:520.
[12]王锦军,黄兆文,李瑶瑶.艾叶化学成分的研究[J].药学服务与研究,2008,8(6):465-466.
[13]王锦军,黄兆文.等度反相高压液相色谱法同时测定艾叶中四种黄酮化合物的含量[J].分析试验室,2008,27(S1):444-447.

