侵袭性纤维瘤病的影像诊断及临床治疗分析
福建省肿瘤医院 1.放诊科;2. 病理科(福建 福州 350014)
郑德春 陈韵彬 陈 英 曹喜生 张和军
侵袭性纤维瘤病(Aggressive Fibromatosis,AF)是一种少见的、生长缓慢的间叶源性肿瘤,起源于肌肉、筋膜或腱膜,呈侵袭性生长,术后复发率高,但不发生远处转移。早期定性诊断及明确病变的侵犯范围,有助于制定手术计划,对减少术后复发有重要意义。本研究为总结侵袭性纤维瘤病的影像特点及临床干预策略,提高对本病诊疗的认识。
材料与方法
收集我院2006-01~2011-08经病理证实的侵袭性纤维瘤病30例。性别:女性22例(73.3%),男性8例(26.7%);年龄:8岁~73岁(平均37.7岁,中位年龄35岁),其中:<10岁1例(3.3%),10~29岁11例(36.7%),30~49岁11例(36.7%),50~69岁6例(20%),>70岁1例(3.3%);症状:25例无明显症状,1例位于胸腔表现为活动后气促,2例位于胸壁表现为胸痛或胸闷,2例位于盆腔表现为疼痛、坠胀不适;病程:1天~5年不等。
MRI使用GE SIGNA EXCITE III HD 1.5T超导型磁共振成像仪,根据部位选用头颈联合或体部表面线圈,行轴、冠、矢状位扫描,T1WI(TR 450~600ms,TE 12~16ms),T2WI(TR 4500~5000ms,TE 114~128ms),层厚5~8cm,间距5~10mm,增强对比剂使用Gd-DTPA,用量0.15ml/kg,打药速率1.5ml/s。
CT使用日本东芝多排探器计算机断层仪(16 multiple detector computed tomography MDCT),层厚和层间距5mm,螺距1.0mm,增强使用非离子型对比剂。
结 果
2.1 部位、大小及境界 病变位于头颈部有3例(10%),其中胸锁乳突深面肌间隙2例,大小为4.5cm×3cm和5cm×4.5cm(1例与迷走神经粘连,边界清楚;1例与颈丛粘连,累及颈侧肌群,边界不清);右腮腺1例,病灶大小为4cm×3cm,边界不清,与面神经颞面干相连。病变位于胸部6例(20%),其中前胸壁4例,大小为3.8cm×2.2cm~12cm×9cm(2例累及肌肉结构或肋骨,边界欠清;脊柱旁沟1例,边界清楚;术后复发1例);右胸腔1例,大小为20cm×15cm,与胸膜及下肺韧带粘连;右肺中叶1例,大小为2cm×1.5cm,边界清楚。腹部12例(40%),其中前腹壁6例,大小为2.0cm×1.5cm~13cm×6.5cm(腹内斜肌、腹直肌各2例,边界清楚;术后复发2例,边界清楚);腹腔4例,大小为4.0cm×3.0cm~7.7cm×7.0cm,边界清楚;盆底2例,大小为7cm×5cm和7.5cm×4.8cm,边界清楚。臀部及四肢9例(30%),边界模糊或清楚,上肢3例,臀部4例,下肢2例;其中术前检查3例,术后复发6例。
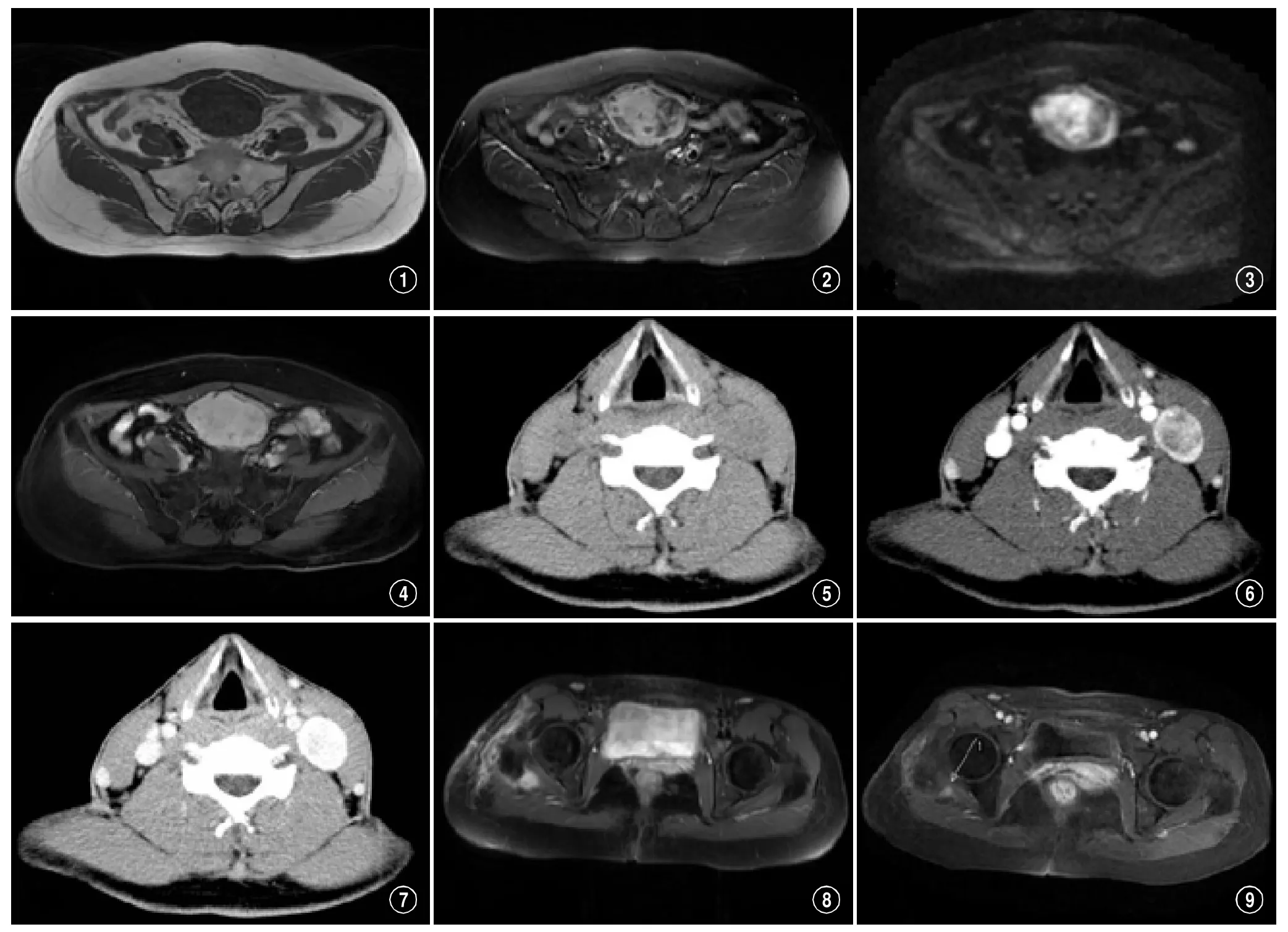
图1-4患者,女性,49岁,肠系膜侵袭性纤维瘤病,呈椭圆形,边界清楚。图1:T1WI呈不均匀等低信号;图2:T2WI(压脂)呈不均匀高信号;图3:DWI(b值=800)呈不均匀高信号;肿瘤内见T1WI、T2WI、DWI低信号区;图4:增强后肿块明显强化,低信号区强化较轻。图5-7患者,男性,37岁,左颈深部侵袭性纤维瘤病,边界清楚。图5:平扫呈等密度;图6:增强后见不均匀强化,中央见轻度强化区;图7:延迟3分钟扫描肿瘤进一步强化,强化范围扩大。图8、9患者,女性,17岁,右臀部侵袭性纤维瘤病。图8:术后深部肿瘤结节残留,边界清楚;图9:术后补充放疗结束复查肿瘤结节明显退缩(白色箭头示)。
2.2 MRI、CT表现 20例MRI检查:11例为术前检查,表现为大小不等的实性肿瘤,信号T1WI呈等信号(9例)或稍低信号(2例),T2WI呈稍高信号,9例(82%)瘤内见索条状、片状或星芒状长T1短T2低信号纤维成分区,2例(18%)内部可见小片状长T1长T2玻璃样变信号区,DWI示肿块呈不均匀明显高信号,中间见低信号区,增强后大多数均匀明显强化,边界清楚,瘤体内低信号区强化程度较轻或无强化(图1-4)。肿块形态9例呈爪状或分叶状(2例为多发病灶),2例呈梭形或椭圆形,见假包膜。9例术后复发,3例为多发病灶,信号及强化表现与典型的侵袭性纤维瘤病MRI表现相似。
10例CT检查:平扫呈稍低密度,密度不均匀,CT值为38-64HU,8例行增强扫描,增强后不均匀轻度强化者5例,CT值为41-52HU,不均匀明显强化者3例,CT值为145-157HU,1例3分钟扫描呈延迟强化,强化趋于均匀(图5-7);边界清楚4例,边界模糊6例。
2.3 病理及免疫组织化学特征 病理标本常规HE染色示肿瘤由成纤维细胞、纤维细胞及胶原纤维束组成,不同病例间三种成分的比例存在较大差异,成纤维细胞和纤维细胞无明显异形性。本组共14例行诊断性免疫组织化学分析,所检测指标不尽相同,各主要指标的阳性率为:8/9例(88.9%)呈Vim阳性、8/13例(61.5%) CD34阳性、8/9例(88.9%)呈Bcl-2阳性、6/6例(100%)呈CD99阳性、5/13例(38.5%)呈SMA阳性、2/11例(18.2%)呈Des灶性阳性,1/5例(20%)呈EMA灶性阳性。8例Ki-67表达显示:6例(75%)小于5%,2例(25%)约10%。
2.4 治疗及随访 30例中,1例仅行CT引导穿刺活检。2例术中见与神经干或血管粘连紧密,仅行部分切除术。27例行根治性肿物切除,首次手术者18例,术中探查10例周界清楚或见假包膜,切除完全,7例境界不清,经严密分离与其粘连的肌组织、骨膜和粘连或包绕的神经后,予以完整切除,1例为多发灶,术后残留;复发手术者9例,术中探查境界欠清,将肿瘤与部分周围组织一并切除,8例完全切除,1例术后切缘残留。术后8例接受补充放疗,肿瘤放疗后缩小(图8、9)。随访:术后10例有MRI随访,时间1月~5.5年,3例复发。
讨 论
3.1 侵袭性纤维瘤病的临床及病理特点 侵袭性纤维瘤病可发生于身体任何部位,年发病率约为3~4例/100万人口;女性多见(本组22例,73.3%),大多数发生于15~50岁之间,本组22例年龄在17~50岁间,占73.3%,与文献报道相符[1]。该病病因不清,综合文献报道本病的发生与遗传、外伤、手术、激素水平等因素有关。部分与肠腺瘤样息肉病有关,约10%的患者为加德纳(Gardner)综合征的肠外表现的一部分[2]。约25%的患者局部病灶有创伤史,Goy等[3]报道61例中19例发生在曾经手术部位,从手术创伤到发生侵袭性纤维瘤病的时间平均为2.75年。Wilcken报道了侵袭性纤维瘤病绝经后或运用他莫昔芬治疗时缓解,当口服避孕药后侵袭性纤维瘤病进展[4-5]。临床上大多数表现为无痛性缓慢生长的肿块,少数有疼痛和压迫症状(如气喘、肢体活动障碍等),症状与肿瘤所在部位、大小、周围结构和神经等受累有关。
2002 年WHO病理学分类将侵袭性纤维瘤病与韧带瘤和肌肉腱膜纤维瘤定义为同义词,归纳为纤维母细胞和肌纤维母细胞肿瘤及肿瘤样病变[6],目前倾向使用侵袭性纤维瘤病。镜下肿瘤由梭形纤维母细胞及胶原纤维构成,细胞核分裂像极少,呈浸润性生长。复发瘤与原发瘤在组织结构上无差别[7]。本组资料显示:大多数呈Vim、Bcl-2和CD99阳性,SMA阳性率为38.5%(5/13),CD34阳性率为61.5%(5/13);而Des和EMA很少阳性,共计3/16个标本呈灶性阳性;结果与文献报道不尽相符[8-9],考虑与取材部位等有关。陈文昌等[10]研究表明,Ki-67表达与侵袭性纤维瘤病的复发呈正相关。本组8例Ki-67均为I级表达。
3.2 侵袭性纤维瘤病的影像特征 近几年关于侵袭性纤维瘤病的影像表现尤其是MRI表现有较多的报道。随中高场强MR扫描机的普及,MRI正逐渐取代CT,成为软组织肿瘤诊断和鉴别诊断首选影像学方法,是影像和临床医师的共识。
MRI显示肿瘤多呈浸润性生长,累及一块或多块肌肉,边缘呈分叶状、爪状,本组15/20例(75%),少部分呈类圆形、梭形,本组5/20例(25%)。其MRI信号及强化程度与瘤体内部的细胞成分、胶原纤维成分比例以及间质血管的多少有关[11-13]:瘤体内胶原纤维为主的区域呈T2WI和T1WI双低信号,增强后无或轻度强化,是侵袭性纤维瘤病重要MRI特征;而以细胞成分为主的区域,呈T1WI等信号、T2WI高信号,增强后见明显强化。本组20例均具有上述特征。DWI序列有助于多发病灶的检测,协助定性诊断[14-16]。增强序列能更好的显示肿瘤的边界、边缘毛刺等特征。因此术前检查和术后随访均应增强扫描。
CT技术广泛应用于胸腹部疾病尤其是肿瘤的检查。平扫肿物呈等密度或不均匀等低密度,增强后不均匀轻度强化,少部分可明显强化,本组3例呈明显强化。延迟扫描进一步强化,强化趋于均匀,对诊断本病具有提示作用[15],对中青年女性的胸、腹壁或肢体等软组织内肿物,尤其是影像评估肿瘤有沿筋膜间隙浸润生长的特征时,诊断应考虑本病可能[17,18]。
3.3 鉴别诊断 鉴别诊断思路随肿瘤发生部位不同而不同。发生头颈部、胸腹壁、臀部及四肢软组织内的AF,主要应与神经源性肿瘤、纤维肉瘤、恶性纤维组织细胞瘤、骨化性肌炎、绒毛结节性滑膜炎、骨巨细胞瘤等鉴别;发生于腹盆腔者,应与间质瘤,子宫或卵巢来源肿瘤、神经源性肿瘤、淋巴瘤、恶性纤维组织细胞瘤、腹膜后纤维化等鉴别;发生于胸腔者,应与胸膜间皮瘤、原始神经外胚细胞瘤等鉴别。
3.4 侵袭性纤维瘤病的临床干预策略及疗效 侵袭性纤维瘤病是较难进行彻底根治,治疗后易复发。手术切除是首选方法,由于肿瘤多发生于深部,且与周围神经、血管、骨膜粘连,关系密切,故有时难以整块切除,本组2例无法切除,2例术后残留。本病术后复发率的文献报道不尽一致,在15%~65%之间,Mankin等对234例腹壁外侵袭性纤维瘤病长达62个月的随访,复发率为16.7%[19]。
对于肿瘤无法切除或残留者,可采取放射治疗或药物治疗。放疗的有效性目前仍有争议,部分病例放疗后可达到控制甚至痊愈的效果,Guney[20]对7例接受放疗患者进行15个月随访的结果显示,3例达到根治,3例带瘤生存,1例死亡。我院主要应用于术后补充放疗,平均处方剂量在60Gy左右,放疗后残留病灶明显退缩。药物治疗包括细胞毒性药物和非细胞毒性药物两类,均有一定的效果[21]。由于本病与雌激素关系密切,国内外均有报道应用三苯氧胺或他莫昔芬对本病治疗有一定疗效,但对绝经后和有生育要求的妇女有应用限制。
总之,MRI对侵袭性纤维瘤病具有很高诊断价值,在肿瘤定位及周界描绘方面优于CT,在判断瘤内纤维成分、出血、与神经血管关系优于CT, 结合临床病史等特征多能做出正确诊断,是本病检查和随访的首选方法。手术切除是本病治疗的首选,放射治疗或药物治疗能进一步巩固疗效,减少残留和复发。
1.朱莉莉,姚伟武,李文彬,等.MRI在侵袭性纤维瘤诊断中的应用[J].上海交通大学学报医学版,2008,28:21-23.
2.Nieuwenhuis MH,De W,Botma A,et al.Desmoid tumors in a Dutch cohort of patients with familial adenomatous polyposis[J].Clin Gastroenterol Hepatol,2008,6(2):215-219.
3.Goy BW,Lee SP,Eilber F,et al.The role of adjuvant radiotherapy in the treatment of resectable desmoid tumors[J].Int J Radial Oncol Biol Phys,1997,39(3):659-665.
4.Wilcken N,Tattersall MH. Endocrine therapy for desmoid tumors[J].Cancer,1991,68(6):1384-1388.
5.Maseelall P,Robins JC,Williams D,B,et al. Stabilization and regression of a recurrent desmoid tumor with the antiestrogen toremifene[J].Fertil Steril,2005,84(2):509-509.
6.Juan Rosai,回允中. 外科病理学(第9版)[M].北京:北京大学医学出版社,2006:2249-2252.
7.Lee JC,Thomas JM,Phillips S,et al.Aggressive Fibromatosis: MRI features with pathologic correlation[J].AJR,2006,186:247-254.
8.苏金亮,周利民,纪建松,等.腹部侵袭性纤维瘤病的CT及MRI特征[J].放射学实践,2011,26(5):497-500.
9.周杭城,王志华,吴海波,等.韧带样型纤维瘤病21例临床病理分析[J].安徽卫生职业技术学院学报,2009,8(5):15-16.
10.陈文昌,胡世平,郑松龄,等.ki-67在纤维瘤病的表达及临床意义[J].福建医科大学学报,2001,35(4):380-381.
11.杨献峰,江波,朱斌,等.MRI对侵袭性纤维瘤病的诊断价值[J].医学影像学杂志,2008,18(2):147-150.
12.苏金亮,周利民,纪建松,等.腹部侵袭性纤维瘤病的CT及MRI特征[J].放射学实践,2011,26(5):497-500.
13.江波,杨献峰,赖英荣,等.肢体软组织侵袭性纤维瘤病组织病理特征的MRI研究[J].中华放射学杂志,2009,43(2):141-145.
14.张禹,朱友志,康健,等.DWI结合常规MRI在侵袭性纤维瘤病诊断中的作用[J].放射学实践,2010,25(4):426-429.
15.陈金勇,陈远钦.肾上腺神经纤维瘤一例[J].中国CT和MRI杂志,2010,8(5):78.
16.陈冉,徐德龙,杨庆军.胸壁侵袭性纤维瘤病1例报道[J].罕少疾病杂志,2000,7(3):45.
17.陈宇,罗德红,石木兰.深部侵袭性纤维瘤病的CT表现[J].临床放射学杂志,2002,21(3):218-221.
18.李腾飞,李臻,吴刚,等.多发性神经纤维瘤病合并肝恶性神经鞘瘤1例[J].中国CT和MRI杂志,2009,7(5):77-78.
19.Mankin HJ,Hornicek FJ,Springfield DS. Extra-abdominal desmoid tumors:a report of 234 cases[J].J Surg Oncol,2010,102(5):380-384.
20.Guney Y, Hi?s?nmez A, Andrieu MN,et al. Outcome of aggressive fibromatosis treated with radiation therapy[J].Scott Med J,2007,52(4):11-14.
21.Janinis J,Patriki M,Vini L,et al.The pharmacological treatment of aggressive fibromatosis: a systematic review[J].Ann Oncol,2003,14(2):181-190.

