我国分离的10株狂犬病病毒P和M蛋白基因序列分析*
解庭波,黄思佳,明平刚,吴 杰,徐葛林,严家新
我国分离的10株狂犬病病毒P和M蛋白基因序列分析*
解庭波,黄思佳,明平刚,吴 杰,徐葛林,严家新
目的探讨我国狂犬病病毒P、M蛋白基因序列的结构特点及变异情况。方法用RT-PCR方法从分离的10株具有代表性的狂犬病病毒中获得目的基因片段,测定核苷酸序列后,利用生物信息学软件分析核苷酸、氨基酸序列及其相关的功能位点并构建P、M蛋白基因的系统发育树。结果10株病毒P和M基因核苷酸序列同源性分别为85.9%~99.4%和89.5%~99.5%,推导出的氨基酸同源性分别为92.3%~100%和96.0%~99.5%。在核苷酸及氨基酸水平上,10株病毒与我国分离的街毒株HN10及CTN疫苗株的P、M基因同源性均明显高于国外其它疫苗株、标准攻击毒CVS株相应的同源性。系统发育分析表明,10株病毒与我国湖南街毒株、CTN疫苗株进化关系最近,而与研究中选取的其他毒株进化关系较远。氨基酸对位分析表明,与其它基因1型毒株相比,本研究中10株狂犬病病毒的P、M基因出现多处变异,但很少在功能区发生变异。结论分离的10株病毒属基因l型狂犬病病毒,与我国分离的街毒株及CTN疫苗株关系较近。
狂犬病病毒;遗传特征;P基因;M基因
狂犬病病毒(Rabies virus,RV)属弹状病毒科狂犬病毒属,为单股负链RNA病毒,病毒基因组长约12 kb,分为7个功能区,从3′至5′方向依次为3′非编 码 区 (3′leader)-N-P-M-G-L-5′非 翻 译 区 (5′trailer),分别编码核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)和转录酶大蛋白(L)。研究表明,除G蛋白外,P蛋白和M蛋白也与狂犬病病毒的致病性相关[1]。P蛋白与N蛋白、L蛋白共同构成核糖核蛋白(RNP)包裹着病毒RNA,和L蛋白一起在病毒的转录和复制中发挥着重要作用[2]。此外,M蛋白决定了病毒的组装和出芽[3],即使在没有其它病毒成份存在的情况下,仍然能够从细胞中以出芽的方式释放出来,而且能够与病毒糖蛋白(G)相互作用使其整合到新生病毒中,参与宿主的免疫反应。近年来还发现M蛋白与宿主神经元的凋亡有关[4]。
随着分子生物学的迅速发展,对狂犬病病毒分子结构的认识逐渐深入,但是在狂犬病毒遗传变异方面的分析研究主要集中在N、G基因,而关于P、M基因序列的报道还较少。为了解我国狂犬病病毒P、M基因序列和结构特点,本研究选取我国在不同地域分离的10株狂犬病病毒,用RT-PCR方法扩增P、M基因编码区序列并进行序列测定,通过与GenBank中具有代表性的狂犬病病毒及疫苗株的P、M基因序列信息在分子水平上进行同源性分析、主要功能位点比较和种系发生分析,探讨中国狂犬病病毒P、M基因的遗传特点、进化规律等分子生物学特征。
1 材料与方法
1.1 病毒毒株 从武汉生物制品研究所狂犬病检测中心收集的街毒株中选取10个在地域上具有代表性的(不同的省份及地区)街毒株,其代码及分离地区见表1。将以上毒株接种于1~2日龄乳鼠脑,取发病后死亡的脑组织用于RNA提取。
1.2 主要试剂 TRIzol购自Invitrogen公司,MMLV反转录酶为大连宝生物公司产品,Go Taq Green Mix DNA聚合酶购于Promega公司,凝胶回收试剂盒QIAquick Gel Extraction Kit购于QIAGEN公司。
1.3 引物设计 参考GenBank中收录的多株狂犬病病毒序列,针对P、M基因的编码区分别设计上、下 游 引 物。 序 列 如 下:M-F:CAGGCAACACCACTGATAAAATGAA;M-R:TCTCTCCTCCAGAGGTAAACAAGTG(扩增区域2476-3153 bp;预期长度678 bp),P-F:TAACACCCCTCCTTTT
GAACCAT;P-R:GTGGTGTTGCCTGTTTTTT
TCAT(扩增区域1484-2488 bp;预期长度:1005 bp)。两对引物由南京金斯瑞公司合成。
1.4 病毒RNA的提取 取阳性脑组织100 mg,加入1 m L TRIzol充分研磨,然后用力振荡混匀,室温静置5 min。加入氯仿250μL,振荡混匀后室温静置5 min;4℃13 000 r/min离心15 min;将上清小心转入新的1.5 m L离心管,加入等体积的异丙醇,混匀后置-20℃1 h。随后,4℃13 000 r/min离心10 min;弃上清,加入1.2 m L 75%乙醇,在振荡器上振荡悬浮沉淀,4℃12 000 r/min离心10 min;小心弃上清,在超净台内吹干,加20μL DEPC水溶解RNA样品。提取的RNA立即用于cDNA合成或-80℃冻存备用。
1.5 逆转录及P、M基因的扩增 以pd(N)6为引物,反转录合成病毒基因组cDNA。以此为模板PCR反应扩增P、M基因。PCR反应体系为:Go Taq Green Mix 25μL,去离子水21μL,cDNA模板2μL,浓度为10 pmol/μL的P、M 基因特异性上、下游引物各1μL。PCR循环参数为:94℃ 预变性5 min;94℃30 s,52℃30 s,72℃60 s,共30个循环;72℃延伸10 min。扩增后的基因片段经1%凝胶电泳鉴定,将鉴定后的PCR产物用凝胶回收试剂盒QIAquick Gel Extraction Kit回收,回收后的PCR产物送南京金斯瑞公司测序。
1.6 DNA序列的测定及分析 利用ATGC软件对测序结果进行拼接和手工校对;利用BioEdit软件对序列文件进行剪切、拼接;使用DNAStar软件包中的Meg Align模块对基因所编码的氨基酸进行对位分析;将测定的序列与GenBank中具有代表性的国内外狂犬病病毒街毒株及疫苗株(表1)的P和M基因核苷酸和氨基酸序列进行比对和分析,序列比对使用 Clustal X1.83;用 MEGA 4.1软件以Kimura two-parameter模型邻位相连法(NJ)构建基因的系统发育树。
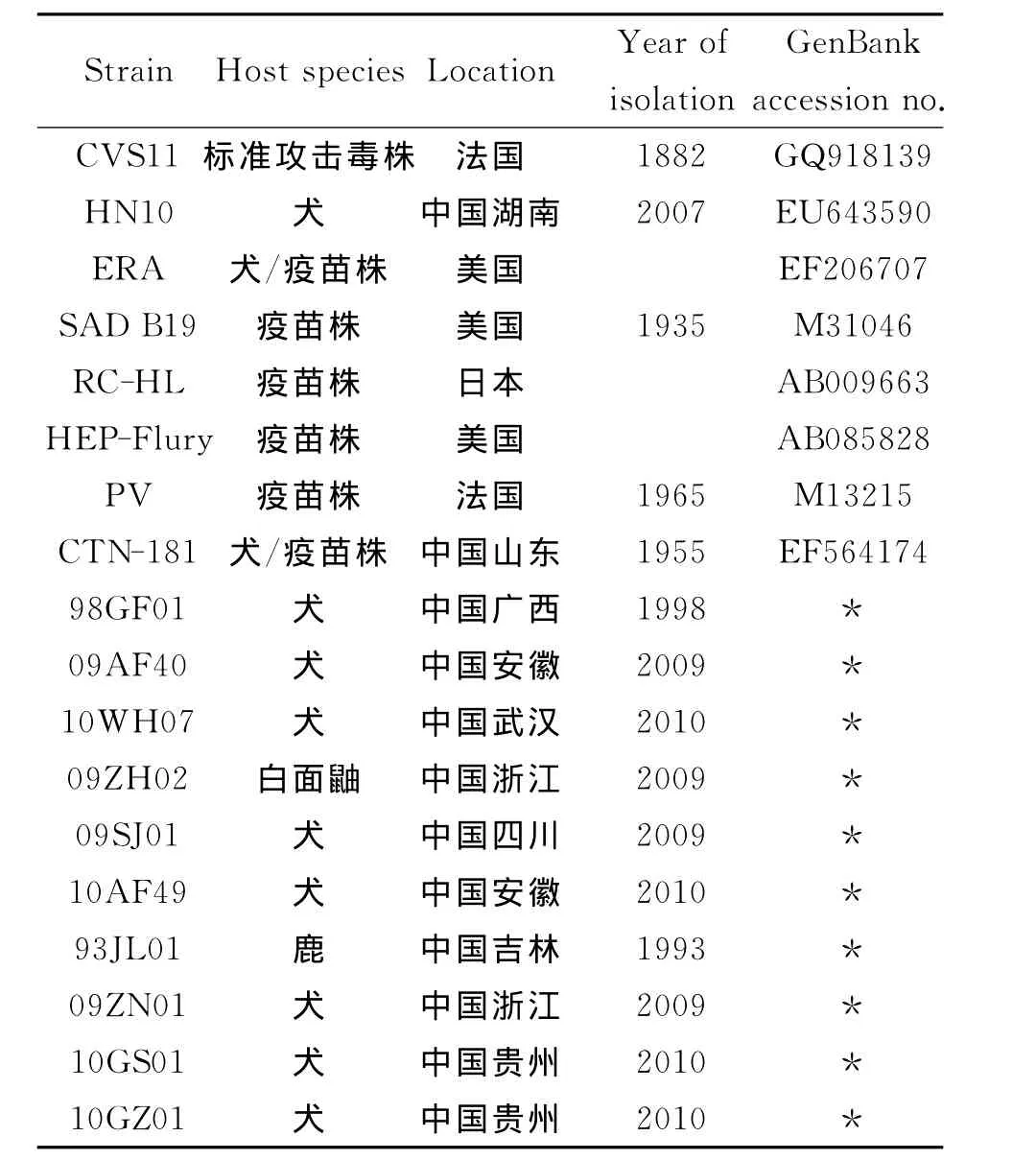
表1 本研究中使用的狂犬病病毒P蛋白和M蛋白基因序列Tab.1 P and M gene of rabies viruses used in this study
2 结 果
2.1 狂犬病病毒P、M基因扩增结果 10株狂犬病病毒P、M基因扩增片段分别为1 005 bp和678 bp左右,与预期大小相符,结果见图1和图2。

2.2 狂犬病病毒P基因测序结果及分析 序列分析表明,10株狂犬病病毒P基因完整开放阅读框(ORF)全长均为894 bp,编码长度为297个氨基酸残基。10株病毒彼此之间核苷酸及氨基酸同源性分别在85.9%~99.4%和92.3%~100%之间。其中09ZH02与10GZ01核苷酸同源性最低(85.9%),10GS01与10GZ01核苷酸同源性最高(99.4%)。将这10株病毒的P基因核苷酸序列与国内外其他代表性街毒株和疫苗株的P基因核苷酸序列进行比较,核苷酸同源性在80.5%~93.4%,氨基酸同源性在84.2%~99.3%(表2)。将分离的10株病毒氨基酸序列进行比对,P蛋白与L蛋白主要作用区域的前19位氨基酸中,除了10GS01第3位氨基酸为E外,其余均一致。P蛋白与LC8相互作用位点的143~148位氨基酸中,除09ZH02第144位氨基酸为R外,其余序列均为DKSTQT。P蛋白63-64位和162、210、271位氨基酸残基具有特定的蛋白激酶磷酸化丝氨酸位点,10株狂犬病病毒在这些位点的氨基酸均为P、S、S、S、S,与CTN株一致。利用核苷酸序列建立P基因NJ进化树,见图3。从进化树分析,分离的10株狂犬病病毒P基因与我国湖南以往分离的街毒株HN10以及我国人用狂犬病疫苗株CTN有着较近的系统发育关系,处于同一个亚群。而国外的病毒株以及疫苗株在系统发育树上构成另一个亚群。
2.3 狂犬病病毒M-基因测序结果及分析 序列分析表明,10株狂犬病病毒M基因完整开放阅读框(ORF)全长均为609 bp,编码长度为202的氨基酸残基。10株病毒彼此之间核苷酸及氨基酸同源性分别在89.5%~99.5%和96.0%~99.5%之间。其中93JL01与10GS01核苷酸同源性最低(89.5%),09ZN01与10GZ01核苷酸同源性最高(99.5%)。将这10株病毒的M基因核苷酸序列与国内外其它代表性街毒株和疫苗株的M基因核苷酸序列进行比较,核苷酸同源性在82.3%~97%,氨基酸同源性在91.6%~99%(表2)。本研究中测定的10株狂犬病病毒M蛋白N端35~38位氨基酸残基为高度保守的富含脯氨酸序列,即PPEY,与其他比较的毒株一致。M蛋白第58位氨基酸残基对调整病毒转录和复制的平衡具有关键作用,10株病毒M蛋白的第58位氨基酸残基均为谷氨酰胺残基(E),显示出高度保守性。利用核苷酸序列建立M基因NJ进化树,见图3。从进化树分析,分离的10株狂犬病病毒M基因与我国湖南以往分离的街毒株HN10以及我国人用狂犬病疫苗株CTN有着较近的系统发育关系,处于同一个亚群。而国外的病毒株以及疫苗株在系统发育树上构成另一个亚群。
3 讨 论
本研究中我们从武汉生物制品研究所狂犬病检测中心收集的121株街毒株中选取了10株。为了使选取的样品具有代表性,在地域上我们选择的是我国范围内不同的省份及地区所分离的街毒株,包括像安徽、广西、贵州这样的狂犬病高发区。在时间跨度上,我们主要选择的是近3年分离的狂犬病病毒,也包括1993年和1998年本中心收集到的比较早的街毒株样品。另外从分离病毒的宿主中,我们既选择了从狂犬病病毒的主要携带者——犬中分离的病毒,也选择了白面鼬和鹿这样的野生动物中分离的毒株。研究中,我们将以上收集的毒株接种于乳鼠脑,取发病后死亡的脑组织提取RNA、RT-PCR、序列测定和后续的序列分析。
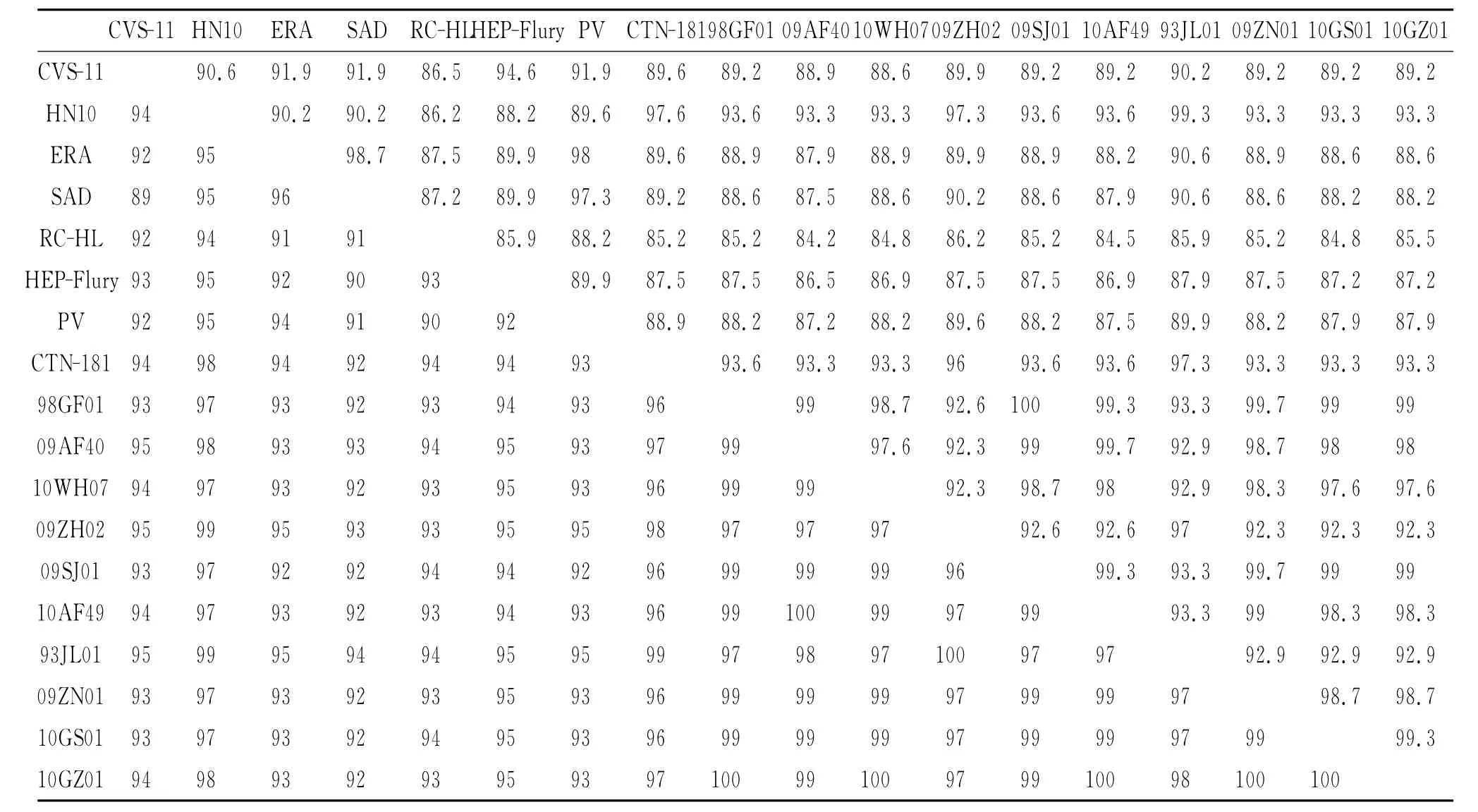
表2 我国10株狂犬病病毒与代表性的街毒株和疫苗株P和M基因氨基酸序列同源性的比较(%)Tab.2 Comparison of amino acid sequences of P and M gene between 10 Chinese rabies viruses and the representative street strains and vaccine strains(%)

图3 狂犬病病毒P和M基因系统发育树Fig.3 The phylogenetic tree of RV P and M gene
通过同源性分析发现,10株病毒彼此之间P蛋白核苷酸及氨基酸同源性分别在85.9%~99.4%和92.3%~100%之间,M蛋白核苷酸及氨基酸同源性分别在89.5%~99.5%和96.0%~99.5%之间,均在文中参考的其它基因1型狂犬病毒彼此同源性范围内,因此属基因1型狂犬病病毒。从进化树分析,分离的10株狂犬病病毒P基因和M基因与我国湖南以往分离的街毒株HN10以及我国人用狂犬病疫苗株CTN有着较近的系统发育关系,处于同一个亚群。而国外的病毒株以及疫苗株在系统发育树上构成另一个亚群。
P蛋白是一个多功能型蛋白,一方面它与可溶性的N蛋白结合形成N-P蛋白复合物以防止N蛋白的自身聚合,保持N蛋白形成核衣壳时所需的最佳形式[5]。另一方面P蛋白作为一种非催化性的辅助因子,协同L蛋白参与病毒RNA的转录与复制。P蛋白的前19个氨基酸与L蛋白结合[6]以介导L蛋白的聚合酶活性中心与N-RNA复合物连接的方式参与基因组的表达[7]。本研究中10株病毒P蛋白前19位氨基酸中除了10GS01第3位氨基酸为E外,其余均一致。P蛋白139~172位区域能与胞浆内动力蛋白轻链(LC8)相互作用,LC8作为胞浆动力蛋白一部分,参与肌球蛋白V复合物的形成,驱动RV的逆轴浆运行[8],本研究中10株病毒的P蛋白在143~148位含有高度保守序列,序列均为DKSTQT。此外,P蛋白具有多种磷酸化形式,其磷酸化主要由狂犬病病毒蛋白激酶(RVPK)和蛋白激酶C(PKC)完成,这种磷酸化状态对其生物学功能的发挥具有重要作用。P蛋白氨基酸N端第63、64两位丝氨酸残基为RVPK作用位点,N端第162、210、271位丝氨酸残基为PKC作用位点,本次分离的10株病毒这些磷酸化位点均未发生变异。
M蛋白作为一种连接蛋白,它将核衣壳(RNP)和病毒糖蛋白连接在一起,它可以直接影响糖蛋白在病毒包膜表面的构型,在病毒形态形成中起着重要作用。M蛋白的PT/SAP、PPPY、Yxx 3个基序是有效的晚期出芽结构域(L-Domains),位于35~38位膜序(PPPY或者PY)富含脯氨酸[9],本次所测10株病毒序列该基序均是PPPEY。M蛋白对病毒转录具有负调控作用[10],其中第58位氨基酸残基对调整病毒转录和复制的平衡具有关键作用,10株病毒M蛋白的第58位氨基酸残基均为谷氨酰胺残基(E),显示出高度保守性。
研究中我们在对本检测中心分离的10株狂犬病病毒P、M基因序列进行比对和分析的基础上发现,各株病毒之间在核苷酸和氨基酸序列中发生了一些位点的变异,但在重要的功能位点上还是比较保守,与我国以往分离的街毒株和现在人用疫苗株CTN株关系较近。这为我国开展狂犬病分子流行病学研究,分析流行株与疫苗株之间的关系,评价疫苗对流行株的预防保护作用奠定了基础。
[1]Shimizu K,Ito N,Mita T,et al.Involvement of nucleoprotein,phosphoprotein,and matrix protein genes of rabies virus in virulence for adult mice[J].Virus Res,2007,123(2):154-160.
[2]Chenik M,Schnell M,Conzelmann KK.Mapping the interacting domains between the rabies virus polymerase and phosphoprotein[J].J Virol,1998,72(3):1925-1930.
[3]Mebatsion T,Weiland F,Conzelmann KK.Matrix protein of rabies virus is responsible for the assembly and budding of bulletshaped particles and interacts with the transmembrance spike glycoprotein G [J].J Virol,1999,73(1):242-250.
[4]Kassis R,Larrous F,Estaquier J,et al.Lyssavirus matrix protein induces apoptosis by a TRAIL-dependent mechanism involving caspase-8 activation [J].J Virol,2004,78 (12):6543-6555.
[5]Green TJ,Macpherson S,Qiu S,et al.Study of the assembly of vesicular stomatitis virus N protein:role of the P protein[J].J Virol,2000,74(20):9515-9524.
[6]Chenik M,Schnell M,Conzelmann KK,et al.Mapping the interacting domains between the rabies virus polymerase and phosphoprotein[J].J Virol,1998,72(3):1925-1930.
[7]Schoehn G,Iseni F,Mavrakis M,et al.Structure of recombinant rabies virus nucleoprotein-RNA complex and identification of the phosphoprotein binding site[J].J Virol,2001,75(1):490-498.
[8]Raux H,Flamand A,Blondel D.Interaction of the rabies virus P protein with the LC8 dynein light chain[J].J Virol,2000,74(21):10212-10216.
[9]Irie T,Licata J M,Mcgettigan J P,et al.Budding of PPx Y-containing rhabdoviruses is not dependent on host proteins TGS101 and VPS4A[J].J Virol,2004,78(6):2657-2665.
[10]Finke S,Conzelmann KK.Dissociation of rabies virus matrix protein functions in regulation of viral RNA synthesis and virus assembly[J].J Virol,2003,77(22):12074-12082.
Genetic analysis on P and M gene of 10 rabies viruses isolated in China
XIE Ting-bo,HUANG Si-jia,MING Ping-gang,WU Jie,XU Ge-lin,YAN Jia-xin
(Center for Rabies Diagnosis,Wuhan Institute of Biological Products,Wuhan 430060,China)
In order to investigate the genetic characteristics of phosphoprotein(P)and matrix protein(M)genes of 10 representative rabies virus(RV)isolated in China,the P and M genes were amplified by RT-PCR,and then sequenced.The nucleotide and amino acid sequences and their functional positions were analysed by bioinformatics software.The phylogenetic trees were constructed based on the P and M genes.The 10 Chinese RV P and M gene nucleotide homology were 85.9%-99.4%and 89.5%-99.5%,and the deduced amino acid identity were 92.3%-100%and 96.0%-99.5%respectively.The ten isolates showed much higher homology with the street strain HN10 and CTN vaccine strain in China than with other vaccine strains and challenge virus standard(CVS)abroad on both nucleotide level and amino acid level.Phylogenetic analysis revealed that these 10 isolates were more closely related to the strain from Hunan Province and vaccine strain CTN than to other strains used in the study.Compared with other genotype 1 rabies viruses,multiple amino acid residues were substituted in P and M gene of the 10 isolates but rarely mutated in the functional regions.These 10 strains of rabies virus isolated in our study belong to genotype 1 and show close relationship to the street strain and vaccine strain CTN in China.
rabies virus;genetic analysis;phosphoprotein gene;matrix protein gene
R373.9
A
1002-2694(2012)03-226-04
*国家高技术研究发展计划 (863计划)项目(2007AA02Z402)资助
严家新,Email:yanjx45@163.com
武汉生物制品研究所狂犬病检测中心,武汉 430060
2011-09-26;
2011-11-15

