生物导向药物研究进展
周天惠,关婉怡,赵宝华
生物导向药物(immunoconjugate)又称生物靶向药物,是有导向功能的载体与具有细胞杀伤能力的物质的结合。这类药物至少包括两个功能区:一个功能区是载体(如单抗、细胞因子等),具有细胞识别功能,能将药物自动导向到靶细胞表面;另一个功能区具有细胞杀伤能力,通过内化作用进入细胞后将其杀死。20 世纪初,Paul Ehrlich 就设想了一种理想生物导弹,但由于当时实验技术的局限性,阻碍了这种理想药物的研制[1]。1975 年,Köhler 和 Milstein[2]发明了杂交瘤技术来制备单克隆抗体(以下简称“单抗”),为生物导向药物提供必要的靶向特异性。直到 20 世纪 80 年代,研究人员成功制备出免疫毒素,兼具细胞杀伤作用和靶向特异性,终于使这种理想导弹变成了现实[3]。与常规药物相比,生物导向药物的靶向性使其具有独特的优点和卓越的效能,但它也面临着很多挑战,如低细胞吸收率、低细胞毒性、脱靶效应、药物存在免疫原性及药物半衰期短等缺陷,这些缺陷限制了其在临床上的应用。经过 30 年,生物导向药物的研究取得了重大进展,有多种生物靶向药物获得美国FDA 批准应用于疾病的治疗。本文将从生物导向药物的载体、药物、制备方法和应用等方面综述其研究进展。
1 生物导向药物中的载体
能携带细胞致死药物并能选择性地将药物导向到靶细胞表面的物质均可作为载体。
1.1 抗体
导向药物中应用最广泛的载体当属抗体。单抗以其生物活性单一、对相应抗原的特异性高、便于人为处理等优点被广泛应用于疾病治疗的多个领域,尤其是对肿瘤的治疗。作为生物导向药物的载体,抗体的选择必须考虑其稳定性,与药物结合后不失去活性和对靶细胞特异结合的能力,并考虑其与抗原特异性的结合途径。为了满足临床需要,且基于基因工程技术的不断成熟,抗体片段、双特异性抗体和纳米抗体应运而生。
1.1.1 抗体片段 通过对抗体基因的改造和修饰可得抗体片段,改变可变区可增加对抗原的亲和力,改变恒定区可减小免疫原性。Fab 片段、单链抗体和人源化抗体都属于抗体片段。在癌症治疗中,抗体片段可在化学或基因水平与抗癌药物融合来获得不同的功能。融合后的抗体比相应的单纯抗体能更好地发挥疗效[4]。
1.1.2 双特异性抗体 随着分子生物学、免疫学、基因工程等学科和技术的不断发展,研究人员研制出一种能识别两种不同抗原的双特异性抗体(bispecific antibody,BsAb),通过抗体片段的多聚化来优化药代动力学参数和亲和力。由于两种抗体可以识别肿瘤细胞表面两种不同抗原,因此可以提高 BsAb 对肿瘤的靶向能力。研究发现,由于正常组织抗原密度低,利用 BsAb 携带药物可使药物更强有力地结合到肿瘤细胞上,从而减少因在正常组织中的渗透而引起的不良反应[5]。
1.1.3 纳米抗体 纳米抗体最初由 Hamers-Casterman 等[6]在 1993 年报道。他们发现骆驼(Camelus dromedarius)血液中存在许多由重链二聚体组成的类 IgG 分子,没有轻链和重链恒定区(CH1),但仍能广泛结合抗原,分子量只有其他抗体的 1/10且长度只有几个纳米,故名纳米抗体。与其他抗体相比,纳米抗体分子小、穿透力强、免疫原性弱,所以在生物导向药物中作为载体,具有很大优势。它能有效穿过血脑屏障,而且具有高度水溶性和构象稳定性,在苛刻的条件下仍能保持抗原结合活性。这些特点为生物导向药物的发展与广泛应用带来了曙光,使纳米抗体在近年成为现代导向药物的研究热点。
1.2 其他载体
载体部分不仅局限于抗体,细胞因子、激素、配体和受体等具有识别和结合功能的分子也可作为导向药物的载体。彭超等[7]以白细胞介素 6(IL6)为载体、绿脓杆菌外毒素(pseudomonas exotoxin,PE)衍生体 PE38 为细胞毒性部分,重组表达毒素基因hIL6(T22)-PE38,所得重组靶向毒素具有明显的选择杀伤作用。刘文胜等[8]以胰岛素为载体与抗肿瘤药物米托蒽醌通过间隔基连接,达到了预期效果。作为配体的转铁蛋白可在癌细胞表面高度表达的转铁蛋白受体介导下内吞进入癌细胞,如将白喉毒素(difteria toxin,DT)与转铁蛋白结合便可特异性地杀伤癌细胞[9]。除了配体,受体也可作为导向药物的载体,如利用 CD4 受体与毒素结合治疗 HIV 感染[10]。
2 生物导向药物中的药物
在临床上,单独使用针对肿瘤细胞表面特异表达的抗原的单抗治疗肿瘤尽管有成功的例子,但却很少有单抗自己的疗效,多数情况下是将单抗治疗与化疗相结合。虽然抗体能用来延长癌症患者的生命,但在许多情况下,需要更有效的药物彻底根除癌症肿块。现在已有多种配体作为“弹头”与载体结合,包括传统的抗癌药物、细胞毒性的天然物质、植物毒素、放射性同位素、生物活性的蛋白质、酶(激活细胞毒性药物的前体药物)和光敏剂。配体药物到达靶细胞后通过内化作用被释放,必须发挥最大药效和显著的细胞毒性,即使在低浓度也应足以杀死肿瘤细胞,所以对配体药物的要求很苛刻。
2.1 毒素
在导向药物中,毒素是应用最早且范围最广的弹头成分。毒素或改造后的毒素基因与抗体可变区或细胞因子等载体基因融合后所制备的物质称为免疫毒素。免疫毒素的毒素一般选用细菌和植物的毒力较强的产物,它们大多属于核糖体失活蛋白(RIPs)。真菌和植物会产生一些有防御功能的分子来对抗病原体(如微生物)和捕食者(如昆虫),这些防御蛋白能抑制 RNA 翻译,可以实现如抗增殖、抗肿瘤、免疫调节、抗病毒、抗真菌和防虫的功能。实验证明,在细胞质中,一分子的毒素足以杀死细胞[11]。采用基因重组技术对其毒素部分进行改造,如以绿脓杆菌外毒素和白喉毒素构建的免疫毒素,取得了一定程度的成功[12-14]。
2.2 抗生素
除多肽类抗生素外,近年来,烯二炔类高效抗肿瘤抗生素的发现使肿瘤导向治疗的研究取得了令人振奋的成果。烯二炔类抗生素由放线菌产生,可裂解 DNA 的活性中心,只需药物与抗体以 1:1 的比例偶联就可以达到治疗效果。例如,单抗 3A5 的 Fab 片段与烯二炔类抗生素力达霉素按 1:1 构建的偶联物有利于增加药物的渗透性,易于进入实体瘤内部发挥作用[15]。
2.3 化疗药物
化疗药物可在肿瘤细胞生长繁殖的不同环节上抑制或杀死肿瘤细胞,常用的化疗药物有氨甲喋呤、柔红霉素、丝裂霉素C、阿霉素及苯丙氨酸氮芥等。何颖等[16]制备了抗表皮生长因子受体单抗与阿霉素的免疫偶联物,研究表明,该偶联物具有选择性杀伤作用,在荷人表皮癌裸鼠内能够抑制肿瘤的生长,对小鼠的副作用小,在肿瘤生物治疗中具有潜在的应用价值。
2.4 其他弹头
还有很多生物活性物质也被当作生物导向药物的弹头,如基因片段、前体药物专一性活化酶、细胞因子、光动力药物和毒性颗粒,都显示了很好的治疗效果。例如,毒性颗粒(如穿孔素和颗粒酶)是人体内的自然免疫活性物质,是细胞毒性细胞两类重要的效应分子[17]。李先茂等[18]成功表达血管内皮生长因子受体结合肽-颗粒酶B融合蛋白,实验表明有明显的抗血管生成作用。
3 生物导向药物制备方法
抗体与药物之间的连接是至关重要的,除了要求传递效率和疗效外,抗体与药物连接后的稳定性也是一个关键因素[19]。到达靶细胞之前分解或衰变会释放毒素,所以在血液中传递时,这个连接必须稳定,以避免高活性抗癌药物伤害健康组织;而内化后,药物必须能以其活性形式释放。理论上,生物导向药物释放与激活自由药物可能发生在胞内或胞外。将治疗剂从导向药物中释放出来的方法有几种,主要机制是所采用的连接方式在特定环境下能够断裂并释放出活性药物,例如利用肿瘤组织中过量表达蛋白质水解酶的特性,使能够被蛋白水解酶特异选择的导向药物水解而释放治疗剂;利用肿瘤、内涵体和溶酶体中存在的酸性环境[20],使对酸敏感的导向药物在肿瘤细胞中分解;利用肿瘤的缺氧环境[21],通过还原反应使高效无毒的前药释放出活性药物[22]。此外,自分解导向药物也被开发出来,它包括药物、连接物和触发器。触发器和连接物相连的地方会特异性地在肿瘤组织中分解,形成一个药物-连接物的产物,随后会降解并自发释放出游离药物[23],因此这种自分解导向药物与正常组织的接触是有限的,更有应用潜能和价值[24]。
在导向药物的制备过程中,接合方法非常重要,它决定了载药量和均匀性,在药代动力学、活性、效能和稳定性上都起着举足轻重的作用。最初的导向药物中,载体与药物通过化学方法连接,在制备过程中需要平衡化学过程中对载体的修饰和载体载药量,以达到所需的浓度与载体修饰之间的平衡。其中一个最重要的双功能试剂是 SPDP[N-succinimidyl 3-(2-pyridyldithio) propionate],能够与蛋白质的氨基(末端和赖氨酸)反应,连接载体与药物。其他交联剂如 SATA[S-(N-succinimidyl) thioacetate]和 SMPT[(N-succinimidyloxy carbonyl)-1-methyl-1-(2-pyridyldithio) toluene]通过插入二硫键形成连接(图 1A、B)。使用 SATA 的主要优点是用温和的试剂(羟胺)代替还原剂 DTT(dithiotreithol),而且不与半胱氨酸发生反应[25]。通过常规化学方法连接载体和毒素所制备的导向药物,虽然耐受性很好,但稳定性和渗透性差,且大多数都是化学异构,尺寸较大,阻碍了其穿透固体肿瘤的能力。此外,一些免疫毒素对正常细胞仍有较弱的结合能力,并产生不良副作用,也称为血管渗漏综合征。为解决这些问题,新一代导向药物以重组蛋白形式产生。较成功的导向药物采用基因工程方法制备,不用或用一个连接肽,将单抗或其片段连到毒素上(图 1C、D),可保留抗体的亲和力和毒素的功能。
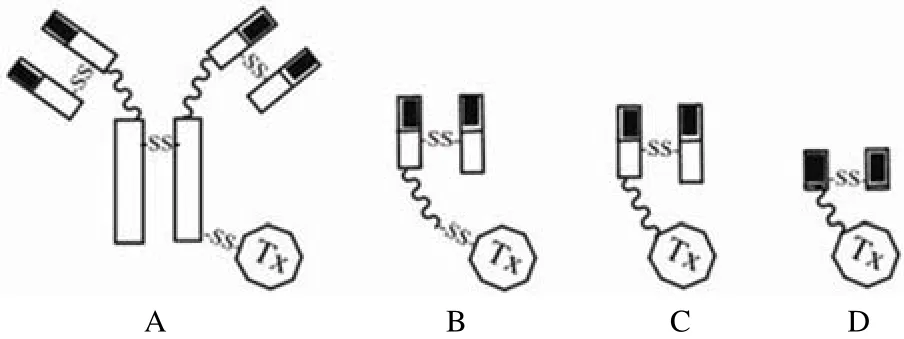
图 1 免疫毒素的构造[26]

表 1 目前处于临床试验阶段的免疫毒素[26]
4 生物导向药物的应用
生物导向药物具有特异性高、性质均一、作用强、持续时间长等优点,被广泛应用于癌症、骨髓移植抗排异、炎症、自身免疫(如类风湿关节炎、过敏反应)等疾病的治疗(表1)。于 2000 年获得美国 FDA 批准的 gem-ozo 是抗 CD33 单抗与烯二炔类抗生素 caliehemicins 构成的偶联物,在临床试验阶段显示了很强的抗急性髓系白血病活性[2]。抗 CD5 和抗 CD7 与蓖麻毒素或蓖麻毒素 A 链连接,已被用于在骨髓移植中消除自体肿瘤细胞和急性移植物抗宿主病[27-28]、非霍奇金淋巴瘤和白血病[27,29];抗死亡受体抗体(AD5-10)与表阿霉素被联合用于治疗类风湿性关节炎[30];英夫利西单抗(IFX)的生物靶向药物已被批准用于溃疡性结肠炎的治疗[31]。如今,纳米技术的成熟拓宽了导向药物的应用范围。如 Grabrucker 等[32]报道了新的生物可降解的纳米粒(nanoparticles,NPs)的发展,NPs 具有生物相容性,能穿过血脑屏障并传递锌原子等物质。通过设计NPs 表面的抗体对抗 NCAM1 和 CD44(分别特异性地靶向神经元和神经胶质细胞),将 NPs 与抗癌药物结合,有望治疗神经疾病和脑肿瘤。
5 展望
生物导向药物的最大好处是可定向治疗,效果显著,在杀伤靶细胞时基本上不损伤正常组织,被认为是未来治疗肿瘤、炎症、自身免疫等疾病的最具前景的治疗方式之一。从毒素和单抗的化学连接开始,已经用不同的方法成功制备了生物导向药物。在过去的 30 年里,免疫毒素的设计不断进步,已开发出更复杂、更有效的产品,很好地解决了药物存在免疫原性、药物半衰期短、渗透性差等问题。全身的脱靶效应一直是普遍存在的问题,需要不断研究来减少这种效应,通过剂量优化,确保药物最有效地作用于靶细胞,同时减少副作用。近期,人们期望减小生物导向药物的大小,以使其免疫原性更低、分配更均匀和渗透力更强,对细胞特异性靶抗原的亲和力更高,更有效地吸收和内化到细胞质中并发挥作用。虽然生物导向药物已被成功改善,但这些新产品的真实效果还需要进一步的临床试验来鉴定。最近,生物导向药物在早期临床试验中显示出巨大潜力,特别是血液系统恶性肿瘤[33-34]的治疗已经有了成熟的单抗技术。随着分子生物学和蛋白质工程的发展,分子生物靶向制剂将会为肿瘤、炎症、自身免疫等疾病带来更有效、更安全、成本更低的治疗方法。
[1] Jukes TH. Searching for magic bullets: early approaches to chemotherapy-antifolates, methotrexate--the Bruce F. Cain memorial award lecture. Cancer Res, 1987, 47(21):5528-5536.
[2] Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, 1975, 256(5517):495-497.
[3] FitzGerald D, Pastan I. Targeted toxin therapy for the treatment of cancer. J Natl Cancer Inst, 1989, 81(19):1455-1463.
[4] Carter P. Improving the efficacy of antibody-based cancer therapies.Nat Rev Cancer, 2001, 1(2):118-129.
[5] Deyev SM, Lebedenko EN. Multivalency: the hallmark of antibodies used for optimization of tumor targeting by design. Bioessays, 2008,30(9):904-918.
[6] Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains. Nature, 1993, 363(6428):446-448.
[7] Peng C, Li YS, He JL, et al. Expression of recombinant target toxin hIL6(T22)-PE38 in E.coli and Cytotoxicity of expressed product. Chin J Biologicals, 2011, 24(1):14-19, 29. (in Chinese)彭超, 李岩松, 何晶龙, 等. 重组靶向毒素hIL6(T22)-PE38在大肠杆菌中的表达及其细胞毒性. 中国生物制品学杂志, 2011, 24(1):14-19, 29.
[8] Liu WS, Zhang ZR, Huang Y. Synthesis of mitoxantrone-insulin conjugates. West China J Pharm Sci, 2004, 19(1):4-6. (in Chinese)刘文胜, 张志荣, 黄园. 米托蒽醌-胰岛素偶联物的制备. 华西药学杂志, 2004, 19(1):4-6.
[9] Dukovski D, Li Z, Kelly DF, et al. Structural and functional studies on the stalk of the transferrin receptor. Biochem Biophys Res Commun,2009, 381(4):712-716.
[10] Till MA, Ghetie V, Greqory T, et al. HIV-infected cells are killed by rCD4-ricin A chain. Science, 1988, 242(4882):1166-1168.
[11] Yamaizumi M, Mekada E, Uchida T, et al. One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell. Cell, 1978,15(1):245-250.
[12] Kreitman RJ. Chimeric fusion proteins-Pseudomonas exotoxin-based.Curr Opin Investig Drugs, 2001, 2(9):1282-1293.
[13] Kreitman RJ, Wilson WH, White JD, et al. Phase I trial of recombinant immunotoxin anti-Tac(Fv)-PE38 (LMB-2) in patients with hematologic malignancies. J Clin Oncol, 2000, 18(8):1622-1636.
[14] Pastan I, Hassan R, FitzGerald DJ, et al. Immunotoxin treatment of cancer. Annu Rev Med, 2007, 58:221-237.
[15] Liu XY, Zhen YS. Antitumor effect of lidamycin-containing monoclonal antibody immunoconjugate with downsized-molecule.Acta Acad Med Sinicae, 2001, 23(6):563-567. (in Chinese)刘小云, 甄永苏. 力达霉素构建的小型化单克隆抗体免疫偶联物的抗肿瘤作用. 中国医学科学院学报, 2001, 23(6):563-567.
[16] He Y, Zhang SQ, Zhao F, et al. Preparation of anti-EGFR monoclonal antibody immunoconjugate (EQ75-ADR) and it’s inhibitory effect on human epidermoid carcinoma. Chin J Cancer Biother, 2000, 7(2):135-138. (in Chinese)何颖, 张尚权, 赵峰, 等. 表皮生长因子受体单抗导向药物(EQ75-ADR)的制备及对人表皮癌抑瘤作用的研究. 中国肿瘤生物治疗杂志, 2000, 7(2):135-138.
[17] Dong HM, Xu XH, Yu XJ. Perforin and granzyme—the perfect material of biologic missile. J Biomed Eng, 2005, 22(5):1075-1077.(in Chinese)董红梅, 徐小虎, 于晓军. 穿孔素和颗粒酶—生物导弹的理想材料.生物医学工程学杂志, 2005, 22(5):1075-1077.
[18] Li XM, Zeng WS, Zhang YL, et al. Inhibitation of vascular endothelia growth factor receptor binding domain-GraB to KDR/flt-1 prositive endothelial proliferation in vitro and angiogenesis in vivo. J Fourth Mil Med Univ, 2002, 23(21):1929-1932. (in Chinese)李先茂, 曾位森, 张亚历, 等. 血管内皮生长因子受体结合肽介导颗粒酶B靶向性抗肿瘤血管生成. 第四军医大学学报, 2002, 23(21):1929-1932.
[19] Ducry L, Stump B. Antibody-drug conjugates: linking cytotoxic payloads to monoclonal antibodies. Bioconjug Chem, 2010, 21(1):5-13.
[20] Ulbrich K, Subr V. Polymeric anticancer drugs with pH-controlled activation. Adv Drug Deliv Rev, 2004, 56(7):1023-1050.
[21] de Groot FM, Damen EW, Scheeren HW. Anticancer prodrugs for application in monotherapy: targeting hypoxia, tumor-associated enzymes, and receptors. Curr Med Chem, 2001, 8(9):1093-1122.
[22] Singh Y, Palombo M, Sinko PJ. Recent trends in targeted anticancer prodrug and conjugate design. Curr Med Chem, 2008, 15(18):1802-1826.
[23] Damen EW, Nevalainen TJ, van den Bergh TJ, et al. Synthesis of novel paclitaxel prodrugs designed for bioreductive activation in hypoxic tumour tissue. Bioorg Med Chem, 2002, 10(1):71-77.
[24] Duncan R. Polymer conjugates as anticancer nanomedicines. Nat Rev Cancer, 2006, 6(9):688-701.
[25] Ghetie V, Vitetta ES. Chemical construction of immunotoxins. Mol Biotechnol, 2001, 18(3):251-268.
[26] Dosio F, Brusa P, Cattel L. Immunotoxins and anticancer drug conjugate assemblies: the role of the linkage between components.Toxins (Basel), 2011, 3(7):848-883.
[27] van Oosterhout YV, van Emst L, Schattenberg AV, et al. A combination of anti-CD3 and anti-CD7 ricin A-immunotoxins for the in vivo treatment of acute graft versus host disease. Blood, 2000,95(12):3693-3701.
[28] Martin PJ, Pei J, Gooley T, et al. Evaluation of a CD25-specific immunotoxin for prevention of graft-versus-host disease after unrelated marrow transplantation. Biol Blood Marrow Transplant,2004, 10(8):552-560.
[29] Schnell R, Borchmann P, Staak JO, et al. Clinical evaluation of ricin A-chain immunotoxins in patients with Hodgkin’s lymphoma. Ann Oncol, 2003, 14(5):729-736.
[30] Zhou JS, Shi J, Zhu HQ, et al. Combination of AD5-10 and epirubicin in treating rhumatoid arthritis. Acta Acad Med Sinicae, 2011, 33(4):367-370. (in Chinese)周剑锁, 史娟, 朱浩卿, 等. AD5-10与表阿霉素联合作用治疗类风湿性关节炎. 中国医学科学院学报, 2011, 33(4):367-370.
[31] Clark M, Colombel JF, Feagan BC, et al. American gastroenterological association consensus development conference on the use of biologics in the treatment of inflammatory bowel disease, June 21-23, 2006.Gastroenterology, 2007, 133(1):312-339.
[32] Grabrucker AM, Gamer CC, Boeckers TM, et al. Development of novel Zn2+ loaded nanoparticles designed for cell-type targeted drug release in CNS neurons: in vitro evidences. PLoS One, 2011, 6(3):e17851.
[33] Wong BY, Dang NH. Inotuzumab ozogamicin as novel therapy in lymphomas. Expert Opin Biol Ther, 2010, 10(8):1251-1258.
[34] Polson AG, Ho WY, Ramakrishnan V. Investigational antibody-drug conjugates for hematological maligncies. Expert Opin Investig Drugs,2011, 20(1):75-85.

