1株枯草芽胞杆菌的鉴定及其弹性蛋白酶结构研究
王超,陈启和,倪辉,3,4*,李利君,3,4,蔡慧农,3,4,苏文金,3,4
(1.集美大学生物工程学院,福建厦门361021;2.浙江大学食品科学与营养系,浙江杭州310058;3.福建省高校食品微生物与酶工程技术研究中心,福建厦门361021;4.厦门市食品与生物工程技术研究中心,福建厦门361021)
弹性蛋白酶是一种特异性水解弹性蛋白的蛋白水解酶[1],在食品、化妆品和医药工业中有广泛的应用。弹性蛋白酶常用作为一种肉类嫩化剂[2-3],生产可溶性的弹性蛋白多肽[4],而且它可以有效地治疗高血脂症和动脉硬化症[5]。胰脏是弹性蛋白酶的主要来源[6],但是对于微生物来源的弹性蛋白酶的研究越来越受到科学家的青睐[7]。一些科学家已经从一些微生物中如:Pseudomonas aeruginosa[8-9]、Micrococcus luteus[10]和Vibrio cholerae[11]中分离得到弹性蛋白酶。此外,刘书亮等[12]在2011年从枯草芽胞杆菌中分离纯化得到弹性蛋白酶,并对其酶学性质进行了相关研究。刘双发等[13]在2009年从秸秆中分离得到1株产弹性蛋白酶的高产菌,并将其鉴定为短小芽胞杆菌。Chen等[14]在2002年分离得到了产弹性蛋白酶的芽胞杆菌,并对其发酵条件进行了初步研究。目前,微生物弹性蛋白酶的研究存在2个主要问题:①分离得到的弹性蛋白酶产生菌株大部分都具有致病性,制约着其在商业上的应用;②微生物弹性蛋白酶的结构尚不明确,限制了地衣芽胞杆菌及枯草芽胞蛋白酶的发酵生产及应用。在之前的研究中,分离得到了产弹性蛋白酶的菌株EL32,通过优化发酵条件提高了其弹性蛋白酶产量。本论文对该菌株进行鉴定,并研究其弹性蛋白酶的基本结构,为后续研究提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株从屠宰厂处的土壤中分离得到的分泌弹性蛋白酶的菌株,编号为EL32。
1.1.2 主要试剂细菌基因组DNA提取试剂盒,购自TIANGEN公司;DNA凝胶回收试剂盒DW02-2、dNTPs、Taq酶、10×PCR Buffer均购自广州东盛生物科技有限公司;Congo-red elastin购自Sigma公司;引物合成及测序由上海华大基因生物科技有限公司完成。其他实验试剂均购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 菌株EL32鉴定①菌株EL32产弹性蛋白酶活性的鉴定:取斜面保存的菌种稀释涂布于平板培养基(质量体积比,酵母膏0.5%,蛋白胨1%,NaCl 1%,琼脂2%)上,形成单菌落后,点种于刚果红弹性蛋白培养基(质量体积比,酵母膏0.5%,蛋白胨1%,NaCl 1%,琼脂2%,刚果红弹性蛋白0.2%)上进行鉴定,通过观察水解刚果红弹性蛋白的水解圈来判断该菌株是否分泌弹性蛋白酶;②菌株EL32的16S rDNA的扩增与序列分析:将菌种接种于培养基(酵母膏5 g/L,蛋白胨1 g/L,NaCl 10 g/L),37℃、180 r/min培养12 h,采用细菌基因组DNA提取试剂盒(DONGSHENG公司)提取菌株总DNA,扩增其16S rDNA。上游引物序列(16S-F):5'-AGAGTTTGATCCTGGCTCTG-3',下游引物序列(16S-R):5'-ACGGCTACCTTGTTACGACT-3'。PCR反应体系(20 μL):10×Buffer 2.0 μL,25 μmol/L的MgCl20.8 μL,2.5 mmol/L dNTPs 0.4 μL,16S-F 25 μmol/L 0.4 μL,16S-R 25 μmol/L 0.4 μL,DNA模板0.5 μL,5 U/L的Taq DNA聚合酶1.0 μL,超纯水14.5 μL。PCR扩增程序:95℃预变性5 min;95℃变性1 min,53℃退火1 min,72℃延伸1.5 min,循环30次;72℃温浴10 min。PCR产物连接到pMD-18T载体进行克隆,送上海华大基因科技有限公司进行序列测定。测序结果通过Blast软件在NCBI基因数据库中进行比对,构建系统发育树;③菌株EL32的形态观察:在LB培养基中采用平板划线法观察菌株菌落形态,革兰染色法观察菌体形态,孔雀石绿染色法观察有无芽胞着生。根据观察结果参考《伯杰细菌鉴定手册》(第8版)[15]对该菌株进行分类鉴定;④菌株EL32的生理生化特征分析:参照《微生物实验》(第4版)[16],进行糖酵解试验、明胶液化、淀粉水解、生长温度试验、V-P试验及厌氧生长试验。根据试验结果参考《伯杰细菌鉴定手册》(第8版)[15]对该菌株进行分类鉴定。
1.2.2 菌株EL32弹性蛋白酶的分离纯化①粗酶液的制备:将菌株EL32的发酵液在4℃,10 000 r/min冷冻离心15 min,除去菌体以及其他不溶物沉淀,取上清液;②硫酸铵沉淀:在粗酶液中加入硫酸铵至饱和度为20%,10 000 r/min冷冻离心15 min,弃沉淀取上清,再加入硫酸铵至饱和度为60%,离心,取沉淀;用pH 7.4 50 mmol/L硼酸盐缓冲液溶解,透析脱盐;③离子交换层析:将透析后的样品上样于事先用50 mmol/L pH 7.4的硼酸缓冲液平衡的DEAE-Sepharose Fast Flow层析柱(2.5 cm×19 cm)上,用3倍柱体积缓冲液流洗去除未吸附的蛋白后,再用含0~1.0 mol/L NaCl梯度的相同缓冲液进行线性洗脱,洗脱总体积为75 mL,流速为1 mL/min,以3 mL/管收集。测定收集液的酶活力及蛋白浓度[17],合并有弹性蛋白酶活性的流洗液,用10 ku超滤膜截留进行超滤浓缩,凝胶过滤层析备用;④凝胶过滤层析:将浓缩后的样品(上样体积0.5 mL)上样于事先用含有0.15 mol/L NaCl的50 mmol/L pH 7.4的硼酸缓冲液平衡凝胶过滤层析柱Sephacryl S-100 HR(1.6 cm×60 cm),然后以相同的缓冲液以0.5 mL/min的流速洗脱,每管收集2 mL,分别测定每管的酶活力及蛋白浓度[17],合并弹性蛋白酶活性较高的部分洗脱液透析后备用;⑤弹性蛋白酶的SDS-PAGE电泳分析:用10%的SDS聚丙烯酰胺凝胶电泳对纯化后的弹性蛋白酶样品的分子量和纯度进行测定,并用标准蛋白质(116.0~14.0 ku)做对照,考马斯亮蓝R250染色;⑥弹性蛋白酶活力的测定:采用Sachar[14,18]的方法,称取2 mg刚果红弹性蛋白(congo-red elastin)溶于1 mL蒸馏水中,加入1 mL 0.2 mol/L硼酸缓冲液(pH 7.4)、1 mL适度稀释的酶液,37℃振荡反应20 min,加入2 mL 0.7 mol/L磷酸缓冲液(pH 6.0)终止反应,立即离心,取上清液在495 nm测定。空白为不含酶液的反应体系。在此条件下溶解1 mg刚果红弹性蛋白底物所需要的酶量定义为1个弹性蛋白酶活性单位(U)。标准曲线参照Sachar方法制作;⑦蛋白含量测定[19]:以牛血清蛋白为标准蛋白质。实验设3个重复,实验结果取平均值。
1.2.3 菌株EL32弹性蛋白酶的肽指纹图谱分析
将纯化后的弹性蛋白酶液进行SDS-PAGE电泳试验,在凝胶上找到目的蛋白质,用干净的手术刀沿条带的边缘小心切下凝胶,将切下的蛋白质胶条置于1.5 mL的试管中,加入适量的胰蛋白酶进行酶解,然后进行质谱(LTQ-MS)分析。将得到的肽指纹图谱采用Mascot搜索程序,在Swissport数据库中进行搜索、鉴定,搜索设定的参数在表1中列出。

表1 数据搜索参数Table 1 Parameters used for database search
1.2.4 菌株EL32弹性蛋白酶的结构分析①菌株EL32弹性蛋白酶的基因序列分析根据肽指纹图谱的分析结果,以枯草芽胞杆菌蛋白酶[17](subtilisin amylosacchariticus precursor,登录号:D00264.1)的DNA序列为模板设计弹性蛋白酶的基因序列的引物:YBQHF(5'ATGAGA AGCAAAAAATTGTGGATC3')和YBQHR(5'TTATTGTGCAGCTGC TTGTACG3')。PCR反应体系(50 μL):10×Buffer 5.0 μL,2.5 mmol/L dNTPs 1.0 μL,YBQHF 50 μmol/L 1.0 μL,YBQHR 50 μmol/L 0.4 μL,DNA模板1.25 μL,5 U/L的Taq DNA聚合酶0.5 μL,超纯水40.25 μL。PCR扩增程序:94℃预变性5 min;94℃变性1 min,53℃退火1 min,72℃延伸1 min,循环30次;72℃温浴10 min。PCR产物连接到pMD 18-T载体进行克隆,送上海华大基因科技有限公司进行序列测定。测序结果通过Blast软件在NCBI基因数据库中进行比对;②菌株EL32弹性蛋白酶的空间结构分析将推导的的弹性蛋白酶氨基酸序列(AFC89901.1)上传到CPHmodels 3.0服务器的网站(http://www.cbs.dtu.dk/services/CPHmo dels)上,通过在线软件分析得到模拟的弹性蛋白酶的三维结构相关信息,使用PyMOL软件进行分析。
2 结果与分析
2.1 菌株EL32弹性蛋白酶的鉴定
在含有弹性蛋白酶的特异性底物刚果红弹性蛋白的平板培养基中培养菌株EL32,图1所示的结果显示在EL32的周围产生了明显的水解圈,说明该菌株分泌产生了弹性蛋白酶。
2.2 菌株EL32的鉴定
以提取分泌弹性蛋白酶菌株的DNA为模板、16S-F和16S-R为引物,扩增该菌株16S rDNA序列,扩增产物条带单一、明亮,大小约为1 500 bp。测序分析结果表明,菌株EL32与Bacillus属成员具有较高的序列相似性,用Neighbor-Joining方法构建系统发育树,表明与Bacillus subtilis(HQ851067)亲缘关系最近,相似性达到了99%(图2)。
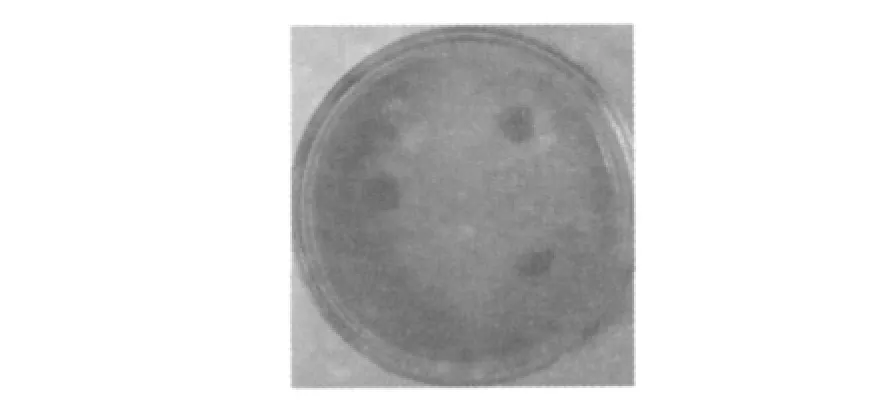
图1 Bacillus subtilis EL32在0.2%刚果红弹性蛋白平板上培养48 h产生的水解圈Fig.1 Elastolytic activity of Bacillus subtilis.EL32 strain on 0.2%elastin congored agar plates after 48 h incubation
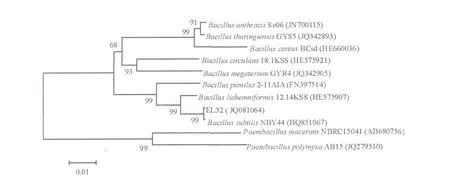
图2 菌株EL32的16S rDNA序列系统发育分析Fig.2 Phylogenetic tree derived from 16S rDNA sequences of strain EL32
在培养基(质量体积比,酵母膏0.5%,蛋白胨1%,NaCl 1%,琼脂2%)中37℃培养48 h后,其菌落及细胞形态如表2所示,菌株EL32菌落形态为圆形、乳白色、边缘不整齐;其细胞革兰染色呈阳性、具有芽胞,与《伯杰细菌鉴定手册》的枯草芽胞杆菌相同。如表3所示,菌株EL32发酵葡萄糖产酸不产气,明胶水解试验和淀粉水解试验呈阳性,在5℃不能生长,在10℃时可以生长,厌氧生长试验呈阴性,V-P反应呈阳性,同《伯杰细菌鉴定手册》中Bacillus subtilis标准菌株相一致。这些结果表明,EL32是1株枯草芽胞杆菌。

表2 菌株EL32的菌落及个体形态特征Table 2 Characteristics of the clone and cell of strain EL32

表3 菌株EL32生理生化特性Table 3 Physiological and biochemical characteristics of strain EL32
2.3 菌株EL32弹性蛋白酶的纯化及一级结构
经过硫酸盐沉淀、DEAE-Sepharose Fast Fow阴离子交换层析及Sephacyl S-100HR分子筛层析,酶比活达到288.8 U/mg,纯化了19.7倍,回收率为13.2%,SDS-PAGE电泳分析表明该蛋白达到了电泳纯(图3)。从胶条上切下目的条带,用胰蛋白酶进行胶内酶切,水解后的肽段混合物用LTQ-MS测定肽指纹图谱,在www.matrixscience.com网站上利用MASCOT软件检索Swissprot蛋白质数据库进行鉴定。根据Mascot的评分标准判断(P<0.05),评分大于75分认为有统计学意义,满足这一条件的蛋白用MASCOT软件检索得到16种蛋白,其中排在首位的蛋白酶subtilisin[18](Bacillus subtilis subsp.amylosacchariticus,D00264.1)得分197,吻合肽段数为4条(表4),其他在数据库中检索出的蛋白质的得分值和吻合肽段数都低于蛋白酶subtilisin的检索结果。以枯草芽胞杆菌蛋白酶subtilisin[18](登录号:D00264.1)的DNA序列为模板设计引物,以枯草芽胞杆菌EL32的DNA序列为模板,克隆得到菌株EL32的前弹性蛋白酶原基因,其长度为1 152 bp核苷酸,能编码381个氨基酸,它包含29个氨基酸组成的信号肽,77个氨基酸组成的前体肽和275个氨基酸组成的成熟弹性蛋白酶(图4)。一般来说,1个氨基酸的平均分子量为128,由此计算得到成熟弹性蛋白酶分子量的大小约为30 268 ku,这与SDS-PAGE图所估计的分子量约为31 ku是一致的。测序后将其序列登录GenBank(登录号为JQ305692),进行同源性分析发现菌株EL32成熟弹性蛋白酶的氨基酸序列与枯草芽胞杆菌的蛋白酶subtilisin的氨基酸序列同源性达到99%,与嗜中性芽胞杆菌弹性蛋白酶[20](alkaline elastase YaB,P20724.1)的氨基酸序列的同源性为49%(图4)。由此,可以确定该弹性蛋白酶为枯草芽胞杆菌的蛋白酶Subtilisin。

图3 纯化得到的弹性蛋白酶的SDS-PAGEFig.3 SDS-PAGE of the purified elastase
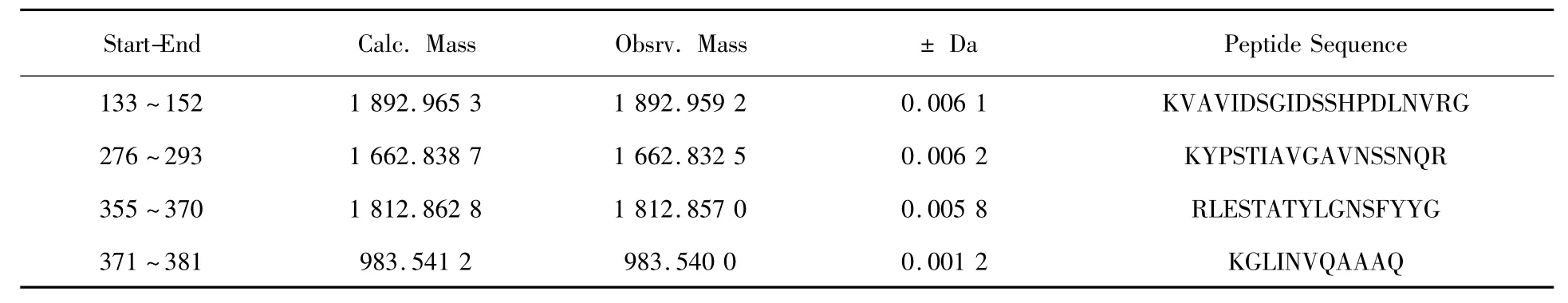
表4 Swissport数据库中有效的匹配肽段Table 4 Effective peptides from MS compared with data in the Swissport
2.4 菌株EL32弹性蛋白酶的空间结构
将菌株EL32的弹性蛋白酶氨基酸序列(AFC89901.1)提交至CPHmodels 3.0服务器的网站(http://www.cbs.dtu.dk/services/CPH-models/)上,进行自动建模,得到pdb格式的枯草芽胞杆菌EL32弹性蛋白酶的三维结构信息;应用PyMOL软件对获得三维结构信息进行分析,得到菌株EL32的弹性蛋白酶三维结构图(图5B),其含有6个α-螺旋、7个扭曲的平行β-折叠以及2个反平行的β-折叠,与Bacillus amyloliquefaciens的蛋白酶subtilisin的三维结构高度相似(图5)。
Kaneko等[20]研究表明碱性弹性蛋白酶YaB(P20724.1)也属于蛋白酶subtilisin。为了对比菌株EL32弹性蛋白酶与碱性弹性蛋白酶YaB的空间结构,降碱性蛋白酶YaB的氨基酸序列(alkaline elastase YaB,P20724.1)提交至CPHmodels 3.0服务器的网站(http://www.cbs.dtu.dk/services/CPHmodels/)上进行自动建模,并用pyMOL软件对获得三维结构信息进行分析发现如图6所示,碱性蛋白酶YaB的空间结构(图6B)与菌株EL32弹性蛋白酶三维结构(图6A)也高度相似,都含有6个α-螺旋,7个扭曲的平行β-折叠以及2个反平行的β-折叠。


图6 菌株EL32的弹性蛋白酶(A)嗜中性芽胞杆菌的碱性弹性蛋白酶(B)的三维结构模拟图Fig.6 The simulative three demensional structure of elastase from Bacillus subtilis EL32(A)and an alkalophilic Bacillus strain(B)
3 讨论
产弹性蛋白酶的菌株EL32经鉴定为枯草芽胞杆菌。与其他菌株相比,枯草芽胞杆菌是工业酶制剂的常用生产菌株,生物安全性较高,因此,是潜在的弹性蛋白酶生产菌株。
马长中等[21]在2011年从西藏林芝中分离出产弹性蛋白酶的枯草芽胞杆菌。王金英等[22]在2001年从稻草中筛选出产弹性蛋白酶的枯草芽胞杆菌。Nakamura等[23]报道了枯草芽胞杆菌分泌的纳豆激酶(也属于蛋白酶)。Agrebi等[24]2009年克隆得到枯草芽胞杆菌分泌的一种水解纤维蛋白的蛋白酶基因。Jang等[25]克隆得到嗜热脂肪芽胞杆菌分泌的一种蛋白酶subtilisin基因。国外学者主要克隆了绿脓杆菌(Pseudomonas aeruginosa)产生的弹性蛋白酶的基因[8-9,26]。但枯草芽胞杆菌弹性蛋白酶的结构尚不明确。本文鉴定了菌株EL32弹性蛋白酶为蛋白酶subtilisin,确定了枯草芽胞杆菌弹性蛋白酶的本质。
Wong等[27]和Yoshimoto等[19]研究发现蛋白酶subtilisin的氨基酸序列有1条108个氨基酸组成的前体肽,包含29个氨基酸组成的信号肽和77个氨基酸组成的前肽,其切割位点的氨基酸序列为Ala-Gln-Ala*Ala-Gly(图4),序列中的星号是切割位点;Kaneko等[20]也在芽胞杆菌中分泌的碱性弹性蛋白酶氨基酸序列中发现类似的含切割位点的氨基酸序列Ala-Gln-Ala*Ala-Glu。
相关研究表明,Ser和His是芽胞杆菌的碱性弹性蛋白酶活性中心的催化基团[20];且碱性弹性蛋白酶没有蛋白酶subtilisin BPN'底物结合部位的氨基酸Ser-161-Ser-162-Ser-163-Thr-164,这4个氨基酸的缺失改变了底物结合部位的构象,使该碱性弹性蛋白酶优先水解Ala,而蛋白酶subtilisin BPN'优先水解Tyr。Estell等[28]报道Gly-166位于蛋白酶subtilisin底物结合部位的底部,在酶催化过程中起重要作用。Carter等[29]报道蛋白酶subtilisin BPN'的催化活性中心由Asp-32、His-64和Ser-221组成;Kaneko[19]报道蛋白酶subtilisin和芽胞杆菌碱性弹性蛋白酶,它们的催化中心及邻近催化活性中心的氨基酸序列具有高度的保守性。图5和图6表明,菌株EL32弹性蛋白酶的催化中心也含有Asp-32、His-64、Ser-221等基团,因此,可以确定Asp-32、His-64、Ser-221等也是菌株EL32弹性蛋白酶的活性中心基团。
本论文对前期筛选获得的1株产弹性蛋白酶菌株进行了鉴定,并对其弹性蛋白酶的结构进行了研究,为该弹性蛋白酶的深入研究及开发其在食品加工领域中的应用提供基础。
[1] Morihara K,Tsuzuki H.Elastolytic properties of various proteinases from microbial origin[J].Archives of biochemistry and biophysics,1967,120(1):68-78.
[2] Takgi H,Kondou M,Hisatsuka T,et al.Effects of an alkaline elastase from an alkalophilic Bacillus strain on the tenderization of beef meat[J].Journal of Agricultural and Food Chemistry,1992,40(12):2364-2368.
[3] Considine T,Healy A,Kelly A,et al.Proteolytic specificity of elastase on bovine[beta]-casein[J].Food Chemistry,1999,66(4):463-470.
[4] Xu Y,He GQ,Li J.Effective extraction of elastase from Bacillus sp.fermentation broth using aqueous two-phase system[J].Journal of Zhejiang University Science B,2005,6(11):1087-1094.
[5] Robert L,Robert A,Jacotot B.Elastin-elastase-atherosclerosis revisited[J].Atherosclerosis,1998,140(2):281-295.
[6] Erlendsson LS,Filippusson H.Purification and characterization of ovine pancreatic elastase[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,120(3):549-557.
[7] Chen QH,He GQ,Jiao YC,et al.Effects of elastase from a Bacillus strain on the tenderization of beef meat[J].Food Chemistry,2006,98(4):624-629.
[8] Jellouli K,Bayoudh A,Manni L,et al.Purification,biochemical and molecular characterization of a metalloprotease from Pseudomonas aeruginosa MN7 grown on shrimp wastes[J].Applied microbiology and biotechnology,2008,79(6):989-999.
[9] Pandeeti E V P,Pitchika GK,JOTSHI J,et al.Enzymatic Depilation of Animal Hide:Identification of Elastase(LasB)from Pseudomonas aeruginosa MCM B-327 as a Depilating Protease[J].PloS one,2011,6(2):e16742.
[10] Clark DJ,Hawrylik SJ,Kavanagh E,et al.Purification and characterization of a unique alkaline elastase from Micrococcus luteus[J].Protein Expression and purification,2000,18(1):46-55.
[11] Janda JM,Abbott SL,Khashe S.Identification and initial characterization of elastase activity associated with Vibrio cholerae[J].Current microbiology,1999,39(2):73-78.
[12] 刘书亮,吴琦,詹莉,等.枯草芽胞杆菌弹性蛋白酶的纯化及酶学性质研究[J].食品与发酵工业,2010,6:26-30.
[13] 刘双发,安德荣,苟丽霞,等.新的产弹性蛋白酶菌株的筛选与鉴定[J].微生物学通报,2009,36(9):1345-1349.
[14] Chen QH,He GQ,Ali MAM.Optimization of medium composition for the production of elastase by Bacillus sp.EL31410 with response surface methodology[J].Enzyme and Microbial Technology,2002,30(5):667-672.
[15] Buchanan R,Gibbonsbian N.伯杰氏鉴定细菌学手册(第8版)[M].北京:科学出版社,1974.
[16] 沈萍,陈向东.微生物学实验(第4版)[M].北京:科学出版社,2008.
[17] Sachar LA,Winter KK,Sicher N,et al.Photometric method for estimation of elastase activity[J].Experimental Biology and Medicine,1955,90(2):32.
[18] Yoshimoto T,Oyama H,Honda T,et al.Cloning and expression of subtilisin amylosacchariticus gene[J].Journal of biochemistry,1988,103(6):1060-1065.
[19] Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical biochemistry,1976,72(1):248-254.
[20] Kaneko R,Koyama N,Tsai YC,et al.Molecular cloning of the structural gene for alkaline elastase YaB,a new subtilisin produced by an alkalophilic Bacillus strain[J].Journal of bacteriology,1989,171(9):5232-5236.
[21] 马长中,辜雪冬,罗章,等.西藏产弹性蛋白酶的枯草芽胞杆菌分离及鉴定[J].安徽农业科学,2011,39(24):14528-14530.
[22] 王金英,刘宇峰.枯草杆菌弹性蛋白酶高产菌株的筛选与鉴定[J].生物技术,2001,11(2):30-32.
[23] Nakamura T,Yamagata Y,Ichishima E.Nucleotide sequence of the subtilisin NAT gene,aprN,of Bacillus subtilis(natto)[J].Bioscience,biotechnology,and biochemistry,1992,56(11):1869.
[24] Agrebi R,Haddar A,Hmidet N,et al.BSF1 fibrinolytic enzyme from a marine bacterium Bacillus subtilis A26:Purification,biochemical and molecular characterization[J].Process Biochemistry,2009,44(11):1252-1259.
[25] Jang JS,Kang DO,Chun MJ,et al.Molecular cloning of a subtilisin J gene from Bacillus stearothermophilus and its expression in Bacillus subtilis[J].Biochemical and biophysical research communications,1992,184(1):277-282.
[26] Lin X,Xu W,Huang K,et al.Cloning,expression and characterization of recombinant elastase from Pseudomonas aeruginosa in Picha pastoris[J].Protein Expression and purification,2009,63(2):69-74.
[27] Wong SL,Doi R.Determination of the signal peptidase cleavage site in the preprosubtilisin of Bacillus subtilis[J].Journal of Biological Chemistry,1986,261(22):10176-10181.
[28] Estell D,Graycar T,Miller J,et al.Probing steric and hydrophobic effects on enzyme-substrate interactions by protein engineering[J].Science,1986,233(4764):659-663.
[29] Carter P,Wells JA.Dissecting the catalytic triad of a serine protease[J].Nature,1988,332(6164):564-568.

