新型4-噻唑烷酮衍生物及其抗病毒活性研究进展
张强强, 刘新泳
(山东大学药学院药物化学教研室,山东济南250012)
在过去的几十年间,含有两个杂原子的4-噻唑烷酮逐渐引起了药学研究者们的关注,大量的研究发现,它是一个非常重要的生物活性结构,其C-2、N-3和C-5位可被各种取代基取代,形成具有抗病毒、抗菌、抗结核、抗炎、抗癌、抗惊厥、抗组胺、催眠、驱虫、卵泡刺激素受体激动剂等多重活性以及心脑血管作用的衍生物(1)[1]。其中,4-噻唑烷酮衍生物的抗病毒活性研究取得了长足进展,推动了新型抗病毒药物的开发。

1 2,3-二取代的4-噻唑烷酮衍生物
1.1 抗人类免疫缺陷病毒活性
在过去的30年里,全球约有3 300万人受到了人类免疫缺陷病毒(HIV)感染,并有2 500万人因罹患艾滋病而死亡[2]。因此,开发高效、安全的抗HIV药物一直是药学研究者追求的目标。
近年来,有诸多文献报道,由噻唑并[3,4-a]苯并咪唑(TBZ)类化合物[如TBZ1(2)和TBZ2(3)]衍生的2,3-二芳基取代的4-噻唑烷酮衍生物具有高抗HIV-1活性,且细胞毒性低。这类4-噻唑烷酮衍生物基本上均属于非核苷逆转录酶抑制剂,即通过抑制HIV-1的逆转录过程而抑制病毒的复制。
Rawal等[3]合成了一系列C-2位被2,6-二卤代苯基和N-3位被嘧啶基取代的4-噻唑烷酮衍生物,并对其抗HIV-1活性进行了评价。结果发现,其中化合物4和5能有效抑制HIV-1的复制,EC50达22~28 nmol·L-1,选择性指数[SI,即半数细胞毒性浓度(CC50)与EC50或IC50的比值]大于10 000;其在MT-4细胞系中的抗HIV-1活性比TBZ1高10倍,而在 CEM细胞系中的抗 HIV-1活性比TBZ1高500倍。此外,Rao等[4]也合成了一系列此类化合物,体外实验发现,其中化合物6在MT-4细胞系中的抗 HIV-1活性比 TBZ1高近20倍,EC50达0.017μmol·L-1,SI为9 521,但由于其靶标是HIV-1逆转录酶,所以它对逆转录酶K103N/ Y181C突变株的抑制活性降低。
Rao等[5]还合成了一系列在C-2和N-3位用苯基取代的4-噻唑烷酮衍生物,体外实验发现,其中某些化合物对MT-4细胞中HIV-1的复制有很好的抑制活性,尤以化合物7~10的活性最好,EC50分别为0.080、0.086、0.128和0.156μmol·L-1。

Barreca等[6-8]以TBZ类化合物为先导物,设计并合成了一系列2,3-二芳基取代的4-噻唑烷酮化合物。体外实验发现,这些化合物能有效抑制HIV-1的复制,其中化合物11~14对MT-4细胞中HIV-1复制的抑制活性最好,EC50分别为0.030、0.044、0.053和0.082μmol·L-1,SI分别为1 066、6 470、601和1 536,均显著优于TBZ类化合物(EC50=0.352μmol·L-1,SI=54.5)。
Rao等[9]也合成了若干新型2,3-二芳基取代的4-噻唑烷酮衍生物,体外实验表明,这些化合物在30~50 nmol·L-1的浓度下可有效抑制HIV-1复制,且细胞毒性低,尤以化合物15~18的活性最好,IC50分别为0.050、0.030、0.034和0.045μmol·L-1。
Murugesan等[10]对4-噻唑烷酮的 C-2和 N-3位取代基进行优化,合成了17个化合物。抗HIV活性实验显示,其中化合物19~22对HIV逆转录酶的抑制活性最好,在TZM-bl细胞系中对HIV-1 IIIB病毒株的EC50为0.09~0.80 mg·L-1。构效关系研究发现,在4-噻唑烷酮N-3位的芳杂环上引入大的亲脂性基团和把C-2位上苯环的C-4' (苯环对位的C原子)换成生物电子等排的三价N或二价基团,有利于增强这类化合物的抗HIV活性。

鉴于含有异硫脲或硫脲官能团的化合物有很好的抗HIV-1活性,Rawal等[11]基于先导化合物23合成了一系列2-芳基-3-芳杂环取代的4-噻唑烷酮衍生物,体外活性测试发现,其中化合物24对 MT-4细胞中HIV-1复制有显著的抑制活性,EC50为0.26μmol·L-1,活性高于阳性对照药TBZ类化合物(EC50=0.35μmol·L-1)。

Balzarini等[12-13]报道了一系列C-2或N-3位被金刚烷取代的4-噻唑烷酮衍生物,其中化合物25为外消旋体,抑制HIV-1复制的EC50为0.35μmol·L-1,SI为 120,但其(-)-异构体活性较低,EC50为12μmol·L-1,SI为3.8,而(+)-异构体活性较高,EC50为0.178μmol·L-1,SI为198;另一化合物26抑制 CEM细胞系中 HIV-1复制的 EC50为0.67 μmol·L-1;而化合物27~29的抗HIV活性(EC50= 1.0~2.0μmol·L-1)则均明显低于阳性对照药奈韦拉平(EC50=0.12μmol·L-1),且细胞毒性较大。
Ravichandran等[14]通过CoMFA和CoMSIA两个计算模型构建了一类新型4-噻唑烷酮衍生物(30)的三维定量构效关系(3D-QSAR),并由此预测了113个化合物的抗HIV活性。结果显示,在芳环的3'、2″和5″位引入CN、F、Br、Cl等电负性基团时,可增强静电场作用,提高化合物活性,而在4'位引入电负性基团时,则会降低化合物活性;在2'、4'、2″、3″和5″位引入空间位阻较大的基团时,会导致化合物活性降低。
1.2 抗流感病毒活性
流感是由流感病毒引起的流行性疾病,严重时可能威胁到人的生命。近几十年来,全球每年有25万~50万人死于流感或流感病毒感染引起的并发症[15-16]。
近年来,有关4-噻唑烷酮衍生物抗流感病毒活性研究的报道相对较少。Ravichandran等[17]设计、合成了一系列4-噻唑烷酮衍生物,并考察了其抗病毒活性。结果发现,其中化合物31能有效抑制A型流感病毒H3N2亚型和B型流感病毒的复制,EC50分别为249和263μmol·L-1,且 CC50均大于283μmol·L-1。

2 2,3,5-三取代的4-噻唑烷酮衍生物
2.1 抗人类免疫缺陷病毒活性
诸多研究表明,具有抗HIV活性的2,3,5-三取代的4-噻唑烷酮衍生物主要是HIV逆转录酶和整合酶抑制剂,分别通过抑制HIV的逆转录过程和抑制HIV前病毒DNA插入到宿主染色体中而抑制HIV复制。如Rawal等[18-19]合成的2,3,5-三取代的4-噻唑烷酮衍生物(32)对MT-4细胞中HIV-1逆转录酶有很好的抑制活性,EC50为0.204μmol·L-1,且细胞毒性很低。
定量构效关系研究表明,对于该类化合物,在C-2位上引入除2,6-二卤代苯基以外的其他基团,都可能导致其活性降低,且在C-5位上引入基团,也会导致其活性降低,但在N-3位上引入糠基,则能增强其活性。
Dayam等[20]以第1代 HIV整合酶抑制剂 S-1360(33)及其衍生物为先导化合物,建立了一个β-二酮酸的药效团假说,并从15万个相关分子结构中筛选出1 700个化合物与HIV整合酶进行分子对接,最后对其中110个对接效果较好的化合物进行活性测试。结果发现,这些化合物的结构中同时含有水杨酸基团和硫氰酸基团时,其对HIV整合酶表现出较强的抑制活性,而仅含其中1个基团时,其活性便会降低甚至消失;其中化合物34~39的活性最好,IC50分别为(17±11)、(15±10)、(15±3.0)、(36±23)、(32±14)和(33±23)μmol·L-1。
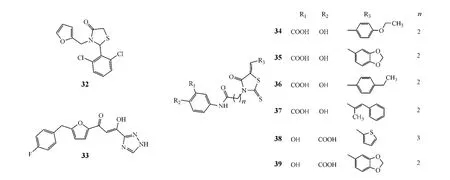
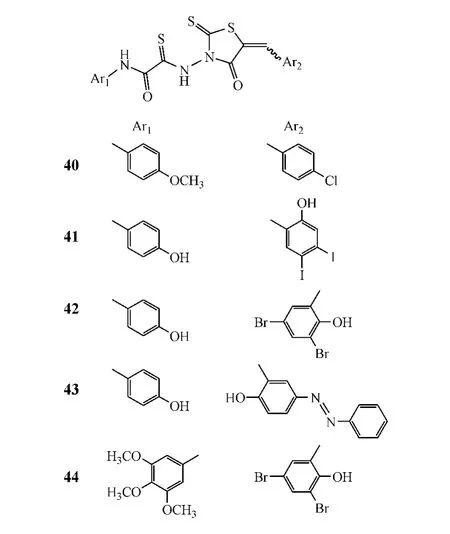
Ramkumar等[21]将上述化合物结构中的脂肪链换成硫代酰胺链,水杨酸基团和C-5位上的芳基均换成其他取代苯基,设计、合成了49个新型4-噻唑烷酮衍生物,并对其抑制HIV整合酶活性进行了测试。结果发现,其中化合物40~44的活性最好,但除了化合物41,活性均低于化合物35和36。
2.2 抗丙型肝炎病毒活性
目前全球丙型肝炎病毒(HCV)感染者人数已近1.7亿,且其病情有可能进一步发展为肝硬化和肝癌[22]。自1989年首次发现HCV以来,研究与开发的抗HCV药物大多是靶向HCV的各种酶,特别是NS3-4A丝氨酸蛋白酶和NS5B RNA聚合酶。具有抗HCV活性的4-噻唑烷酮衍生物BMS-858(45)和BMS-824(46)的作用靶点就是NS5B RNA聚合酶,通过抑制HCV生命周期中的多功能蛋白NS5B的高度磷酸化而达到抑制HCV复制的目的[23]。活性试验结果显示,BMS-858和BMS-824抑制Huh-7细胞系中HCV复制的EC50分别为0.57μmol·L-1和5 nmol·L-1,后者活性几乎是前者的100倍[24-26]。

在Rawal等[27]合成的一系列新的2,3-二芳基-4-噻唑烷酮衍生物中,化合物47~51在0.25 mmol· L-1浓度下对HCV NS5B RNA聚合酶活性的抑制率均达95%以上,且化合物47和49的IC50仅分别为31.9和32.2μmol·L-1。
此外,Ramkumar等[21]报道的化合物52为一种HCV NS3蛋白抑制剂。HCV NS3蛋白在病毒体的成熟和复制中起着重要作用,是近年来抗HCV药物研究的又一重要靶点。

3 结语
现在研究发现的具抗病毒活性的4-噻唑烷酮衍生物大多为抗HIV、抗HCV和抗流感病毒的活性化合物,但可以相信,随着结构生物学和计算机辅助药物设计技术的发展以及对4-噻唑烷酮衍生物的生物学活性与构效关系研究的深入,对4-噻唑烷酮基本骨架进行适当的结构修饰和改造,必将会设计并合成出更多的高效低毒、适于临床使用的新型4-噻唑烷酮类抗病毒药物。
[1] Verma A,Saraf S K.4-thiazolidinonea biologically active scaffold[J].Eur J Med Chem,2008,43(5): 897-905.
[2] Summers M F,Karn J.Special issue:structural and molecular biology of HIV[J].J Mol Biol,2011,410(4): 489-490.
[3] Rawal R K,TripathiR,Katti SB,etal.Synthesis and evaluation of 2-(2,6-dihalophenyl)-3-pyrimidinyl-1,3-thiazolidin-4-one analogues as anti-HIV-1 agents[J].Bioorg Med Chem,2007,15(9):3134-3142.
[4] Rao A,Balzarini J,Carbone A,et al.2-(2,6-Dihalophenyl)-3-(pyrimidin-2-yl)-1,3-thiazolidin-4-ones as nonnucleoside HIV-1 reverse transcriptase inhibitors[J].Antiviral Res,2004,63(2):79-84.
[5] Rao A,Carbone A,Chimirri A,et al.Synthesis and anti-HIV activity of 2,3-diaryl-1,3-thiazolidin-4-ones[J].Farmaco,2003,58(2):115-120.
[6] Barreca M L,Balzarini J,Chimirri A,et al.Design,synthesis,structure-activity relationships,and molecular modeling studies of 2,3-diaryl-1,3-thiazolidin-4-ones as potent anti-HIV agents[J].JMed Chem,2002,45(24): 5410-5413.
[7] Barreca M L,Chimirri A,De Luca L,et al.Discovery of 2,3-diaryl-1,3-thiazolidin-4-ones as potent anti-HIV-1 agents[J].Bioorg Med Chem Lett,2001,11(13): 1793-1796.
[8] Barreca M L,Chimirri A,De Clercq E,et al.Anti-HIV agents:design and discovery of new potent RT inhibitors[J].IL Farmaco,2003,58(3):259-263.
[9] Rao A,Balzarini J,Carbone A,et al.Synthesis of new 2,3-diaryl-1,3-thiazolidin-4-ones as anti-HIV agents[J].IL Farmaco,2004,59(1):33-39.
[10]Murugesan V,Tiwari V S,Saxena R,et al.Lead optimization at C-2 and N-3 positions of thiazolidin-4-ones as HIV-1 non-nucleoside reverse transcriptase inhibitors[J].Bioorg Med Chem,2011,19(22):6919-6926.
[11]Rawal R K,Tripathi R,Katti SB,et al.Design,synthesis,and evaluation of 2-aryl-3-heteroaryl-1,3-thiazolidin-4-ones as anti-HIV agents[J].Bioorg Med Chem,2007,15 (4):1725-1731.
[12] Balzarini J,Orzeszko-Krzesinska B,Maurin J K,et al.Synthesis and anti-HIV studies of 2-and 3-adamantylsubstituted thiazolidin-4-ones[J].Eur J Med Chem,2009,44(1):303-311.
[13]Balzarini J,Orzeszko B,Maurin J K,et al.Synthesis and anti-HIV studies of2-adamantyl-substituted thiazolidin-4-ones[J].Eur JMed Chem,2007,42(7):993-1003.
[14]Ravichandran V,Prashantha Kumar B R,Sankar S,et al.Predicting anti-HIV activity of1,3,4-thiazolidinone derivatives:3D-QSAR approach[J].Eur JMed Chem,2009,44(3):1180-1187.
[15]Liu Y,Jing F,Xu Y,et al.Design,synthesis and biological activity of thiazolidine-4-carboxylic acid derivatives as novel influenza neuraminidase inhibitors[J].Bioorg Med Chem,2011,19(7):2342-2348.
[16]Tumpey TM,Belser JA.Resurrected pandemic influenza viruses[J].Annu Rev Microbiol,2009,63:79-98.
[17]Ravichandran V,Jain A,Kumar K S,etal.Design,synthe-sis,and evaluation of thiazolidinone derivatives as antimicrobial and anti-viral agents[J].Chem Biol Drug Des,2011,78(3):464-470.
[18]Rawal R K,Solomon V R,Prabhakar Y S,et al.Synthesis and QSAR studies on thiazolidinones as anti-HIV agents[J].Comb Chem High Throughput Screen,2005,8(5): 439-443.
[19]Rawal R K,Prabhakar Y S,Katti SB,et al.2-(Aryl)-3-furan-2-ylmethyl-thiazolidin-4-ones as selective HIV-RT inhibitors[J].Bioorg Med Chem,2005,13(24): 6771-6776.
[20]Dayam R,Sanchez T,Clement O,et al.Beta-diketo acid pharmacophore hypothesis.1.Discovery of a novel class of HIV-1 integrase inhibitors[J].JMed Chem,2005,48 (1):111-120.
[21]Ramkumar K,Yarovenko V N,Nikitina A S,etal.Design,synthesis and structure-activity studies of rhodanine derivatives as HIV-1 integrase inhibitors[J].Molecules,2010,15(6):3958-3992.
[22]Aly H H,Shimotohno K,Hijikata M,et al.In vitro modelsfor analysis of the hepatitis C virus life cycle[J].Microbiol Immunol,2012,56(1):1-9.
[23]Gao M,Nettles R E,Belema M,et al.Chemical genetics strategy identifies an HCV NS5A inhibitor with a potent clinical effect[J].Nature,2010,465(7294):96-100.
[24]Lemm J A,O'Boyle D,II,Liu M,et al.Identification of hepatitis C virus NS5A inhibitors[J].J Virol,2010,84 (1):482-491.
[25]Lemm JA,Leet JE,O'Boyle D R,II,et al.Discovery of potent hepatitis C virus NS5A inhibitors with dimeric structures[J].Antimicrob Agents Chemother,2011,55 (8):3795-3802.
[26]Keller T H,Shi P Y,Wang Q Y.Anti-infectives:can cellular screening deliver?[J].Curr Opin Chem Biol,2011,15(4):529-533.
[27]Rawal R K,Katti SB,Kaushik-Basu N,et al.Non-nucleoside inhibitors of the hepatitis C virus NS5B RNA-dependant RNA polymerase:2-aryl-3-heteroaryl-1,3-thiazolidin-4-one derivatives[J].Bioorg Med Chem Lett,2008,18(23):6110-6114.

