难溶性药物渗透泵控释制剂的研究现状
徐良娟, 王 柏
(中国药科大学药剂学教研室,江苏南京211198)
药物剂量和给药间隔对维持体内药物治疗窗浓度、保证疗效以及降低药物毒副作用至关重要。而患者对某些需长期且频繁服用的药物的顺应性会大大降低,故限制了这些药物的临床应用,若将其制备成控释型药物传递系统,则既可增加药物的疗效,又可减少服用次数,有利于提高患者的顺应性。目前,在众多的控释制剂中,渗透泵控释制剂是控释效果最为理想的一种以零级释药为特征、膜内外渗透压差为释药动力的新型药物传递系统,其释药行为受介质环境pH值、胃肠蠕动和食物的影响较小,体内外释药行为的相关性良好,而且能够在较长时间内维持恒速释药,从而可减少用药频次,减小血药浓度的波动,降低药物的毒副作用,提高用药的安全性和有效性。此外,渗透泵制剂易于实现工业化生产,现已成为国内外缓控释制剂的研究热点。
自1955年Rose和Nelson首次将渗透泵原理运用于药物传递系统而制备出首个植入型渗透泵制剂以来,渗透泵制剂研究取得了长足发展[1]。如今,药学工作者通过对渗透泵制剂的结构和释药机制的不断创新、改进,开发出各种类型的渗透泵制剂,如推挽式渗透泵制剂、初级渗透泵制剂以及夹芯式渗透泵制剂,渗透泵制剂的研究已日趋成熟,现已有多种渗透泵制剂产品上市(见表1)[1-5]。近来,Ghosh等[2]还介绍了目前较为热门的液体渗透泵制剂、脂质体渗透泵制剂、脉冲释药式渗透泵制剂等的研究进展。
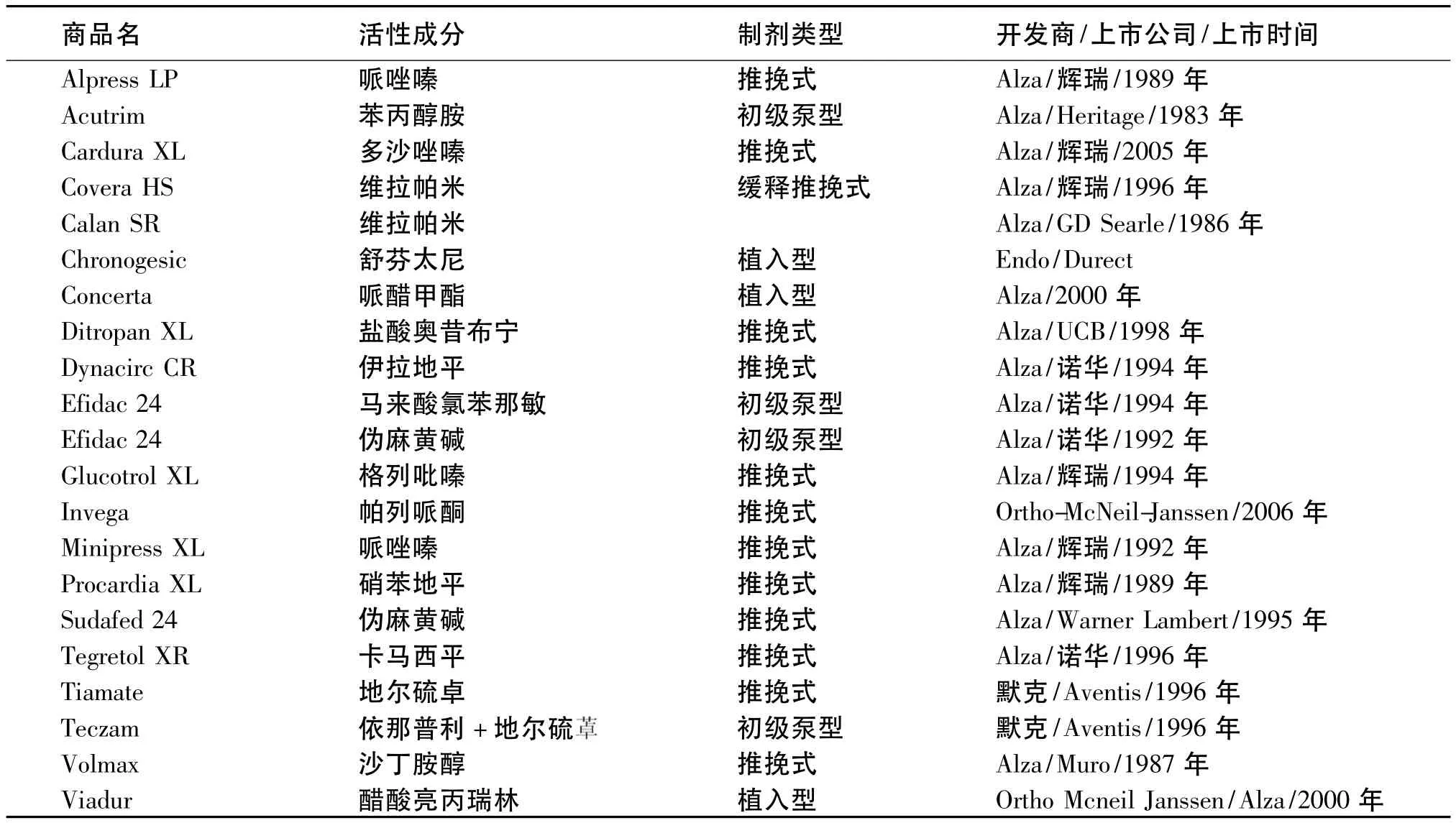
表1 主要的渗透泵制剂上市产品一览表Table1 List ofmain launched osmotic drug delivery systems
渗透泵控释制剂一般为片剂,主要由活性药物、渗透活性物质、促渗聚合物、半透膜包衣材料(包括致孔剂、增塑剂及成膜材料)和其他填充材料组成,其控释原理主要是利用渗透压效应,即在水性环境中水分通过半透膜进入片芯内部,溶解片芯中的药物和渗透活性物质,形成渗透压差很高的饱和溶液,从而使药物随水分一起从释药小孔恒速释出。影响渗透泵控释制剂中药物释放的主要因素有药物溶解度、半透膜的厚度和孔径/孔隙度、膜内外渗透压差、助推层材料和助悬剂的性质以及包衣液中致孔剂和增塑剂的用量等[3]。
渗透泵制剂最初设计用于水溶性药物(溶解度至少达50~100 g·L-1)[6],这主要是由渗透泵原理所决定的,水溶性药物本身易溶于水,其在制剂中溶解后可形成一定的渗透压,有利于药物的释放,目前研究得较为成熟的是用于具中等溶解度(50~300 g·L-1)的药物的渗透泵制剂[7]。有研究表明,由高通量药物筛选而获得的活性物质中约有40%是水难溶性的[8]。而难溶性药物由于水溶性差,影响其活性,难以用于临床,因此研究与开发难溶性药物渗透泵控释制剂的意义重大。目前,难溶性药物渗透泵制剂的主要类型有推挽式、单室单层型和夹芯式,其中推挽式渗透泵制剂是目前可实现难溶性药物恒速、持久缓释的较为理想的一种新剂型。
1 推挽式渗透泵制剂
推挽式渗透泵制剂(PPOP,又称双层渗透泵制剂)由含药层、助推层和半透膜组成,在水性环境中外界水分经过半透膜进入含药层和助推层后,使含药层水化形成含药混悬液,而助推层中高分子吸水膨胀,推动含药混悬液经小孔释出。目前难溶性药物渗透泵制剂中研究得最为成熟的即是PPOP[9],这种双层片芯的渗透泵由于助推层的作用,能更好地控制难溶性药物的释放,使其更接近恒速并完全释放。对于半衰期为1~12 h、治疗指数为2~4、溶解度小于50 g·L-1、刺激性较大、需长期服用的药物宜考虑制成PPOP[10]。PPOP的释药速率主要与释药孔径、膜厚度、膜内外压力差、混悬液黏度以及药物含量有关。
1.1 含药层处方工艺
含药层主要由活性药物、促渗聚合物、渗透活性物质以及其他可提高药物溶解度的表面活性剂或酸碱调节剂等组成。其中,渗透活性物质可产生高渗透压,这是渗透泵制剂释药的基本动力,且恒定的渗透压是药物恒速释放的前提,常用的渗透活性物质有乳糖、葡萄糖、甘露醇、氯化钠等;为改善难溶性药物的溶解性,可在处方中加入酸碱助溶剂、环糊精、表面活性剂等,或合成溶解性能较好的前体药物[11];促渗聚合物则作为助悬剂,可使药物在含药层水性环境中以混悬液的形式存在,继而在助推层的作用下释出,常用的促渗聚合物有聚氧乙烯(PEO)、聚乙烯基吡咯烷酮(PVP)、羟丙基甲基纤维素(HPMC)等。不同相对分子质量的促渗聚合物的黏度差异较大,而黏度大小可影响其在含药层中的助悬效果,所以在含药层处方中应选用适宜相对分子质量的促渗聚合物。颜廷旭等[12]在四逆散双层渗透泵控释片片芯含药层中试用不同相对分子质量的PEO作为助悬剂,结果,体外释药试验发现,不同相对分子质量的PEO对药物释放的影响存在显著差异:选用PEO-N10(Mr=1×105)时,可致前期药物释放较快;而选择PEO-N12K(Mr=1×106)时,则药物释放迟缓,且释药不完全;而用中等相对分子质量的PEO-N750(Mr=3×105)作为助悬剂时,制剂的释药速率适宜,释药完全。该研究小组还考察了含药层中乳糖、甘露醇和氯化钠等不同渗透活性物质对制剂体外释药行为的影响,结果发现,氯化钠的使用可致制剂中药物释放更接近零级动力学过程,而以十二烷基硫酸钠(SDS)作为增溶剂,能提高四逆散中某些难溶性有效成分的溶解度。因此,该研究小组最终得到的此渗透泵控释片优化处方是:含药层中主药、PEO-N750、氯化钠、SDS和硬脂酸的用量分别为343.5、100、30、10和10 mg,助推层中PEO-WSR303和氯化钠的用量分别为100和30 mg。由此处方制得的渗透泵控释片每片质量为623.5 mg,体外释放实验表明,其在12 h内呈现零级释药特性。
1.2 助推层处方工艺
有许多难溶性药物的渗透泵制剂会因后期渗透压降低而导致药物释放动力不足,即使加入大量的促渗剂和助悬剂也无法达到完全释放。为了解决这个问题,研究者们在制备含药层的同时增加了助推层,利用助推层中高分子材料吸水膨胀的特性,为含药层提供推力,将含药混悬液推出片芯,以达到持续释放的目的。助推层主要由膨胀性高分子材料、渗透活性物质、润滑剂、色素等组成,其中膨胀剂一般选用相对分子质量为300×105~800×105的PEO[6]或交联羧甲基纤维钠(CCMC-Na),也可将其与HPMC合用而起助推作用。Enkhtogtokh等[13]在助推层中采用相对分子质量为1×106的PEO和HPMC E5作为膨胀剂(两者占助推层总质量的90%),并与氯化钠(5%)、硬脂酸镁(1%)、氧化铁(4%)混合,成功制备了硝苯地平双层渗透泵片。由于PEO和HPMC E5具有持久的水合能力,故在片剂中可促使药物持续释放,实现药物24 h零级释放。将此硝苯地平渗透泵控释片和普通片分别单剂量经口给予家兔,结果,两者在家兔体内的Cmax分别为(0.299± 0.035)和(0.452±0.038)mg·L-1,tmax分别为(12.05±0.28)和(5.98±0.47)h,渗透泵片相对于普通片的相对生物利用度为(119.5±7.2)%。可见,渗透泵片可降低硝苯地平的Cmax值,显著延长其Tmax,提高药物的生物利用度。Ketjinda等[14]采用壳聚糖(CS)-丙烯酸(PAA)共聚物作为助推层膨胀剂,制备非洛地平推挽式渗透泵片,并考察了具不同配比的CS-PAA共聚物和不同类型增塑剂对药物释放的影响。结果,体外释放实验发现,在增塑剂不变的情况下,制剂中药物的释放速率随着共聚物中CS比例的增加而加快,而通过改变增塑剂的种类和用量可不同程度地延长制剂的零级释药时间,如选用质量比分别为1∶2、1∶1和2∶1的增塑剂PEG400与共聚物时,制剂可实现12 h释药,而选用质量比分别为1∶2、1∶1和2∶1的增塑剂癸二酸二丁酯与共聚物时,均能使制剂释药时间延长至24 h。
1.3 包衣膜处方工艺
渗透泵片一般均需在片芯表面包裹半透膜,半透膜主要由成膜材料、致孔剂和增塑剂组成,在水性环境中水分经过半透膜进入片芯溶解或水化内容物,致使药物经释药小孔释出。激光打孔是常用的半透膜打孔方法,但采用该方法打孔,可能会导致膜灼烧而使打出的孔径不一,且所打孔数有限,制剂口服后经胃肠道时其孔道易被堵塞而导致无规则释药或释药不完全。为了解决这一难题,研究人员采用非对称膜技术,先将包衣膜制成微孔型膜再打孔,这样便能更好地控制药物的释放。非对称膜主要是利用包衣成膜材料中加入的水溶性小分子(致孔剂)处于水性环境中时易溶解而在膜上形成孔隙,实现原位致孔,具有高的渗透性,可致使药物释放速率加快,更适用于难溶性药物制剂。常用的非对称膜材料有醋酸纤维素(CA)、乙基纤维素、醋酸丁酸纤维素或它们的混合物,常用致孔剂有丙三醇、山梨醇、二甲亚砜、PVP和聚乙二醇(PEG)以及其他水溶性小分子[15],常用增塑剂是邻苯二甲酸二乙酯、三乙酸甘油酯和PEG等。Malaterre等[16]制备了可同时释放难溶性药物依拉地平和可溶性药物氯苯那敏的双层渗透泵片,体外释放实验发现,当载药量提高至20%~30%时,药物以凝胶状或混悬液的形式释出,其释放行为与药物的性质无关;除了受药物本身特性的影响外,药物释放行为的其他主要影响因素依次是PEG消除速率[用对数值表示ln(kPEG)]、氯化钠用量、PEO相对分子质量以及片芯表面积。这说明膜的渗透性和片芯中渗透活性物质的用量对药物的控释起关键作用。此外,通过电子显微电镜观察发现,当膜材料中PEG与CA的质量比大于1∶3时,形成的膜上可见均匀分布的20~50 nm小孔,进一步证实了致孔剂的原位致孔作用。该项实验研究表明,这种双层渗透泵片可实现两种溶解性不同的药物同时完全释放。
笔者所在课题组也对难溶性药物的推挽式渗透泵制剂进行了研究:选用卡维地洛作为模型药物,通过单因素考察确定了含药层助悬剂PEO的用量为75 mg,助推层材料选用PEO 75 mg和HPMC 30mg;在此基础上,以致孔剂PEG400、增塑剂邻苯二甲酸二乙酯以及促渗剂氯化钠的用量为考察因素,采用中心复合效应面法进行处方优化,结果,所得优选处方能实现16 h内零级释药。家兔体内药动学实验显示,该卡维地洛渗透泵制剂和市售普通片的Cmax分别为55.44和187.53μg·mL-1,tmax分别为8.5和 1 h,渗透泵制剂相对于普通片的相对生物利用度为106.91%。可见,渗透泵片能显著延长卡维地洛的Tmax,降低其Cmax值。目前,本课题组正致力于将卡维地洛制备成固体分散体,以提高卡维地洛在水中的溶解度,进而将其制备成工艺较简单的单室单层型渗透泵制剂,而上述对双层渗透泵片的研究将为这项研究后期工作提供参考和依据。
2 单室单层型渗透泵制剂
难溶性药物推挽式渗透泵制剂的制备工艺复杂,需要带有含药层识别功能的打孔设备,生产成本较高。为了简化工艺、降低成本、提高药物的溶解度和膜通透性,国内外学者在高分子促渗聚合物的使用以及改进包衣膜成分等方面对渗透泵制剂进行了大量的研究,使难溶性药物适合于制备成单室单层型渗透泵制剂。对于单室单层型渗透泵制剂,可采用常规方法压制片芯,无需确定打孔面,制备工艺简单,更易于实现规模化生产,是目前渗透泵制剂的研究热点。但由于难溶性药物不能形成均一的溶液,在片芯中难以形成较高的浓度和渗透压,无法维持适宜的释药速率,因此不能简单地按渗透泵释药原理制备难溶性药物的单室单层型渗透泵制剂。
2.1 片芯处方工艺
2.1.1 提高片芯中药物溶解度的方法
方法一,在药物中加入酸碱性助溶剂。许多难溶性药物的溶解度具有pH依赖性,其在中性水环境中难溶,但可与酸碱反应而提高溶解度,因此此类药物可通过加入酸碱助溶剂而制备成单室单层渗透泵制剂。马锐等[17]以枸橼酸为助溶剂,使得难溶性药物盐酸尼卡地平的溶解度从7.90 g·L-1提高到约80 g·L-1,使其适于制备成简单的单层渗透泵制剂。该研究小组将质量比为1∶1的枸橼酸和乳糖分别作为渗透活性物质和辅助渗透活性物质,与主药混合均匀,湿法制粒,压制片芯,用以丙酮-乙醇(95∶5)为溶剂的CA与PEG-1500(CA用量的0.7%)的混合溶液包衣(包衣增重6%),激光单面打孔(孔径为0.4 mm),体外释放实验结果表明,制得的渗透泵制剂基本可实现零级释药,且24 h内累计释药量达95%以上。
方法二,将药物制成固体分散体。固体分散体是指将药物高度分散于固体载体中而形成的一种以固体形式存在的分散系统,可提高难溶性药物的溶解度和生物利用度,降低药物的毒副作用,是制备缓控释药物制剂的常用技术之一[18-19],也已成为制备难溶性药物渗透泵制剂的一种有效方法。刘辉等[20]采用超临界流体技术制备了布地奈德-PEO N750(1∶10)固体分散体,并以此作为片芯材料,通过优化处方,制得布地奈德固体分散体增溶型单层渗透泵片,其中片芯含固体分散体99 mg、氯化钠200 mg、微粉硅胶/微晶纤维素预混辅料(SMCC) 150 mg和硬脂酸镁1 mg,包衣膜含CA 6 mg和PEG400 2.4 mg。体外释放实验显示,该制剂可在12 h内近乎恒速释药。吴敏等[21]采用熔融法将岩白菜素和PEG6000按质量比1∶4制成固体分散体,使岩白菜素的溶解度从1.615 g·L-1提高到3.786 g·L-1,然后将此固体分散体与甘露醇、PEO等辅料混合压片并包衣,其中甘露醇用量为20%,而作为助悬剂的相对分子质量为35×105和55×105(1∶1)的PEO用量则占片芯质量的3.5%。体外释放实验显示,由此处方制得的渗透泵片12 h累积释药达到90%以上。
方法三,将药物与β-环糊精(β-CD)制成包合物。难溶性药物与β-CD形成包合物后,可使药物高度分散,能显著提高其溶解度、稳定性及生物利用度,因此,研究者们将包合物引入渗透泵控释制剂的开发中[22]。Sotthivirat等[23]将磺丁基醚-β-环糊精[(SBE)7M-β-CD]与泼尼松龙按1∶2摩尔比制成包合物,再将此包合物66.5 g、泼尼松龙5.5 g和微晶纤维素(MCC)128 g混合,以湿法制粒,压制片芯,然后以醋酸丁酸纤维素为包衣材料,枸橼酸三乙酯为增塑剂(18.2%),蔗糖为致孔剂(21.2%),制得渗透泵片。体外释放实验发现,该渗透泵制剂中76%的药物是以渗透机制释放。刘洪等[24]采用饱和水溶液法将摩尔比为1∶1的岩白菜素与β-CD制成包合物,然后按处方量将此包合物与PEO、甘露醇等辅料混合压制成单层片芯,再以CA为包衣材料,PEG1500为致孔剂,制得渗透泵片。体外释放实验显示,该渗透泵系统的溶出速率接近零级释药(r=0.989 7)。
2.1.2 高分子促渗聚合物的使用
高分子促渗聚合物可作为助悬剂,在片芯中吸水溶胀后能使难溶性药物形成混悬液并释出。目前,难溶性药物单室单层型渗透泵制剂中最常用的高分子促渗聚合物是PEO、阿拉伯胶、PVP、羧甲基纤维素钠(CMC-Na)等。辛伟等[25]采用CMC-Na作为助悬剂,甘露醇和乳糖为渗透活性物质,10%酒石酸为酸性助溶剂,制得盐酸青藤碱单室渗透泵控释片,其中,片芯处方为盐酸青藤碱24.0 g、甘露醇40.0 g、乳糖28.0 g、CMC-Na 1.1 g、酒石酸10.8 g以及3.0 g的PVPK30,包衣材料为醋酸纤维素,致孔剂为PEG4000。体外实验显示,该单室渗透泵控释片可持续释药16 h,药物释放曲线符合零级释药模型。王娟等[26]采用熔融法,将泊洛沙姆188与药物西罗莫司按质量比10∶1制得固体分散体,并对助悬剂PEO的相对分子质量和用量、渗透活性物质的种类和用量以及包衣液中PEG400的用量进行优化,最终确定最佳处方为:片芯由药物固体分散体(含药物9%)1.10 g、PEO 3.00 g、氯化钠7.00 g和硬脂酸镁0.07 g组成,包衣液由CA 1.20 g、PEG400 0.14 g和丙酮-水(95∶5)100 mL组成,衣膜增重12 mg。体外实验显示,由此处方制得的西罗莫司单层高分子渗透泵控释片呈显著的体外零级释放特征。
2.2 包衣膜处方工艺
采用微孔型渗透泵片技术,控制包衣膜的孔隙率和厚度,可为改善包衣膜的通透性,实现药物控释。Prakash等[27]以模型药物茶碱的24 h释放百分量为考察指标,对渗透泵片包衣处方中的变量进行多元分析,发现不同类型的增塑剂和致孔剂对药物释放的影响有显著差别,故考察了制剂中不同类型的增塑剂(PEG400和三乙酸甘油酯)和致孔剂(PVP和山梨醇)在不同用量时对药物释放的影响。结果显示,制剂释药速度随PEG400用量的增加而加快,随三乙酸甘油酯用量增大而降低,且随着致孔剂用量的增加而提高,其中PVP对药物释放速率的提高作用较山梨醇更明显。体外实验显示,以PEG400为增塑剂、PVP为致孔剂、乙基纤维素为包衣材料(溶剂为乙醇)等优化处方,制得的茶碱单层渗透泵片在24 h内释药达98.2%以上。
3 夹芯式渗透泵制剂
夹芯式渗透泵制剂主要由两个含药层、1个助推层和包衣膜组成,其中,两个含药层夹着1个助推层组成片芯,包衣后在两个药物层各打1个孔,包衣膜可控制水进入片芯的速度,而进入片芯的水可使助推层体积膨胀,推动液化的药物从释药孔释出。而且,在夹芯渗透泵片的制备过程中避免了双层渗透泵片制备过程中需对含药层进行辨认的过程,使工艺有所简化。此外,夹芯渗透泵制剂由于其独特的结构,有利于同步控制不同溶解特性或不同作用机制的药物的释放,适用于复方制剂的制备。
3.1 片芯处方工艺
在研究难溶性药物夹芯渗透泵制剂的片芯处方工艺时,首先需考虑解决药物的溶解性问题,用于提高药物溶解性的方法除“2.1.1”节所述外,也可通过加入高分子助悬剂等手段。
刘龙孝等[28]以硝苯吡啶为模型药物,先将该固体药物进行深层粉碎至平均直径约为15μm的微粒,再用相对分子质量为3×105的PEO作为夹芯渗透泵片含药层的助悬剂,而用相对分子质量为8×106的PEO作为助推层的膨胀剂,并经处方优化,制得硝苯吡啶夹芯渗透泵片,且其两个含药层侧面各打有1个0.5 mm的释药孔。体外释放实验显示,该渗透泵片能在24 h内匀速释药;且释药孔孔径在0.50~1.40 mm范围时,其释放曲线与市售双层渗透泵片的释放曲线基本重合,释药速率分别为0.88~1.22和0.86~1.18 mg·h-1;而与市售常规胶囊相比,该夹芯渗透泵片的释药速率波动较小。可见,该夹芯渗透泵片可达到控制药物匀速释放的目的,且由于打孔时无需辨认药物层,其制备工艺得以简化。Kumaravelrajan等[29]选用相对分子质量为6×105的PEO作为含药层助悬剂,相对分子质量为8×106的PEO作为助推层膨胀剂,制得硝苯地平(NP)和美托洛尔(MP)分处不同含药层的夹芯渗透泵片,并通过对片芯、释药孔孔径、增塑剂、包衣膜厚度等进行优化,得到最佳处方:NP或MP含药层分别由NP 22 mg或MP 53 mg、PEO 60 mg、氯化钾30 mg和MCC 20 mg组成,助推层由PEO 60 mg、氯化钾 40 mg、MCC 10 mg组成,释药孔孔径为550μm,包衣材料中PEG用量为CA的20%,包衣增重8%。体外实验显示,由此处方制得的夹芯渗透泵片在16 h内达到零级释药;与NP胶囊和MP胶囊相比,该夹芯渗透泵片中两药在24 h内的释放接近恒速,其中NP在2~20 h内每小时释放量维持在4.46%~4.15%范围,MP在2~16 h内每小时释放量达5.16%~4.97%,而两药的胶囊剂最初释放率都很高,随后逐渐降至零,其释放曲线尖锐且波动较大,NP和MP胶囊在24 h内的释放率波动范围分别为0.55%~5.11%和1.21%~11.31%。
3.2 包衣处方工艺
在夹芯渗透泵片的制备过程中,常采用双面打孔结合控制包衣膜通透性的方法来实现药物的控释。对于两个含药层所含药物相同的夹芯渗透泵制剂,一般采取双面打相同孔径的释药孔,而对于两个含药层所含药物不同的夹芯渗透泵制剂,有时为了使两个含药层药物释放速率不同,实现双速控释,常施行不同含药层打不同孔径的释药孔或对片芯进行不对称外形设计以使包衣层厚度出现差异,或将这两种方法结合运用。赵志全等[30]通过一系列科学的处方设计,并采用片芯不对称外形设计,将具不同溶解性的药物阿昔莫司(水溶性)和辛伐他汀(难溶性)制成复方渗透泵控释片,实现了两种药物同步双速释放。其中,分别含阿昔莫司和辛伐他汀的两个含药层采用了不同孔径的释药孔,以调节两药的释放速率,经优化筛选确定阿昔莫司和辛伐他汀含药层释药孔的最佳孔径分别为0.5和0.8 mm,这样可将辛伐他汀的8 h释放率控制在90%左右,避免了多剂量给药造成的药物蓄积;且片芯的不对称外形设计不但可与不同孔径的释药孔相配合而使片剂达到更好的双速控释效果,还便于识别片剂两面,以实施区别打孔。该渗透泵片的优化处方为:阿昔莫司含药层由阿昔莫司280 g、果糖115 g以及4 g PVPk30和2 g硬脂酸镁组成,辛伐他汀含药层由辛伐他汀10 g、PEG4000 20 g、甘露醇60 g以及2 g PVPk30和1 g硬脂酸富马酸钠组成,助推层由聚乙烯醇20 g和乙基纤维素20 g组成,包衣膜由乙基纤维素12 g、HPMC 2 g、PEG4000 2.5 g和邻苯二甲酸二乙酯1 g组成。体外释放实验显示,该渗透泵片的12 h释药率达90%以上,且释药曲线呈线性。
夹芯渗透泵片的开发有望实现复方制剂中不同药物的控释,保证联合用药的有效性。但由于夹芯渗透泵片的压片工艺复杂,目前尚未实现大规模工业化生产。
4 结语
现有的渗透泵制剂主要用于水溶性药物,且对其的研究也已趋于成熟。然而,难溶性药物由于水溶性差,其临床应用受到极大限制。如果能将治疗指数低的难溶性药物制备成渗透泵制剂,不仅可提高药物的有效性和安全性,还可扩大渗透泵制剂的应用范围,促进渗透泵制剂的发展。因此,将难溶性药物制备成控释效果良好的渗透泵制剂,已成为目前渗透泵制剂研究的一个重要的发展方向。且随着渗透泵制剂技术的不断发展,难溶性药物渗透泵制剂的开发已展现出良好前景。
[1] Thakor R S,Majmudar F D,Patel J K,et al.Review: Osmotic drug delivery systems current scenario[J].Pharm Res,2010,3(4):771-775.
[2] Ghosh T,Ghosh A.Drug delivery through osmotic systemsan overview[J].J Appl Pharm Sci,2011,1 (2):38-49.
[3] Brahma PG,Thakur N,Nishi P J,et al.Osmotically controlled drug delivery system with associated drugs[J].JPharm Pharm Sci,2010,13(3):571-588.
[4] Rajan K V,Sanjay G.Current status of drug delivery technologies and future directions[J].Pharm Technol,2001,25(1):1-14.
[5] 贾昆.渗透泵制剂研究进展[EB/OL].(2004-01-04)[2011-11-12].http://www.100md.com.
[6] 潘卫三,甘勇.双室型渗透泵控释制剂的研究进展[J].沈阳药科大学学报,2000,17(2):147-151.
[7] 曲昌海,汤韧,高永良.不同溶解性药物口服渗透泵片片芯的处方设计[J].中国医院药学杂志,2005,25 (12):1164-1165.
[8] Perrut M,Jung J,Leboeuf F.Enhancement of dissolution rate of poorly-soluble active ingredients by supercritical fluid processes:Part I:Micronization of neat particles[J].Int JPharm,2005,288(1):3-10.
[9] Shamblin S L.Controlled release using bilayer osmotic tablet technology:reducing theory to practice[M]//.Wen H,Park K.Oral Controlled Release Formulation Design and Drug Delivery:Theory to practice.Hoboken: John Wiley,2010:129-151.
[10]赵锋,马银玲,王静,等.难溶性药物双层渗透泵控释片的研究进展[J].中国医院药学杂志,2010,30 (20):1772-1774.
[11]杨硕晔,郭允,陈西敬.制剂新技术在水难溶性药物中的应用研究进展[J].中国药房,2011,22(13): 1228-1231.
[12]颜廷旭,杨星钢,潘卫三,等.四逆散双层渗透泵控释片片芯单因素考察[J].中国药剂学杂志,2010,8 (2):64-72.
[13]Enkhtogtokh B,吴正红,陈钦,等.硝苯地平双层渗透泵片的制备及家兔体内药动学研究[J].药学与临床研究,2011,19(4):302-305.
[14]Ketjinda W,Sinchaipanid N,Limsuwan P,et al.Development of push-pull osmotic tablets using chitosan-poly (acrylic acid)interpolymer complex as an osmopolymer[J].AAPSPharmSciTech,2011,12(1):132-140.
[15]Suman S,Chauhan M.Asymmetric membrane capsule: new prospects in osmotic deliver[J].Int J Drug Deliv,2011,3(2):185-193.
[16]Malaterre V,Ogorka J,Loggia N,etal.Approach to design push-pullosmotic pumps[J].Int JPharm,2009,376(1/ 2):56-62.
[17]马锐,王洪亮,刘玉玲,等.盐酸尼卡地平单层渗透泵片的制备及其体外释放行为的考察[J].中国药房,2011,22(21):1967-1969.
[18]张佳良,杨秋霞,陈建明.固体分散体在缓控释制剂中的应用[J].药学实践杂志,2010,28(4):248-250.
[19]艾秀娟.盐酸溴己新缓释片的制备及体外释放度研究[J].海峡药学,2010,22(7):34-35.
[20]刘辉,张宜,符旭东,等.布地奈德固体分散体增溶型渗透泵片的研制及其释药机制[J].中国药师,2009,12(1):5-8.
[21]吴敏,尹蓉莉,李全,等.岩白菜素固体分散体渗透泵片制备工艺[J].中国实验方剂学杂志,2011,17(2): 35-39.
[22]Salústio P J,Pontes P,Conduto C,et al.Advanced technologies for oral controlled release:cyclodextrins for oral controlled release[J].AAPS PharmSciTech,2011,12 (4):1276-1292.
[23]Sotthivirat S,Haslam J L,Lee P I,et al.Release mechanisms of a sparingly water-soluble drug from controlled porosity-osmotic pump pellets using sulfobutylether-βcyclodextrin as both a solubilizing and osmotic agent[J].Pharm Sci,2009,98(6):1992-2000.
[24]刘洪,李德银,曾建,等.岩白菜素包合物渗透泵片体外释药机制研究[J].中国现代应用药学,2011,28 (7):650-652.
[25]辛伟,张志宏,白敏,等.盐酸青藤碱单室单层渗透泵型控释片的制备及释放考察[J].中国药学杂志,2011,46(19):1500-1505.
[26]王娟,张晶,宋洪涛,等.西罗莫司单层高分子渗透泵控释片的制备及其体外释放特性研究[J].中国药房,2010,21(37):3502-3505.
[27]Prakash R B,Geetha M,Purushothama N,et al.Optimization and development of swellable controlled porosity osmotic pump tablet for theophylline[J].Trop J Pharm Res,2009,8(3):247-255.
[28]刘龙孝,姜吉善,李钟文,等.夹芯渗透泵片用于水不溶性药物的控制释放[J].药学学报,2003,38(8): 620-623.
[29]Kumaravelrajan R,Narayanan N,Suba V,et al.Simultaneous delivery of nifedipine and metoprolol tartarate using sandwiched osmotic pump tablet system[J].Int J Pharm,2010,399(1/2):60-70.
[30]赵志全,刘全志,牛童,等.一种复方渗透泵控释制剂及其制备方法:中国,200710128956[P].2009-01-28.

