脂肪酶催化制备丁酸乙酯的研究
沈咏梅,谢晓娜,荀二娜,王佳欣,张 弘,王 磊,王 智
(1.吉林大学白求恩医科大学制药厂,吉林长春 130021;2.吉林大学第一临床医院,吉林长春 130021; 3.吉林大学分子酶学工程教育部重点实验室,吉林长春 130023)
0 引言
丁酸乙酯是一种无色至微黄色透明液体,呈香蕉和菠萝的特殊香味,其天然品主要存在于草莓、橄榄等植物油中.在食品工业中,丁酸乙酯主要被用来配制香蕉、葡萄、草毒、菠萝和朗姆酒等香型的香料,此外,其在玫瑰油香精、烟用香精中亦有使用.在我国,它是GB2760-86规定允许使用的食用香料[1].
目前,除了极少数的酯是由天然植物中提取以外,短链脂肪酸酯几乎全部都是通过传统的化学方法进行生产的,即在高温、高压条件下,由无机催化剂,如浓硫酸、对甲苯磺酸等催化合成.然而,化学生产不仅存在着催化剂可能带来有毒物质的问题,而且剧烈的反应条件也很容易产生有毒的副产物[2,3].此外,采用微生物发酵方法也可以制备短链脂肪酸酯[4],但该方法的主要缺点是产物的浓度低、代谢产物复杂,难以实现工业化大规模生产.近年来,随着科研人员对非水酶学研究的深入,酶在有机溶剂中催化功能的应用不断扩大,利用脂肪酶在有机相中具有较高酯化能力的特性,已经出现一些利用该方法催化制备短链脂肪酸酯的比较成功的例子[5,6].酶法制备短链脂肪酸酯具有反应条件温和、节约能源、副产物少、产品品质高等优点,而且其产品可以被认作天然产物[7].
在本研究中,我们采用脂肪酶BSL2(Bacillus subtilis lipase)作为催化剂,考察了由丁酸与乙醇在常压下直接酯化合成丁酸乙酯的可行性,同时,对其最适反应条件进行了筛选.
1 材料方法
1.1 仪器与试剂
实验所用脂肪酶BSL2由吉林大学分子酶学工程教育部重点实验室自行克隆、表达[8].丁酸、乙醇以及其他化学试剂均采用国产分析纯试剂.
1.2 脂肪酶BSL2粗酶制备
脂肪酶BSL2粗酶制备[8]的方法为:首先,将脂肪酶BSL2工程菌BSL按接种量的1%接种于硫酸卡那霉素的LB培养基上(5 mL,30 μg/mL),恒温30℃下振荡培养20 h.然后,按1%的接种量接种于LB培养基上(200 mL),恒温30℃振荡培养4 h后转接到2 L发酵LB培养基中,继续恒温30℃培养并监测其OD600值,当培养液OD600达到0.8~1.0时,将培养液进行离心分离(8,000 rpm,15 min),收集菌体,将其置于-20℃的溶器中,冷冻过夜.其后,在室温下将菌体融化,加入pH值为8.5的50 mmol/L Tris-HCl缓冲液(约为菌体9倍体积),同时加入溶菌酶(按1∶500(V/V)加入),恒温4℃下将其消化1 h后离心(4℃,12 000 rpm,20 min)分离,收上清液得脂肪酶BSL2粗酶液.最后,用硫酸铵(40%饱和度)对粗酶液进行沉淀,所得到的上清液用硫酸铵(70%饱和度)进行沉淀,沉淀溶解后透析过夜,冻干备用.
1.3 初始水活度(aw)的控制
初始水活度(aw)的控制[9]方式为,通过直接向反应体系中加入水合盐对来控制体系水活度,并在基本反应体系中分别配置不同水活度为0.06(LiBr)、0.11(LiCl)、0.24(KCH3COO)、0.33(MaCl2)、0.53(Mg (NO3)2)、0.75(NaCl)和0.97(K2SO4)的反应体系.
1.4 脂肪酶催化丁酸乙酯的酯合成反应
脂肪酶催化丁酸乙酯的酯合成反应过程为,在20 mL正丁烷中(含有20 mg硅藻土,aw=0.33)加入丁酸(40 mmol/L)、乙醇(60 mmol/L)和100 mg酶粉,置于40℃振荡培养箱中进行反应.产物经GC分析测定丁酸转化率.酯合成反应速度(μmol/g· min)定义为,单位酶(g)在单位时间(min)内催化合成丁酸乙酯的量(μmol).
1.5 GC检测方法
GC检测方法为:岛津GC214B型气相色谱仪(GC),Econo-CAP SE54毛细管柱(30 m×0.32 mm× 0.25 mm),氢火焰检测器;载气N2(60 mL·min-1),进样室温度200℃,检测室温度290℃.升温程序为:起始柱温110℃,保留1 min,升温速率15℃· min-1,最后温度210℃,保留2 min;进样量2 μL.
2 结果与讨论
影响脂肪酶在有机溶剂中催化合成丁酸乙酯反应的因素有很多,除了选择具有较高催化活性的脂肪酶之外,还有许多反应条件因素需要考虑.
2.1 反应介质
有机溶剂对酶活的影响是非水酶学所要阐明的重要因素.溶剂不但直接或间接地影响酶的催化活力和稳定性,而且也能够改变酶的特异性(包括底物特异性、立体选择性、前手性选择性等),有机溶剂主要通过与水、酶、底物和产物的相互作用来影响酶的这些性质[10].在实验中,我们选择了6种不同极性的有机溶剂,研究了反应介质对酶促丁酸乙酯合成反应的影响,结果如表1所示.
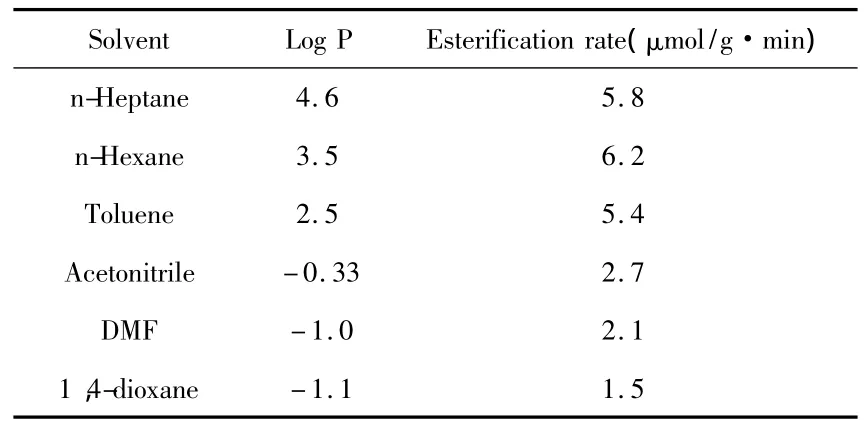
表1 反应介质对酶促丁酸乙酯合成反应的影响
表1数据表明,脂肪酶BSL2催化丁酸乙酯合成反应的反应速度随着有机溶剂极性的增加而下降,在所选择的6种有机溶剂中,正己烷作为反应介质时反应速度最快.这可能是由于极性较强的有机溶剂具有较强的亲水性,其剥夺酶分子必需水的能力较强,容易破坏酶分子的活性构象,因此在这类有机溶剂中,酶的催化活力通常不会太高.
2.2 反应温度
一般来说,反应温度越高反应速度越快,但在高温下酶分子作为一种蛋白质容易变性失活.本研究考察了反应温度对于脂肪酶BSL2催化丁酸乙酯合成反应的影响,结果如图1所示.
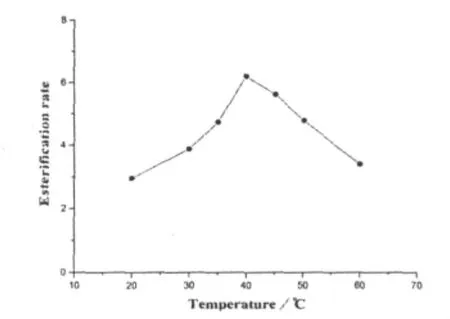
图1 反应温度对酶促丁酸乙酯合成反应的影响
实验结果表明,酯合成反应速度随着反应温度的升高呈现出“钟"形曲线,当反应温度为40℃时,脂肪酶BSL2催化合成丁酸乙酯的反应速度最快.
2.3 底物浓度和底物摩尔比
由于丁酸和乙醇都是具有较强极性的有机化合物,它们的浓度有可能直接影响到酶的催化活性和稳定性,并最终影响酶促反应的反应速度和转化率,故本研究分别考察了底物浓度和底物摩尔比对该反应的影响.
首先,固定丁酸浓度为40 mmol/L,通过改变反应体系中的乙醇量来调节酸醇摩尔比,考察了底物摩尔比对反应的影响,结果如图2所示.

图2 底物摩尔比对酶促丁酸乙酯合成反应的影响
实验结果表明,适当提高酸醇的摩尔比能够提高酯合成反应速度,而底物摩尔比太高则可能会抑制酶活,降低了反应速度.
通过实验发现,最适酸醇摩尔比为1∶1.5.固定底物摩尔比(1∶1.5),调节丁酸的浓度,考察丁酸浓度对酯合成反应速度的影响,结果如图3所示.
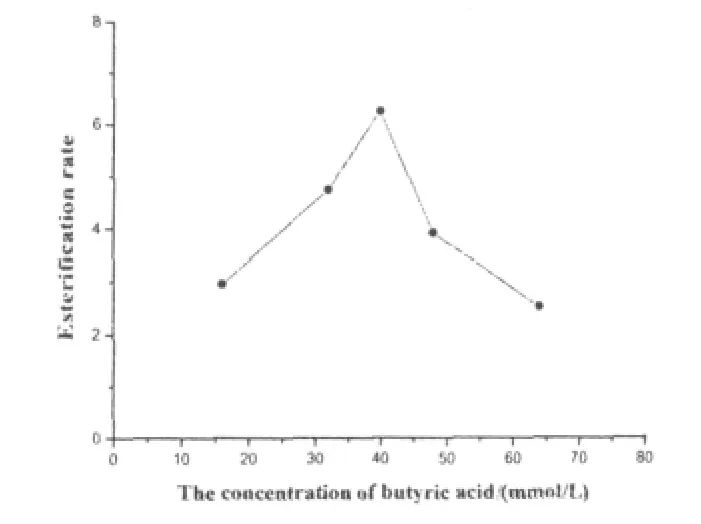
图3 底物浓度对酶促丁酸乙酯合成反应的影响
实验结果表明,当丁酸浓度为40 mmol/L的时候,反应速度最快,进一步增大其浓度,反应速度开始下降,这可能是由于酶活被抑制的缘故.
2.4 加酶量的影响
不同加酶量对酶促丁酸乙酯合成反应速度也会产生影响.本研究分别取10 mg、50 mg、100 mg、150 mg和200 mg酶粉进行酶促酯合成反应,结果如图4所示.
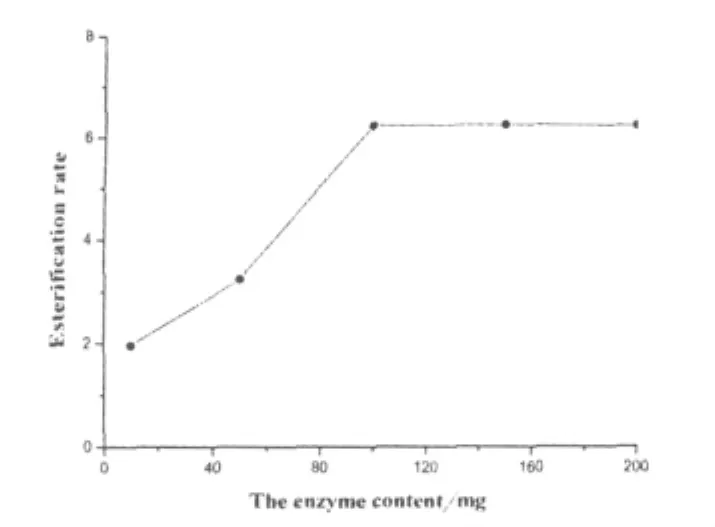
图4 加酶量对酶促丁酸乙酯合成反应的影响
实验结果表明,酶促合成丁酸乙酯的反应速度随着酶量的增加而加快,当酶量达到100 mg时,反应速度达到最大,再增加酶其反应速度不会增加.
2.5 初始水活度的影响
在含微量水的有机介质中,酶的催化活性与反应体系的含水量密切相关[11].一般来说,脂肪酶在完全无水的条件下是没有催化活性的,因为酶需要一定量的水才能维持其催化活性.在有机介质中,微量水直接参与了酶的水化作用,影响酶的催化活性和稳定性.本实验通过改变反应体系的水活度,并对此进行了研究,结果如图5所示.
实验结果表明,当系统初始水活度为0.33时,酯合成反应速度最大.

图5 水活度对对酶促丁酸乙酯合成反应的影响
2.6 酯化反应进程
在最适反应条件下(以正己烷为溶剂,丁酸浓度为40 mmol/L,乙醇浓度为60 mmol/L,加人0.1 g脂肪酶,40℃,aw=0.33)进行酶促丁酸乙酯合成反应,监测不同反应时间丁酸乙酯合成反应的转化率,结果如图6所示.
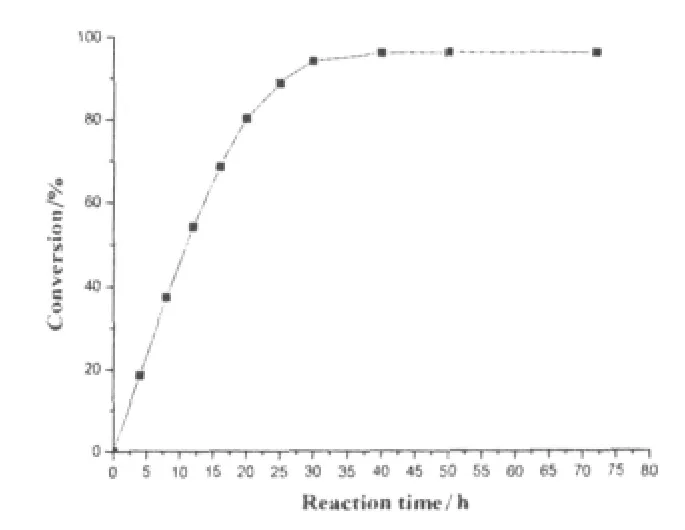
图6 酶促合成丁酸乙酯的反应时间进程
实验结果表明,随着反应时间的延长,酯合成反应的转化率不断增加,当反应时间为30 h的时候,酯合成反应基本达到平衡,此时反应转化率为94.8%.故确定最适反应时间为30 h.
3 结论
本研究利用脂肪酶BSL2作为催化剂,在有机相中催化合成丁酸乙酯.在研究中,考察了反应温度、加酶量、底物浓度、底物摩尔比、反应介质、初始水活度等反应条件对酶促合成丁酸乙酯的影响.试验结果表明,以正己烷为溶剂,初始水活度为0.33,加酶量为100 mg,丁酸浓度为40 mmol/L,底物摩尔比(丁酸/乙醇)为1∶1.5,在40℃条件下振荡反应30 h,合成丁酸乙酣的的转化率可达到94.8%.
[1]贺荣平.香料与香精的应用[J].食品开发,2008,7(9): 12-13.
[2]王浩水,徐顶旺,金思毅.连续反应精馏合成丁酸乙醋[J].化学工业与工程,2006,23(5):377-381.
[3]徐顶旺,金思毅,杨小刚,等.对甲苯磺酸催化合成丁酸乙醋动力学研究[J].青岛科技大学学报,2005,26(1): 26-30.
[4]刘均洪,袁卫平,杨丽,等.微生物酶在香料生产中的应用[J].化学工程与工程技术,1998,19(3):19-21.
[5]李春元,王春宇,王立成,等.固定化嗜热酯酶催化合成己酸乙酯[J].合成化学,2008,16(5):529-532.
[6]徐岩,王亚非,章克昌.有机相中微生物脂肪酶合成短链酯肪酸酯的研究[J].无锡轻工大学学报,1998,17(1): 24-28.
[7]Jaeger K E,Eggert T.Lipases for Biotechnology[J].Current Opinion in Biotechnology,2002,13(4):390-397.
[8]Ma Jisheng,Zhang Zuoming,Wang Baijing,et al.Overexpression and Characterization of a Lipase from Bacillus Subtilis[J].Protein Expression and Purification,2006,45(11):22-29.
[9]Halling P J.Salt Hydrates for Water Activity Control with Biocatalysts in Organie Media[J].Biotechnology Techniques,1992,6(3):271-276.
[10]Fitzpatrick P A,Klibanov A M.How can the Solvent Affect Enzyme Enantioselectivity?[J].Journal of the American Chemical Society,1991,113(8):3166-3171.
[11]王智,冯雁,曹淑桂.微量水对有机溶剂中酶催化的影响与控制方法[J].自然科学进展,2002,12(2):130-134.

