聚氧乙烯辛烷基酚制备去细胞神经移植体
张增祥 赵宝辉 任 宝 薛金伟 张 旋 (河北大学附属医院骨科,河北 保定 07000)
周围神经损伤后造成的较长节段缺损的修复一直是临床治疗中的难题。自体神经移植被公认为是周围神经缺损修复的“金标准”,但对长距离缺损或神经丛的损伤,往往因没有充足的自体神经来源而使治疗陷于困境,且切取后有供区麻木、疤痕、神经瘤等并发症。同种异体神经来源充足,可以方便地选择与受损神经结构相同或相似的神经修复受损神经,但免疫排斥反应限制了异体神经的临床应用。用组织工程方法降低神经的免疫原性,构建组织工程化神经移植体,就可能应用同种异体神经修复周围神经缺损,将为临床修复周围神经缺损开辟一条新的治疗途径。本研究用聚氧乙烯辛烷基酚(Triton X-100)萃取周围神经以去除雪旺细胞等抗原成分,为制备具有天然神经结构的人类去细胞组织工程化神经移植体提供依据。
1 材料与方法
1.1 实验动物及材料 动物:健康新西兰大耳白兔30只(兔龄2~3个月),由河北医科大学实验动物中心提供。材料:Triton X-100(Sigma公司),HITACHIH IB-3型真空离子镀膜仪、HITACHIH S-3500N型扫描电镜由河北医科大学电镜实验中心提供、层黏连蛋白(Laminin)免疫组化染色试剂等由北京中山生物技术有限公司提供。
1.2 方法
1.2.1 实验标本和取材 用空气栓塞法处死白兔后固定于俯卧位,分别自梨状肌下缘水平以远切取10 mm双侧坐骨神经60根。随机分为6组,其中A(12 h组)、B(24 h组)、C(48 h组)、D(96 h组)、E(1 w组)用于化学萃取,F(新鲜神经)为对照组。
1.2.2 化学萃取 先在手术显微镜下剪去表面的脂肪组织和部分神经外膜,然后置于4℃蒸馏水中静置6 h,使细胞和髓鞘在低渗液体中膨胀、细胞被胀破,使之易于Triton X-100的渗透;再将神经放入3%Triton X-100水溶液中分别静置12 h;置于蒸馏水中振荡、漂洗6 h,以使溶于水的Triton X-100膜蛋白复合体充分脱离神经干。如此反复,并且每次更换蒸馏水、Triton X-100水溶液。5组神经Triton X-100萃取时间分别为12 h、24 h、48 h、96 h、1 w。
1.2.3 标本处理 在新鲜神经和萃取后的神经中段分别切取2段2 mm神经,1段神经10%甲醛固定,常规石蜡包埋、纵形切片,分别行HE染色,镜下观察雪旺细胞及神经结构;磷钨酸苏木素(PTAH)染色;光镜下观察髓鞘;阿尔辛蓝(Alcian blue)染色;光镜下观察髓鞘和基底膜;Laminin免疫组化染色;光镜下观察基底膜及其主要成分Laminin。对Laminin免疫组化染色切片进行图像采集,并用真彩色病理图像分析系统对采集的图像作定量分析,对Laminin抗体阳性部位进行灰度测量,计算单位面积平均灰度。另1段神经2.5%戊二醛固定。
1.3 统计学分析 运用SPSS10.0软件行单因素方差分析。
2 结果
2.1 一般性状观察 新鲜神经光泽度好,质地较硬,有弹性;神经萃取过程中可见两端及周围有絮状物析出,萃取后神经呈淡乳白色,色暗,无光泽,其外径及长度较新鲜神经减小,柔软,有韧性,适宜显微操作。
2.2 石蜡切片组织学观察
2.2.1 HE染色 新鲜神经均可观察到雪旺细胞及轴突等结构,雪旺细胞分布均匀,细胞核深染,神经内膜呈管柱状排列整齐,髓鞘清晰可见(图1A)。神经上的雪旺细胞随着处理时间的延长而逐渐减少,分布不规则。细胞核着色变浅,神经内膜与髓鞘的界限不清。萃取96 h时,神经纤维结构消失,红染的神经内膜呈波浪状纵形排列,形成管柱状空隙(图1B)。
2.2.2 PTAH染色 镜下可观察到染成蓝色的神经纤维和基底膜,棕红色的管柱状髓鞘结构,胶原纤维染成浅红或不着色。新鲜神经可观察到蓝色颗粒状的神经轴突,棕红色髓鞘位于轴突周围,排列规则(图1C)。萃取时间为96 h时,去细胞神经显示神经纤维及髓鞘完全消失,仅留下波浪状的基底膜(图1D)。至1 w时仍可见蓝染的基底膜,但连续性欠佳。
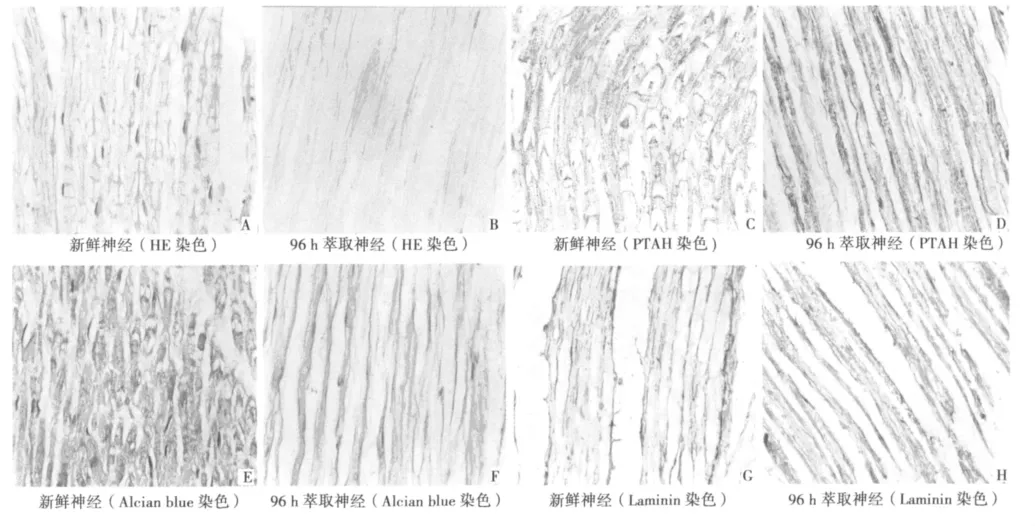
图1 石蜡切片组织学观察结果(×400)
2.2.3 Alcian blue染色 髓鞘粉染,神经基底膜呈绿色。新鲜神经可见粉染的髓鞘、绿色的基底膜排列整齐,基底膜位于髓鞘的外面(图1E)。随着萃取时间的延长,雪旺细胞、粉染髓鞘逐渐减少,髓鞘与基底膜的界限不清,至96 h时去细胞神经纵切片上髓鞘消失,绿色的基底膜呈栅栏样排列,膜与膜之间为中空结构的基底膜管(图1F)。萃取时间为1 w时基底膜排列规则,镜下所见与96 h时相仿,基底膜仍清晰完整,但管状结构排列不规则,部分断裂。
2.2.4 Laminin免疫组化染色 基底膜染成棕红色,细胞核淡蓝染。新鲜神经纵切片上,棕黄染色的神经基底膜呈带状纵形排列,位于轴突周围,排列成管状,并可见蓝染的细胞核(图1G);随着萃取时间的延长,神经上细胞结构、轴突逐渐减少,96 h的标本观察,去细胞神经上细胞结构、轴突已消失,染成棕黄色的基底膜则被保留,呈管状纵形排列,膜与膜之间空虚(图1H)。至1 w时棕红色基底膜仍清晰,管状结构欠规则。
2.3 计算机图像分析 对Laminin免疫组化染色的切片进行图像采集,A~F组切片单位面积Laminin平均灰度分别为140.1±3.41;142.1±3.14;142.1±3.14;140.4±4.03;141.7±2.62;142.7±7.24,各组间比较无显著差异(P=0.751)。
3 讨论
神经的再生主要取决于神经细胞所处的微环境,其主要因素是雪旺细胞和细胞外基质所含的基底膜;基底膜可以反作用于雪旺细胞,增强雪旺细胞迁移和 büngner's带的形成〔2〕;刺激雪旺细胞分裂增殖,没有基底膜,雪旺细胞虽可分裂增殖,但却无法分化成髓鞘,二者关系密切,共同作用,为神经再生提供适宜的微环境。实验表明基底膜各成分对雪旺细胞的贴壁黏附、分裂增殖以及雪旺细胞的髓鞘化有重要的作用,所有雪旺细胞均由一层基底膜包裹,这层基底膜形成一个跨越郎飞氏结的连续管状覆盖。
同种异体神经移植的主要问题是免疫排斥反应,而移植免疫的核心问题是组织相容性复合体(MHC-Ⅱ)。周围神经MHC-Ⅱ的表达产物主要存在于雪旺细胞膜表面,构成了雪旺细胞的膜抗原,其抗原性最强,是产生移植免疫的主要原因〔3〕。如何成功去除细胞和髓鞘结构,以减轻移植体的免疫原性,成为构建组织工程化神经移植体基本问题;能否成功保留雪旺细胞基底膜及其立体管状结构,并保留其主要成分层黏连蛋白的活性,以发挥其促进神经再生、促进雪旺细胞的黏附、迁移、增殖、分化以及基因表达的调控重要的作用,是用组织工程学方法制备神经移植体的核心问题。
Sondell等〔4〕曾报道用Triton X-100和脱氧胆酸处理鼠的坐骨神经,剩余的主要成分为无损伤的基底膜管,从而达到化学萃取的目的。经过化学萃取处理的异体神经移植体无明显抗原性,去细胞神经能够促进和诱导宿主雪旺细胞向移植段内渗透、迁移和增殖〔5〕,有效地促进受体的轴突再生,且无明显排异反应。
Triton X-100是一种温和的非离子型表面活性剂,具有两亲结构,Triton X-100中的疏水端能和膜蛋白的疏水区结合形成复合物,溶解于溶液中〔6〕,本实验采用3%Triton X-100,因为浓度为0.03~5%的水溶液的浊点基本接近,由此可判断其亲水性或疏水性相近似。神经在低渗液体中浸泡处理后,神经雪旺细胞、髓鞘及其他细胞结构被胀破,以利于Triton X-100的浸润,Triton X-100能彻底破坏生物膜,并且清除磷脂类物质,从而使细胞溶解破坏。而细胞外基质具有不溶性,所以可完整保留。这一点在实验中得到充分体现,萃取过程中可发现在神经两端及周围有絮状物析出,随着萃取时间的延长,析出絮状物逐渐减少。萃取后神经外径及长度较新鲜神经减小,柔软,有韧性,适宜显微操作。雪旺细胞、轴突、髓鞘被成功去除,保留了雪旺细胞基底膜。并且各组神经层黏连蛋白仍具有其原有活性。用此法制备的神经移植体是一种天然立体管状支架,保存了完整的雪旺细胞基膜管结构。基膜管的主要成分是层黏连蛋白、纤维黏连蛋白、Ⅳ型胶原等细胞外基质,具有促进引导神经再生的作用。此种支架对雪旺细胞的黏附及其成熟和功能表达又有促进作用。
本实验成功地建立了制备周围神经移植体组织工程学方法。该支架有良好的仿生性,既可直接移植修复周围神经缺损,又可作为雪旺细胞植入的支架,应用前景广阔。但移植体与受体的生物相容性如何,促进神经再生的效果如何,怎样保存与保存时限如何确定,能否在移植体内植入雪旺细胞等,仍需进一步的实验论证。
1 Fawcett JW,Keynes RJ.Muscle basal lamin:a new graft material for peripheral nerve repair〔J〕.J Neurosurg,1986;65(3):354-63.
2 Milner R,Wilky M,Nishimura S,et al.Division of labor of cells in engrains during migration on peripheral nerve extracellular matrix ligands〔J〕.Dev Biol,1997;185(2):215.
3 Trumble TE,Shon FG.The physiology of nerve transplantation〔J〕.Hand Clin,2001;16(1):105-22.
4 Sondell M,Lundborg G,Kanjie M.Regeneration of the rat sciatic nerve into allografts made acellular through chemical extraction〔J〕.Brain Research,1998;795(1):44-54.
5 Dument CE,Hentz VR.Enhancement of axon growth by detergent extracted nerve grafts〔J〕.Transplantation,1997;63(9):1210-5.
6 钟静芬.表面活性剂在药学中的应用〔M〕.北京:人民卫生出版社,1996:13-37.

