住院儿童营养风险筛查和营养治疗的研究现状
彭璐婷 综述 李晓南 审校
充足的营养不仅是维持机体生存的基础,也是儿童生长发育的基本要素。然而,无论是发达国家,还是发展中国家,疾病状态下住院患儿营养消耗和营养不良的现象令人担忧,病程迁延和重症患儿住院期间营养状况甚至呈进行性恶化趋势[1]。国外研究显示住院患儿营养不良的患病率高达15%~30%[2~6]。中国2007年在上海3家儿童专科医院1 901例住院患儿营养状况的调查显示,总的营养不良患病率为24.1%[7]。营养不良不仅影响儿童的生长发育,降低机体功能,而且还可增加营养不良相关并发症以及病死率。2002年欧洲的一份调查报告指出,住院患者营养不良发生率居高不下与缺乏有效的营养风险筛查、临床营养管理不到位密切相关[8],因此欧洲儿科胃肠肝病营养学会(ESPGHAN)呼吁建立“营养支持小组(Nutrition Support Team,NST)”,旨在对住院患儿进行科学有效的营养管理,降低营养不良的患病率[9]。营养风险筛查是营养管理的第一步,通过筛查工具可简便有效地识别出儿童的营养风险状况,以便对存在营养风险的儿童进行早期有效的营养治疗,促进疾病康复并改善其临床预后。本文对住院患儿营养风险筛查和营养治疗现状作一综述。
1 营养风险
1.1 营养风险的定义 营养风险是指基于本身的营养状态,结合临床疾病导致应激性代谢增加等因素造成的营养功能障碍的风险[10]。
1.2 营养风险筛查工具的主要内容 营养风险筛查是一种对患者营养状况的初步筛查工具,不同于全面营养状况评估。营养风险筛查结果可以量化并成为监测指标,不同的风险级别对应着不同的处理方式。2002年欧洲肠外与肠内营养学会[11]建议,营养风险筛查应包括两方面:近期营养状况及食物摄入情况,疾病及其引起的应激性代谢变化。
1.2.1 近期营养状况及食物摄入情况 对儿童而言,体格测量指标及变化可较好地反映机体的营养状况[12]。身高别体重、年龄别体重常用于反映近期的营养状况,而年龄别身高常作为慢性或长期营养状况的指标[13]。在无法测量体重时,中上臂围是很好的替代指标,主要反映肌肉、骨骼、体液和脂肪组织等总的成分。中上臂围和肱三头肌皮褶厚度结合起来可间接反映骨骼肌的容量。近1个月或3个月生长速度是否偏离正常的生长趋势,可反映既往营养状况的稳定性。常用的参考标准有中国2005年九城市青少年儿童的身高、体重标准曲线[14,15],2006年WHO生长发育标准曲线[16],另外,对于唐氏综合征、脑瘫、先天性软骨发育不良等需要参照专有的生长发育量表[17~19]。
近期的膳食摄入情况是营养评价过程中非常有价值的数据,不仅可反映患儿目前的营养状况,还可预测患儿今后营养状况的发展趋势。膳食调查通常采用24 h问卷的形式或者连续3 d膳食回顾等方法。由于膳食调查方法较为复杂且耗时,且对食物摄入量的计算依赖于一定的称量设备,故调查时常需富有经验的营养师参与,若运用得当,可作为评价膳食营养问题的有效方法。
膳食摄入的减少可引起体内代谢的适应性改变,胰岛素分泌减少,胰高血糖素和儿茶酚胺分泌增加,导致糖原和脂肪分解,提供机体代谢所需能量。若饥饿时间超过72 h,胰岛素水平进一步降低,糖原水平下降,机体所必需的葡萄糖主要依赖于糖异生,而该过程需要肌肉不断提供氨基酸前体、脂肪组织提供甘油以及肌肉无糖酵解提供的乳酸盐,因此长期能量摄入不足会导致消耗性消瘦[20,21]。住院患儿因食欲差、进食疼痛、手术前禁食和对医院膳食不满意等原因会出现膳食摄入减少,机体对这种单纯性饥饿就可能出现上述适应性反应,如机体同时还存在疾病导致的其他应激性因素,这种适应性改变将无法起作用。
1.2.2 疾病及其应激性代谢变化 疾病常导致机体产生应激性代谢变化,增加机体能量消耗,从而增加营养风险。而创伤、手术或疾病严重程度的不同,引起的体内代谢变化和营养风险程度也有很大差异。目前国际上关于疾病严重程度的分类尚无统一的标准,国外有关成人疾病严重程度的分级是根据疾病对营养状况的影响以及机体能否从营养支持中获益来制定。欧洲营养学会列举了一些疾病类型作为不同分类的参考[10,11],如重度疾病包括颅脑外伤、骨髓移植和重症监护室患者急性生理学及慢性健康状况评分>10分等;中度疾病包括重大腹部手术、中风、重症肺炎及血液系统恶性肿瘤等;轻度疾病包括股骨骨 折、慢性疾病伴有急性并发症、慢性阻塞性肺病、长期血液透析、糖尿病及肿瘤等。儿科也有类似的疾病严重程度分级,Sermet-Gaudelus等[4]根据美国儿科医师协会及美国饮食营养学会制订了疾病分类,重度疾病包括艾滋病、恶性肿瘤、严重脓毒症、重大手术、多发性外伤、慢性疾病伴有急性恶化和重度抑郁等;中度疾病包括严重但无生命威胁的感染、常规手术、骨折、慢性疾病不伴有急性恶化如炎症性肠病等;轻度疾病包括诊断性操作、无需住院的轻微感染或小手术等。
无论是创伤、手术还是急性感染导致的脓毒症等,其体内导致的应激性代谢变化的过程都类似。总体而言,在应激初期,机体主要以分解代谢为主,肌肉分解加速,机体处于负氮平衡[22],而此时营养支持并不能逆转体内的分解代谢;后期机体进入康复阶段的合成代谢期,表现为食欲增加,蛋白质合成增加,瘦体质和肌肉强度逐渐恢复[23]。对于较大手术、多发性创伤和脓毒症患者,对剧增的分解代谢耐受力则明显减弱,加之医院内感染因素的增加,如胃肠减压管、导尿管和引流管等使黏膜屏障遭到破坏,大量能量消耗和补充不足使其处于营养高风险水平,若不及时进行干预,将导致多器官功能障碍。但需要指出的是,对于多数中小型选择性手术患者,一般均能耐受术后轻至中度的分解代谢和食物摄入不足,安全度过手术关,并在术后短期内得以康复。另外近年来对婴幼儿手术后应激性代谢分析发现,患儿在术后同样会出现高分解代谢,但持续时间相较成人短暂,之后即可回落正常,这可能与婴幼儿在应激性打击后对生长发育方面的能量需求停止,而与手术等应激带来的高分解代谢相抵消有关[24~26]。
1.3 营养风险评分方法学的基本要求[10]理想的营养风险筛查工具不仅能判断患儿住院期间营养风险,而且需具备营养相关的临床结局以及营养治疗效果的预测能力,适合临床工作者简单和快速地操作[10]。另外,不同的评估者对同一受试者的筛查结果差异性越小越好,保证筛查结果的稳定性。
1.3.1 预测度 患儿在住院期间容易发生急、慢性营养不良,最早表现为近期体重不增或下降[27]。Sermet-Gaudelus等[4]在2000年对法国一家医院的胸腹部手术患儿进行营养风险筛查,发现64.5%的患儿在住院期间存在体重丢失,并且营养风险评分越高,患儿住院期间体重丢失的概率越大。Secker等[28]的研究显示营养不良患儿比营养状况良好的患儿术后发生感染性并发症的风险高15%,住院时间平均延长3 d。Kondrup等[11]认为理想的营养风险评估工具应对存在营养风险的患者在接受营养治疗后,可对临床结局的改善情况进行评估,这将成为未来营养风险筛查预测度的研究方向。
1.3.2 稳定性 理想的营养风险筛查工具应避免各个筛查项目出现重复,在推广使用之前,需满足不同筛查者对于同一对象筛查结果的一致性,需要建立在对筛查工具各个项目的详细严格定义和对筛查者规范化培训的基础上。
1.3.3 可操作性 营养风险筛查工具作为入院时的常规筛查工具,应具备方便理解、操作简便、耗时少、安全性高等特点。Sermet-Gauledus等[4]提出的简易儿科营养风险分数以及Secker等[28]提出的主观全面营养评估工具均因操作复杂耗时,故未能在临床推广使用。营养风险筛查工具不仅要适用于临床工作者,患者的依从性也很重要,体现在经济适用、无创等。
1.4 儿科营养风险筛查工具 近10年来,一些针对住院儿童营养风险筛查工具陆续被采用(表1)。McCarthy等[29]在2008年提出并于2010年修正的儿科营养不良评估筛查工具(STAMP),2010年Hulst等[2]发表的营养状况和生长风险筛查工具(STRONGkid)以及Geradimidis等[30]提出的约克郡儿科营养不良筛查(PYMS),这三种儿科营养风险筛查工具临床操作简便、实用性强,均在欧洲一些国家或地区应用。目前,欧洲营养学会推荐使用儿科营养不良评估筛查工具(STAMP)对住院儿童进行营养风险筛查,但该方法的有效性仍有待进一步的临床验证。
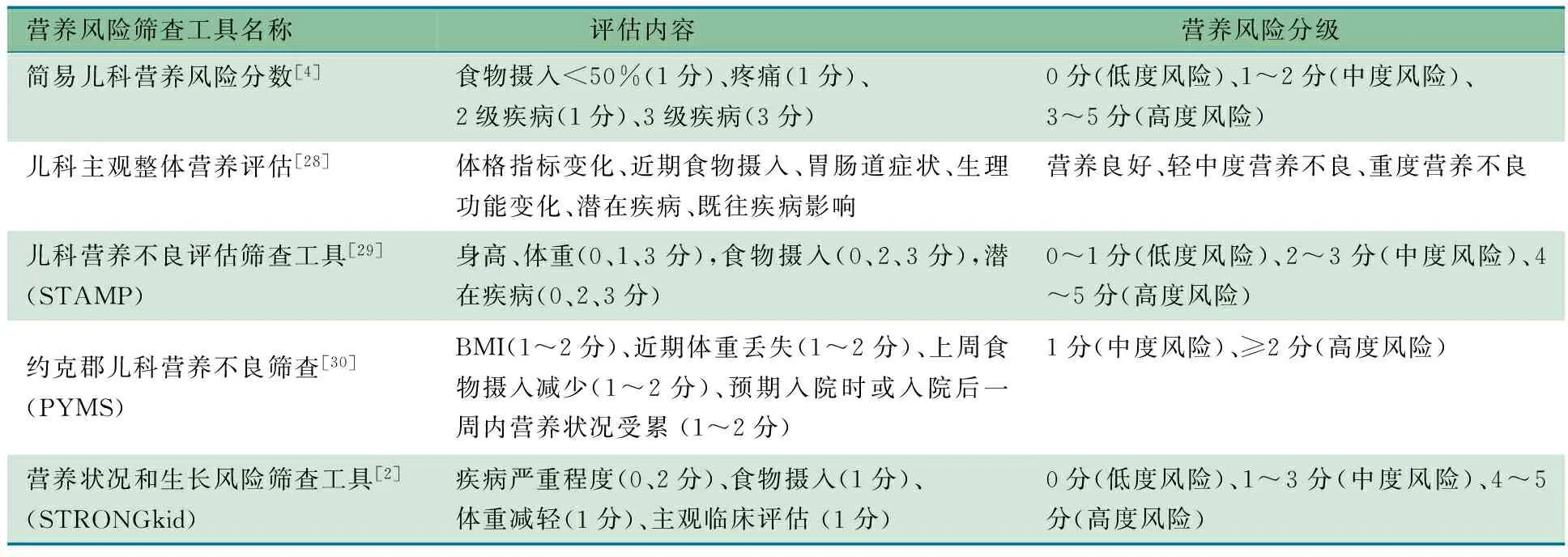
表1 儿科营养风险筛查工具
2 营养治疗与NST
2.1 营养治疗 20世纪60年代,供给营养仅是为了提供能量和蛋白质,因此用了“营养支持(nutrition support)”一词,经过近半个世纪的临床实践,营养支持除能维护氮平衡、保存瘦体质外,更具有免疫调控、减轻氧化应激、降低炎症反应、维护胃肠功能与结构的作用,从而维护细胞、组织器官的功能,促进患者康复,提高生存率,其效应较之初期定义有明显的扩大。2008年Jones等[24]及2009年Martindale等[31]据此认为不宜再称之为“营养支持”,而宜称之为“营养治疗(nutrition therapy)”,营养治疗不仅是疾病治疗的重要组成部分,同时也是临床治疗成功的重要保障。营养治疗依据营养供给途径和供给配方的不同分为肠内营养和肠外营养两大类。
一般营养不良患儿的营养治疗比较容易取得临床效果,而危重患儿因肠道屏障受损、体内高分解代谢和对营养底物的利用不足等因素,使其营养治疗充满了挑战。在危重患儿中,频繁肠内营养的中断、喂养不耐受、液体量的限制或胃肠道运功障碍可导致肠内营养不理想[32~34],而快速的鼻胃管推注常导致胃食管反流,这常与呼吸相关,是肠内营养的主要并发症,可通过慢速、持续的空肠内喂养避免。另外危重患儿因应激性代谢改变的影响,会出现胰岛素抵抗、高血糖及高三酰甘油血症等[34]。在此期间,对危重患儿能量需求的过高估计会导致胆汁淤积、脂肪肝等营养过剩,而估计不足则会加重营养不良,这两种情况都不利于合理的营养治疗计划制定。研究显示通过间接能量代谢仪[35]可精确地估计患者的静息能量消耗(resting energy expenditure,REE),而通过能量预计公式如Scoeffied公式往往高估患者的能量需求[7]。有报道指出,婴幼儿生长发育所需的能量占总能量消耗的1/3,而在危重病期间,婴幼儿生长发育暂停,因此能量消耗也随之降低。危重患儿一旦发生营养不良则非常迅速,故早期积极合理的营养治疗是非常必要的[36]。有证据表明在营养配方中添加免疫营养素如ε-3脂肪酸、谷氨酰胺和精氨酸等可有效调节机体免疫系统活性,改善氮平衡,但尚不能证明这些免疫营养素和预后的关系[37]。
2.2 NST 2002年欧洲国会的一份关于成人患者对医院供餐以及营养护理等现行制度的调查显示,目前医院的临床营养在管理制度上存在严重不足,如一般不进行营养风险筛查和营养状况评估,营养支持更多地用于存在严重营养问题或一些特殊患者,营养管理工作没有分配到相关的责任人等[8],可见一方面医护人员没有认识到营养不良治疗的重要性,也没有建立合理的筛查制度来发现存在营养风险的患者,另一方面营养治疗的应用尚不规范。这一现象在儿科领域更为普遍,基于儿科营养管理的现状,ESPGHAN呼吁在儿科领域成立NST,以“提供疾病儿童科学的营养管理”为宗旨,严格按照营养管理的规范化操作流程以及规章制度,以提高营养治疗质量,促进儿童的临床康复[9]。
2.2.1 NST的组成和工作内容 NST的组成根据机构的类型、团队的工作内容以及工作人员的科室配置而异。除有临床营养知识的儿科医生外,由注册营养师、营养学资格认证的专科护士和注册药剂师组成,必要时还需要儿外科医生进行手术置管(胃造口及空肠造口),以及语言治疗师对经口摄食障碍或口腔咀嚼技能落后患儿进行指导。当然一些团队成员只需贡献出部分工作时间[38]。NST主要的工作内容是对患者进行科学有效的营养管理(图1),而营养风险筛查是营养管理[39]的第一步,对于存在营养风险的患儿还需进行全面的营养评估来判断其是否处于营养不良状态,需综合考虑患儿的食物摄入史,体格检查,身体指标测量和既往营养史、疾病史、用药史、实验室检查等来了解机体的营养状况。在对患者进行营养管理过程中,需注意定期筛查和监测,尤其是重大手术操作、病情恶化或并发症打击时,需对患者的营养状况以及营养需求重新评估,并对营养治疗方案进行调整。
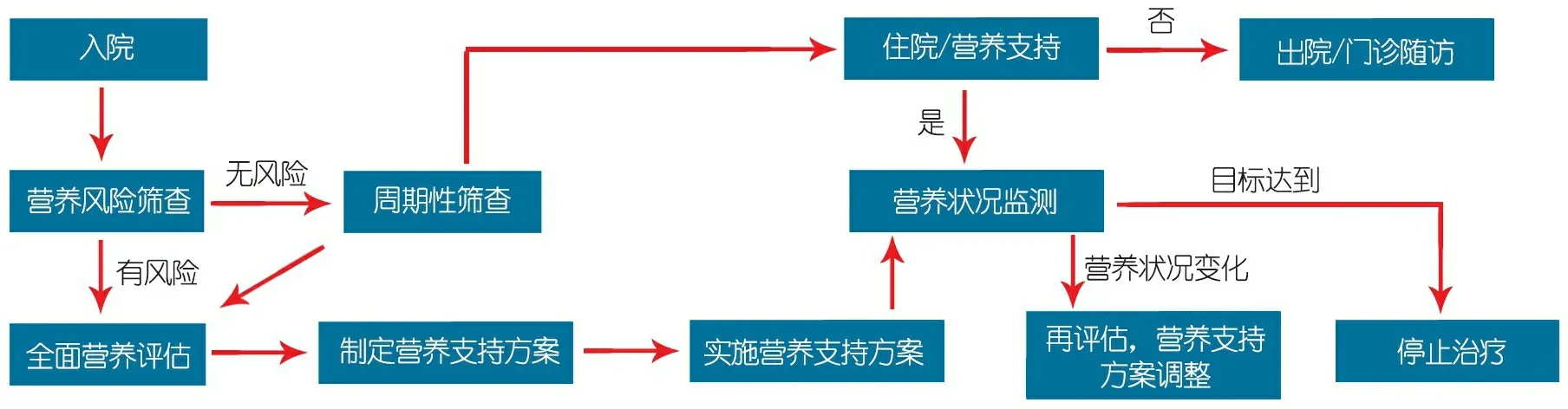
图1 营养管理的工作流程
2.2.2 NST的临床效果 2005年Shang等[40]对德国、奥地利、瑞士的2 071家医院进行标准化问卷调查发现,成立NST使并发症减少了88%,并发症相关支出减少了98%。同时上海儿童医学中心[41]在2007年对NST组织结构和制度政策进行重整,在制度上增加了对所有儿童的营养风险筛查、营养治疗的教学培训,强化了营养支持指南解读,注重内科医生和主治医师在每日查房时的交流,对比重整前的肠外营养相关并发症的发生率由1.4%降至0.45%。蔡威等[42]对上海4家儿童专科医院的2 015例早产儿调查发现,有NST的医院,出院时宫外发育迟缓发生率为44%;无NST的医院,宫外发育迟缓的发生率为62.6%。以上证据表明,NST降低营养治疗并发症主要是通过规范化操作和监测提高了营养治疗的有效性和安全性;此外,对NST成本-效益的分析研究也表明,成立NST是一项效价比较高的临床举措,这主要是NST对住院患者进行营养风险筛查并积极进行营养治疗,降低了并发症的发生率,节约了抗生素额外应用的费用,同时也避免了不必要的营养治疗。
2.2.3 NST的发展现状 20世纪60年代开始,在肠外营养和肠内营养支持开始发展之际,NST也应运而生,经过近半个世纪的发展,但由于各国的政策不同等原因,NST发展水平不一。2008年英国患者预后及死亡调查组织(NCEPOD)对英国国内儿科的调查[43]结果显示,儿科病房中有42%成立了NST,营养支持并发症的监测和处理仍不到位,仅11%的新生儿病房设有NST,28%的新生儿科室对于存在肠外营养支持适应证的患儿没有及时给予肠外营养支持,而近19%的肠外营养支持缺乏相应的监测和评估等。日本和中国台湾医院病房中NST覆盖率几乎达100%,美国教学医院NST的覆盖率也高达80%。
3 问题和展望
目前,中国营养学发展很快,但儿童营养仍有很多问题亟待解决,儿科临床营养规范化远落后于发达国家。至今为止,尚未建立中国住院患儿营养筛查方法,国内很多儿科医师对住院患儿的营养状况以及营养不良造成的消极影响重视不够,常规开展营养风险筛查、营养状况评估以及定期监测的医院寥寥无几,营养不良的发生率尚无数据支持。营养治疗及营养管理的实施也不正规,很多治疗手段仅依靠医生经验而缺乏以循证医学为基础的临床验证资料。而国内对不同营养风险、不同营养状况的患儿进行营养治疗的获益研究也罕见报道。因此,重视住院患儿营养状况并积极推广临床营养观念,借助发达国家对住院患儿营养风险筛查和营养治疗的方法,完善并形成一种适合中国国情和临床应用的儿童营养风险筛查和治疗方法,对改善住院患儿临床结局有重要意义。
[1]Campanozzi A,Russo M,Catucci A,et al. Hospital-acquired malnutrition in children with mild clinical conditions. Nutrition,2009,25(5):540-547
[2]Hulst JM,Zwart H,Hop WC,et al. Dutch national survey to test the STRONG kids nutritional risk screening tool in hospitalized children. Clin Nutr,2010,29(1):106-111
[3]Pawellek I,Dokoupil K,Koletzko B. Prevalence of malnutrition in paediatric hospital patients. Clin Nutr,2008,27(1):72-76
[4]Sermet-Gaudelus I,Poisson-Salomon AS,Colomb V,et al. Simple pediatric nutritional risk score to identify children at risk of malnutrition. Am J Clin Nutr,2000,72(1):64-70
[5]Moy RJ,Smallman S,Booth IW. Malnutrition in a UK children′s hospital,1990
[6]Parsons HG,Francoeur TE,Howland P,et al. The nutritional status of hospitalized children. Am J Clin Nutr,1980,33(5):1140-1146
[7]Tao YX(陶晔璇),Xu YF,Tang QY,et al. Nutrition assessment in hospitalized children. Chinese Journal of Clinical Nutrition(中国临床营养杂志),2007,15(4):214-217
[8]Beck AM,Balknas UN,Camilo ME,et al. Practices in relation to nutritional care and support--report from the Council of Europe. Clin Nutr,2002,21(4):351-354
[9]Agostoni C,Axelson I,Colomb V,et al. The need for nutrition support teams in pediatric units: a commentary by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr,2005,41(1):8-11
[10]Kondrup J,Allison SP,Elia M,et al. ESPEN guidelines for nutrition screening 2002. Clin Nutr,2003,22(4):415-421
[11]Kondrup J,Rasmussen HH,Hamberg O,et al. Nutritional risk screening(NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr,2003,22(3):321-336
[12]Lambe C,Hubert P,Jouvet P,et al. A nutritional support team in the pediatric intensive care unit: changes and factors impeding appropriate nutrition. Clin Nutr,2007,26(3):355-363
[13]Waterlow JC. Classification and definition of protein-calorie malnutrition. Br Med J,1972,3(5826):566-569
[14]Li H(李辉),Ji CY,Zong XN,et al. Height and weight standardized growth charts for Chinese children and adolescents aged 0 to 18 years. Chin J Pediatr(中华儿科杂志),2009,47(7):487-492
[15]Coordinating Study Group of Nine Cities on the Physical Growth and Development of Children Capital Institute of Pediatrics(九市儿童体格发育调查协作组,首都儿科研究所). A national survey on growth of children under 7 years of age in nine cities of China,2005. Chin J Pediatr(中华儿科杂志),2007,45(8):609-614
[16]WHO Child Growth Standards Methods and development,2005
[17]Myrelid A,Gustafsson J,Ollars B,et al. Growth charts for Down′s syndrome from birth to 18 years of age. Arch Dis Child,2002,87(2):97-103
[18]http://www.lifeexpectancy.org/articles/GrowthCharts.shtml
[19]Horton WA,Rotter JI,Rimoin DL,et al. Standard growth curves for achondroplasia. J Pediatr,1978,93(3):435-438
[20]Dulloo AG,Jacquet J. The control of partitioning between protein and fat during human starvation: its internal determinants and biological significance. Br J Nutr,1999,82(5):339-356
[21]Babenkov GI,Gurvich VB,Rudakov II. Letter: Controlled starvation as a biological factor promoting an increase in the adaptive possibilities of the human organism. Kosm Biol Aviakosm Med,1974,8(6):68-72
[22]Coss-Bu JA,Klish WJ,Walding D,et al. Energy metabolism,nitrogen balance,and substrate utilization in critically ill children. Am J Clin Nutr,2001,74(5):664-669
[23]Li JS(黎介寿). 应激病人的代谢与营养支持. J Surg Concepts Pract(外科理论与实践),2000,5(2),70-72
[24]Jones NE,Heyland DK. Implementing nutrition guidelines in the critical care setting: a worthwhile and achievable goal? JAMA,2008,300(23):2798-2799
[25]Nydegger A,Bines JE. Energy metabolism in infants with congenital heart disease. Nutrition,2006,22(7-8):697-704
[26]Tao YX(陶晔璇),Cai W,Tang QY,et al. Study on energy metabolism in perioperative newborns.Chin J Pediatr Surg(中华小儿外科杂志),2005,26(3),113-115
[27]Stratton RJ,Green CJ,Elia M. Disease-related malnutrition: an evidence-based approach to treatment. J Hum Nutr Dirt,2003,16(5):375
[28]Secker DJ,Jeejeebhoy KN. Subjective global nutritional assessment for children. Am J Clin Nutr,2007,85(4):1083-1089
[29]McCarthy H,McNulty H,Dixon M,et al. Screening for nutrition risk in children:the validation of a new tool. J Hum Nutr Dirt,2008,21(4):395-396
[30]Gerasimidis K,Keane O,Macleod I,et al. A four-stage evaluation of the Paediatric Yorkhill Malnutrition Score in a tertiary paediatric hospital and a district general hospital. Br J Nutr,2010,104(5):751-756
[31]Martindale RG,McClave SA,Vanek VW,et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine and American Society for Parenteral and Enteral Nutrition: Executive Summary. Crit Care Med,2009,37(5):1757-1761
[32]Rogers EJ,Gilbertson HR,Heine RG,et al. Barriers to adequate nutrition in critically ill children. Nutrition,2003,19(10):865-868
[33]Mongardon N,Singer M. The evolutionary role of nutrition and metabolic support in critical illness. Crit Care Clin,2010,26(3):443-450
[34]Herman R,Btaiche I,Teitelbaum DH. Nutrition support in the pediatric surgical patient. Surg Clin North Am,2011,91(3):511-541
[35]Firouzbakhsh S,Mathis RK,Dorchester WL,et al. Measuredresting energy expenditure in children. J Pediatr Gastroenterol Nutr,1993,16(2):136-142
[36]Hulst JM,van Goudoever JB,Zimmermann LJ,et al. The effect of cumulative energy and protein deficiency on anthropometric parameters in a pediatric ICU population. Clin Nutr,2004,23(6):1381-1389
[37]Weimann A,Bastian L,Bischoff WE,et al. Influence of arginine,omega-3 fatty acids and nucleotide-supplemented enteral support on systemic inflammatory response syndrome and multiple organ failure in patients after severe trauma. Nutrition,1998,14(2):165-172
[38]Murali B,David T. The role of a hospital nutrition support team. Paediatr Child Health,2011,21(9):389-393
[39]Braegger C,Decsi T,Dias JA,et al. Practical approach to paediatric enteral nutrition: a comment by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr,2010,51(1):110-122
[40]Shang E,Hasenberg T,Schlegel B,et al. An European survey of structure and organisation of nutrition support teams in Germany,Austria and Switzerland. Clin Nutr,2005,24(6):1005-1013
[41]Hong L,Feng Y,Xu J. Positive effect of nutrition support team at Shanghai Children′s Medical Center: 5 years review
[42]Shan HM,Cai W,Cao Y,et al. Extrauterine growth retardation in premature infants in Shanghai: a multicenter retrospective review. Eur J Pediatr,2009,168(9):1055-1059
[43]Ncepod A. Mixed bage an enquiry into care of hospital patients receiving parenteral nutrition 2010

