儿童EB病毒相关噬血细胞淋巴组织细胞增生症NK细胞表面受体和CD107a表达
秦 强 谢正德 刘春艳 黄志卓 王亚丽 张 寒 赵晓曦 申昆玲
在感染相关的继发性噬血细胞淋巴组织细胞增生症(HLH)中,EB病毒相关HLH(EBV-HLH) 占HLH的50%以上,并且有着更差的预后[1~5],且多见于儿童[6]。临床研究证实HLH患者存在不同程度NK细胞活性减低,因而国际组织细胞病协会在HLH诊断标准中将NK 细胞活性减低作为依据之一[1]。有研究[7]显示,78例EBV-HLH患者予免疫治疗,随访43个月,57例(73.1%)存活,免疫治疗的有效性提示了EBV-HLH具有一定的免疫异常基础,并对进一步改善预后提供了可能。本课题组前期研究发现NK细胞免疫球蛋白样受体(KIRs)基因多态性与EBV-HLH的发生相关。为进一步明确EBV-HLH患儿NK细胞表面受体表达及功能是否存在异常,本研究采用配对病例对照研究方法,对EBV-HLH患儿和正常儿童进行NK细胞表面受体表达和功能检测,以期能深入了解EBV-HLH的发病机制。
1 方法
1.1 EBV-HLH诊断标准 符合国际组织细胞协会2004方案中HLH诊断标准[1],同时伴有EBV 感染的证据[8]:①血清学证实有EBV原发感染(抗EBV-VCA-IgM增高)或EBV感染的再激活(早期抗原EBV-EA-IgG或IgA增高);②PCR或Southern blot方法检测到EBV-DNA,血清、骨髓或淋巴结等受累组织中通过原位杂交法检测到EBV编码的RNA(EBER)。
1.2 EBV-HLH组纳入和排除标准 ①首都医科大学附属北京儿童医院(我院)住院患儿;②确诊为EBV-HLH;③未接受过化学免疫治疗;④排除携带家族性HLH(FLH)PRF1、UNC13D、STX11和SH2D1A基因缺陷者。
1.3 正常对照组纳入和排除标准 选取年龄、性别与EBV-HLH组1∶1匹配的我院儿童保健门诊健康查体儿童,排除免疫系统疾病史者(如SLE,川崎病和原发性免疫缺陷病等)。
1.4 伦理和知情同意 本研究经过我院伦理委员会审查通过。所有研究对象在纳入研究前,均获得患儿父母或监护人同意,并签署知情同意书。
1.5 NK细胞表面受体、穿孔素和CD107a表达检测 EBV-HLH组在应用免疫化学治疗前,采集肝素抗凝静脉血4~6 mL,立即送检。正常对照组留取肝素抗凝静脉血4 mL,与EBV-HLH组标本在相同实验室条件下检测。
1.5.1 主要材料和试剂 单克隆荧光标记抗体(NKG2D、DNAM-1、NKP30、NKP46、CD16、2B4和CD48)及相应IgG或IgM同型对照(美国BD公司);红细胞裂解液(美国Beckman公司);破膜剂和穿孔素单克隆抗体Intropep 1和 Intropep 2(美国Beckman公司);穿孔素单克隆抗体及相应同型对照(美国BD公司);流式细胞仪(FACS flow cytometer,BD Biosciences,USA)。
1.5.2 NK细胞表面受体表达检测 流式上样管标记后,分别加入肝素抗凝血100 μL。室温孵育后加入不同抗体组合标记,裂解红细胞,洗脱后采用流式细胞仪定量分析NK细胞表面受体NKp30、NKp46、NKG2D和2B4表达(图1)。
1.5.3 NK细胞穿孔素表达检测 采用细胞膜抗体固定及破膜技术,用NK细胞特异性免疫荧光抗体标记外周血NK细胞细胞膜表面受体和穿孔素,通过流式细胞仪检测,定量分析NK细胞穿孔素的表达(图2)。
1.5.4 NK细胞CD107a表达检测 从肝素抗凝血中提取淋巴细胞,置CO2孵箱中过夜孵育,次日采用K562和P815作为靶细胞体外再激活NK细胞,采用荧光抗体P107a PE标记,通过流式细胞仪检测NK细胞表面CD107a表达(CD107a、CD107a/K562、CD107a/2B4/P815、CD107a/NKG2D/P815和CD107a/2B4/NKG2D/P815),评价NK细胞活性(图3)。
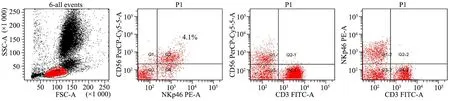
图1 流式细胞仪检测NK细胞NKp46的表达
Fig 1 Surface activating receptor NKp46 expression on NK cells by flowcytometry
Notes The cells both expressed CD56 and NKp46 were considered in Quadrant 2(Q2) and the positive ratio was calculated
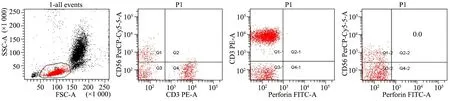
图2 流式细胞仪检测NK细胞穿孔素的表达
Fig 2 Perforin expression on NK cells by flowcytometry
Notes The cells both expressed CD56 and perforin were considered in Quadrant 2-2(Q2-2) and the positive ratio was calculated
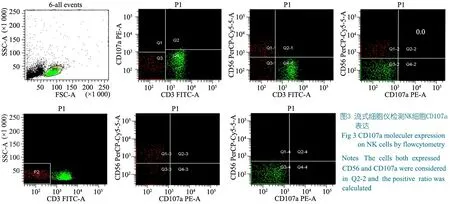
1.5.5 IL-2介入实验 在制备的外周血淋巴细胞中加入IL-2(浓度1 000 IU·mL-1,用量10 μL·mL-1),置于5%CO2孵箱中孵育48 h后再次测定CD107a表达情况,比较IL-2刺激前后CD107a表达变化。
2 结果
2.1 一般情况 2009年8月至2011年5月8例患儿确诊为EBV-HLH,均进行了PRF1,UNC13D,STX11及SH2D1A基因筛查,未见突变。EBV-HLH组和正常对照组的一般情况见表1。
2.2 NK细胞表面受体和穿孔素表达情况 两组在NK细胞表面受体NKp30、NKp46、NKG2D、DNAM-1和2B4表达阳性率、CD56+NK细胞穿孔素表达率和CD8+T细胞穿孔素表达率差异均无统计学意义(表2)。
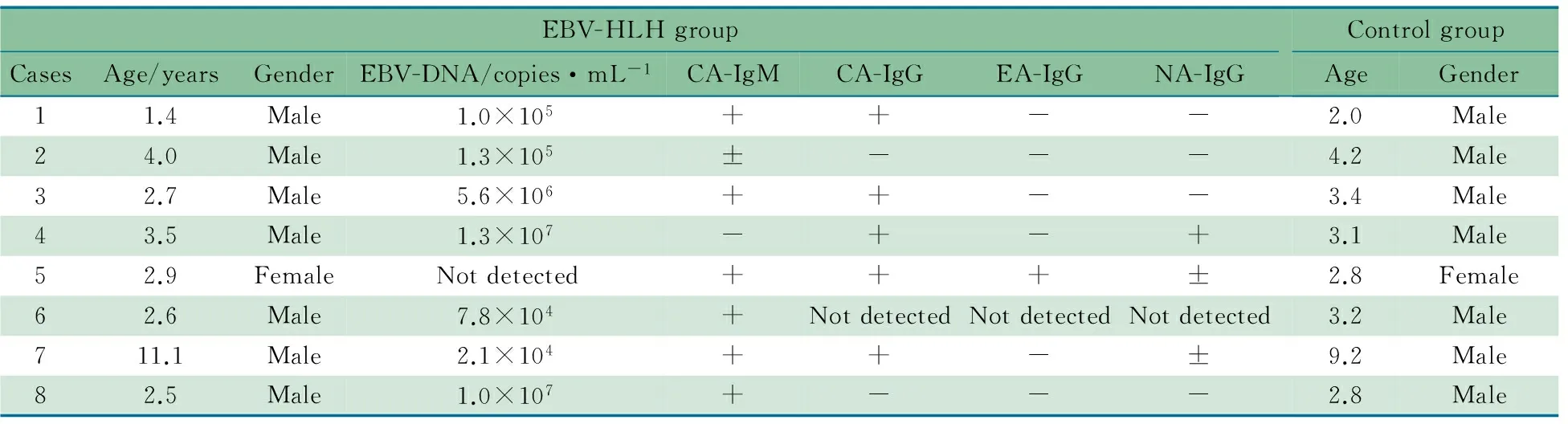
表1 EBV-HLH组和正常对照组的一般情况
Notes "+": positive; "-": negative; "±": probable positive
表2 NK细胞表面受体和穿孔素表达阳性率在EBV-HLH组和正常对照组间的比较[%,M(P25,P75)]
Tab 2 Comparison of positive ratio of surface activating receptors and perforin expressed on NK cells between EBV-HLH group and control group[%,M(P25,P75)]
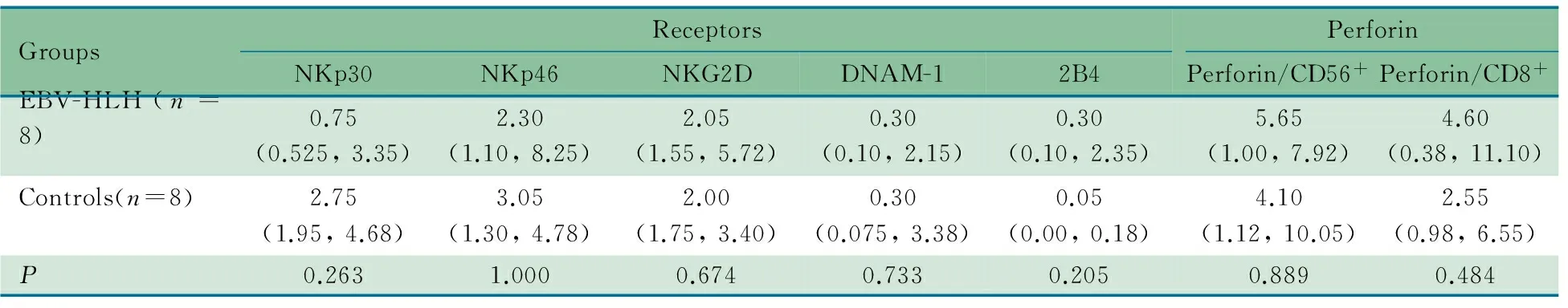
GroupsReceptorsNKp30NKp46NKG2DDNAM-12B4PerforinPerforin/CD56+Perforin/CD8+EBV-HLH(n=8)0.75(0.525,3.35)2.30(1.10,8.25)2.05(1.55,5.72)0.30(0.10,2.15)0.30(0.10,2.35)5.65(1.00,7.92)4.60(0.38,11.10)Controls(n=8)2.75(1.95,4.68)3.05(1.30,4.78)2.00(1.75,3.40)0.30(0.075,3.38)0.05(0.00,0.18)4.10(1.12,10.05)2.55(0.98,6.55)P0.2631.0000.6740.7330.2050.8890.484
2.3 IL-2刺激前后CD107a表达 EBV-HLH组2例患儿因外周血淋巴细胞总数较低,提取的淋巴细胞数量不足以完成IL-2刺激前后CD107a表达测定,予以排除,最终6例EBV-HLH患儿纳入分析。两组在IL-2刺激前CD107a、CD107a/K562、CD107a/2B4/P815、CD107a/NKG2D/P815和CD107a/2B4/NKG2D/P815表达率差异均无统计学意义(表3)。两组在IL-2刺激后,NK细胞CD107a表达差异亦无统计学意义(表3)。
EBV-HLH组在IL-2刺激前后CD107a表达率差异无统计学意义。正常对照组IL-2刺激前后CD107a、CD107a/K562和CD107a/NKG2D/P815表达率差异有统计学意义(表3)。
表3 IL-2刺激前后NK细胞CD107a表达在EBV-HLH组和正常对照组间的比较[%,M(P25,P75)]
Tab 3 Comparison of positive ratio of CD107a expression on NK cells before and after IL-2 stimulation between EBV-HLH group and control group[%,M(P25,P75)]
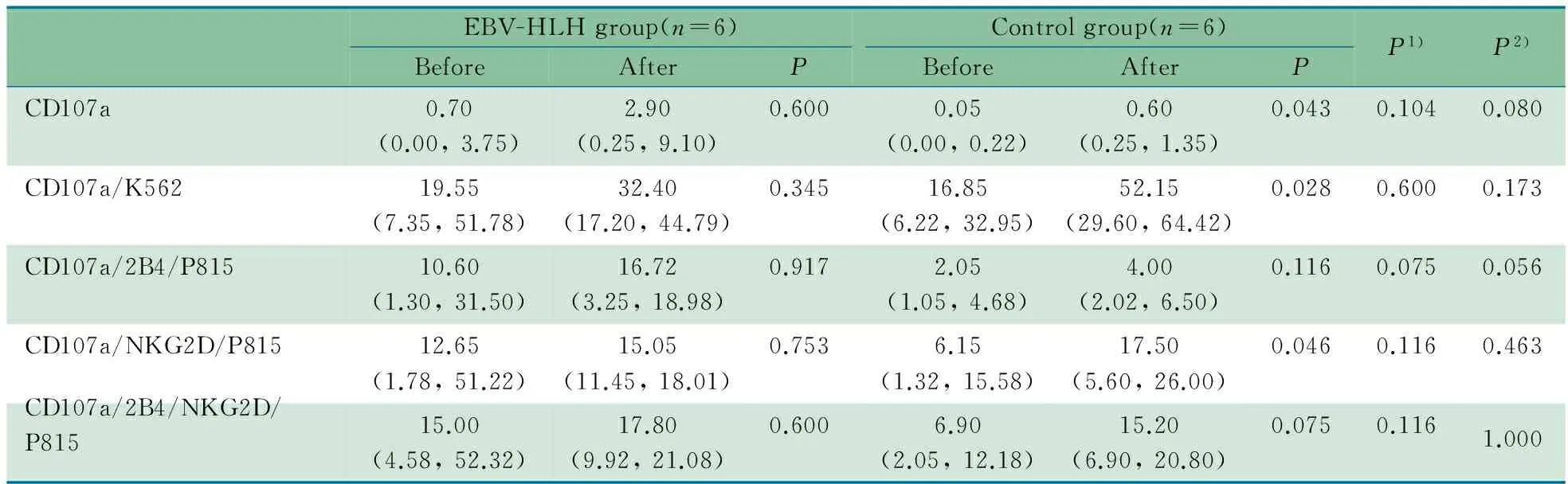
EBV-HLHgroup(n=6)BeforeAfterPControlgroup(n=6)BeforeAfterPP1)P2)CD107a0.70(0.00,3.75)2.90(0.25,9.10)0.6000.05(0.00,0.22)0.60(0.25,1.35)0.0430.1040.080CD107a/K56219.55(7.35,51.78)32.40(17.20,44.79)0.34516.85(6.22,32.95)52.15(29.60,64.42)0.0280.6000.173CD107a/2B4/P81510.60(1.30,31.50)16.72(3.25,18.98)0.9172.05(1.05,4.68)4.00(2.02,6.50)0.1160.0750.056CD107a/NKG2D/P81512.65(1.78,51.22)15.05(11.45,18.01)0.7536.15(1.32,15.58)17.50(5.60,26.00)0.0460.1160.463CD107a/2B4/NKG2D/P81515.00(4.58,52.32)17.80(9.92,21.08)0.6006.90(2.05,12.18)15.20(6.90,20.80)0.0750.1161.000
Notes 1) The comparison before IL-2 stimulation between EBV-HLH and control groups; 2) The comparison after IL-2 stimulation between EBV-HLH and control groups
3 讨论
本研究结果显示,EBV-HLH组和正常对照组间NK细胞表面受体和穿孔素表达率差异无统计学意义,提示EBV-HLH患儿NK细胞功能的异常可能存在着与HLH不同的机制。IL-2刺激后正常对照组CD107a、CD107a/K562和CD107a/NKG2D/P815表达较刺激前显著提高,EBV-HLH组较刺激前差异未见统计学意义。提示EBV-HLH组NK细胞对IL-2的反应出现异常,可能与EBV-HLH的发生有关。
51Cr释放实验是检测NK细胞毒活性的金标准,但51Cr具有半衰期短和放射性等缺点。其他实验如乳酸脱氢酶(LDH)释放法,受其敏感度低的缺点,也未能广泛开展。溶酶体相关膜蛋白-1(LAMP-1或CD107a)是一种高糖基化的蛋白,约占溶酶体膜蛋白的50%[9]。NK细胞杀伤靶细胞时,毒性颗粒将到达浆膜面并与细胞膜融合,引起颗粒内容物释放,最终导致靶细胞的死亡[10]。随着脱颗粒的发生,CD107a分子被转运到细胞膜表面,并且CD107a分子的表达上调与穿孔素的分泌一致[11]。因此,CD107a表达率的变化可以反映NK细胞杀伤活性的改变。
穿孔素受到多种细胞因子的调节,包括IL-2、lL-4、IL-6、IL-7、IL-12和IFN等都能够增加穿孔素表达[12]。穿孔素和颗粒酶的表达降低受TGF-β、感染的迁延、病毒的致病力或肿瘤的影响,从而降低NK细胞的细胞毒作用[13]。有研究表明造血干细胞移植后血清颗粒酶、穿孔素水平的升高与CMV感染有明显的相关性,其升高的水平不仅可预测CMV的发生,还可以评估抗CMV的治疗[14,15]。但目前尚没有EBV感染后相关研究的报道,本研究中,EBV-HLH组在CD56+NK细胞和CD8+T细胞中穿孔素的表达和正常对照组间未发现显著差异。因此,参照同属于疱疹病毒科的CMV的研究结果[14,15],推测如EBV-HLH患儿穿孔素表达异常,除进行基因筛查排除遗传因素外,应注意其对常规治疗的反应,是否能成为临床预后较差的指标,还有待于进一步大样本的研究结果。
IL-2作用的靶细胞包括CD4+T细胞、CD8+T细胞、NK细胞和B细胞,可以引起效应T细胞和B细胞的克隆性扩增。同时IL-2可促进NK细胞的增殖和分化,增强其细胞毒杀伤作用。本研究EBV-HLH组在IL-2的刺激下,NK细胞CD107a、CD107a/NKG2D表达率未见显著变化,与正常对照组不一致,从而不能正常的杀伤受EBV感染的细胞,导致感染的持续存在及机体免疫系统的持续激活。这同时也能解释部分EBV感染患儿在没有明显免疫缺陷或基因缺陷的情况下,发生噬血现象的原因。
Marcenaro等[16]在对FLH的研究中发现,从FHL2型(PRF基因缺陷)和FHL3型(MUNC13-4基因缺陷)患者中分离的NK细胞,在经过体外培养和IL-2刺激后,FHL3型组对K562靶细胞的杀伤作用明显降低。进一步研究提示,NKp30、NKG2D、2B4、CD16等表面受体表达也存在差异。但本研究发现,EBV-HLH组NKp30、NKp46等表面受体及穿孔素表达与正常对照组差异无统计学意义,提示EBV-HLH的发病机制与FHL存在不同,需要进一步研究。
本研究的不足之处和局限性:①由于EBV-HLH发病机制不清,临床诊断困难,且入选病例需要未经过化疗的患儿,病例来源较少。②由于实验步骤较多,受外界因素影响较大,尽管每检测1例患儿,同时都会选取1例相匹配的正常对照,尽量做到条件一致,但外周血单核细胞计数差别较大,而实验所添加的抗体的量是一致的,使数据离散度较大。③本研究未设立单纯EBV感染组,对于NK细胞活性的改变是由EBV所致、HLH所致抑或是EBV和HLH的共同作用无法更确切地说明。
[1]Henter JI,Horne AC,Aricó M,et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistio-cytosis. Pediatr Blood Cancer,2007,48(2):124-131
[2]Stadt U,Beutel K,Kolberq S,et al. Mutation spectrum in children with primary hemophagocytic lymphohistiocytosis: molecular and functional analyses of PRF1,UNC13D,STX11,and RAB27A. Hum Mutat,2006,27(1):62-68
[3]Rouphael NG,Talati NJ,Vaughan C,et al. Infections associated with haemophagocytic syndrome. Lancet Infect Dis,2007,7(12):814-822
[4]Ishii E,Ohga S,Imashuku S,et al. Nationwide survey of hemophagocytic lymphohistiocytosis in Japan. Int J Hematol,2007,86(1):58-65
[5]Jin YK,Xie ZD,Yang S,et al. Epstein-Barr virus-associated hemophagocytic lymphohistiocytosis: a retrospective study of 78 pediatric cases in mainland of China. Chin Med J,2010,123(11):1426-1430
[6]Su IJ. Perspectives on the pathogenesis and therapy of hemophagocytic syndrome. J Formos Med Assoc,2008,107(4):277-280
[7]Imashuku S,Teramura T,Tauchi H,et al. Longitudinal follow-up of patients with Epstein-Barr virus-associated hemophagocytic lymphohistiocytosis. Haematologica,2004,89(2): 183-188
[8]Imashuku S. Clinical features and treatment strategies of Epstein-Barr virus-associated hemophagocytic lymphohistio-cytosis. Crit Rev Oncol Hematol,2002,44(3):259-272
[9]Kannan K,Stewart RM,Bounds W,et al. Lysosome-associated membrane proteins h-LAMPl(CD107a) and h-LAMP2(CD107b) are activation-dependent cell surface glycoproteins in human peripheral blood mononuclear cells which mediate cell adhesion to vascular endothelium. Cell Immunol,1996,171(1):10-22
[10]Lettau M,Schmidt H,Kabelitz D,et al. Secretory lysosomes and their cargo in T and NK cells. Immunol Lett,2007,108(1):10-19
[11]Alter G,Malenfant JM,Altfeld M,et al. CD107a as a functional marker for the identification of natural killer cell activity. Immunol Methods,2004,294(1):15-22
[12]Yu CR,John R. Role of a STAT Binding Site in the Regulation of the Human Perforin Promoter. J Immunol,1999,62(5):2785-2790
[13]Chochi K,Ichikura T,Majima T,et al. The increase of CD57+T cells in the peripheral blood and their impaired immune functions in patients with advanced gastric cancer. Oncol Rep,2003,10(5):1443-1448
[14]Jakson M,Remberger M,Mattsson J. Increased immune transcript levels are correlated with acute graft-versus host disease and cytomegalovirus response after allogeneic stem cell transplantation. Transplantation,2004,77(2):195-200
[15]Kircber B,Sehumaeher P,Nachbaur D. Granzymes A and B serum levels in allo-HSCT. Bone Marrow Transplant,2009,43(10):787-791
[16]Marcenaro S,Gallo F,Martini S,et al. Analysis of natural killer-cell function in familial hemophagocyticlymphohistiocytosis(FHL): defective CD107a surface expression heralds Munc13-4 defect and discriminates between genetic subtypes of the disease. Blood,2006,108(7):2316-2323

