印尼热泉中产嗜热碱性蛋白酶菌株筛选及酶学性质研究*
王 帅,林学政,黄晓航,郑 立,ZILDA Dewi Seswita
(1.国家海洋局第一海洋研究所 海洋生物活性物质重点实验室,山东 青岛266061;2.印度尼西亚海洋与渔业研究局 海洋生物技术与水产品加工研究中心,雅加达999006)
印尼热泉中产嗜热碱性蛋白酶菌株筛选及酶学性质研究*
王 帅1,林学政1,黄晓航1,郑 立1,ZILDA Dewi Seswita2
(1.国家海洋局第一海洋研究所 海洋生物活性物质重点实验室,山东 青岛266061;2.印度尼西亚海洋与渔业研究局 海洋生物技术与水产品加工研究中心,雅加达999006)
采用MSM寡营养培养基从印度尼西亚Pantai cermin,Kalianda和Banyuwedang三个地区的热泉水样、泥样以及沉积物样品中分离获得细菌菌株,通过检测蛋白酶产生透明圈和福林酚蛋白酶活性测定相结合的方法,从中筛选出1株产嗜热蛋白酶的菌株PBI,该菌株经初步鉴定为短杆菌属(Brevibacillus),并对其酶学性质进行了研究。结果表明,菌株PBI产蛋白酶的最适酶活温度为60℃,最适pH值为8.0~9.0,具有较好的热稳定性和pH稳定性,60℃时酶的半衰期为30min,70℃条件下20min仍保持46.1%的酶活,该酶在pH值为5.0~9.0范围的缓冲液中酶活相对稳定。其产嗜热蛋白酶的酶活力最高可达到60.53U/mL,在100℃条件下仍能保留26.37%的相对酶活。Fe2+,Fe3+,Cu2+和Zn2+对嗜热蛋白酶活性具有明显的抑制作用。该嗜热蛋白酶对EDTA敏感,苯甲基磺酰氟(PMSF)、亮抑酶肽(Leupeptin)、苄眯(Benzamidine)和胃蛋白酶抑制剂(Pepstain A)对该嗜热蛋白酶都有一定的抑制作用,说明其酶活性受到丝氨酸、半胱氨酸残基的影响。结果表明,该菌株是1株具有进一步改造利用价值的产蛋白酶菌株。
热泉;嗜热细菌;嗜热蛋白酶;鉴定
(王佳实 编辑)
近年来,嗜热菌已成为人们日益重视并利用的微生物资源,其合成的多种耐热酶系具有巨大的潜在应用价值。自1879年米奎尔(P.Miquel)从法国塞纳河中分离到能在70℃条件下生长的杆菌以来,人们就在各种各样的高温环境——尤其是热泉中,开展了嗜热菌的研究工作[1-3]。一般认为在55℃以上的环境中生长的微生物称为嗜热菌,包括处于系统进化树底部的部分细菌和古菌,其中最适生长温度在80℃以上的称为极端嗜热菌,其大部分是嗜热古菌[4]。嗜热酶是从嗜热微生物中分离得到的一类热稳定性酶,这种酶蛋白的重要特征就是只有在极高温度下才不可逆变性失去催化活性,从而提高了底物和产物的溶解性,加快催化反应速率,残留生物固形物浓度很低,同时还可以降低染菌的可能性。嗜热蛋白酶由于其显著的耐热性及其对有机溶剂、去污剂和变性剂等具有较强的抗性,所以,可有效地应用于需高温条件的工业生产中,取代传统的常温酶催化或化学催化方法,为在食品加工、医药制品、废水处理、皮革加工、造纸等诸多方面优化工艺流程开辟出新的途径,因此已成为酶学领域研究的热点之一[5-6]。这样看来,对于嗜热蛋白酶的研究就显得更为必要和迫切。
蛋白酶是一种主要作用于蛋白质和多肽,催化肽键水解的酶,在工业生产中具有非常重要的作用。微生物是蛋白酶重要的来源之一,微生物来源的蛋白酶一般属于胞外酶,较动植物来源的蛋白酶易于分离纯化。许多嗜热菌(细菌、真菌、古菌和放线菌等)均可以产生胞外嗜热蛋白酶,人们从脂肪嗜热芽孢杆菌[7-8](Bacillusstearothermophilus),短小芽孢杆菌[9](Bacilluspumilus),枯草芽孢杆菌[10](Bacillussubtilis),莫哈韦芽孢杆菌[11](Bacillusmojavensis),芽孢杆菌[12](Bacillussp.JB-99),Fervidobacteriumpennivorans[13],掘越氏火球菌[14](Pyrococcushorikoshii),嗜热芽孢杆菌[6](Thermophilicbacillus),水生嗜热菌[15](Thermosaquaticus),Thermoplasmaacidphilum[16],嗜热栖热菌[17](Thermusthermophilus)和热厌氧杆菌[18](Thermoanaerobacteryonseiensis)等嗜热菌中分离得到各种类型的嗜热蛋白酶。如Huang等[6]对嗜热枯草杆菌HS08(Thermophilicbacillusstrain HS08)中性嗜热蛋白酶的纯化及酶学性质研究发现,所得蛋白酶在40~65℃间均具有较好的热稳定性,于65℃下反应1h后仍可保留75%的酶活力;从掘越氏热球菌(PyrococcushorikoshiiOT3)中分离到最佳活性温度为90℃,最适pH为8.0的1种Zn2+依赖性金属蛋白酶,兼有羧肽酶和氨基酰化酶的双功能蛋白酶[14];张燕新等[19]报道,从云南温泉分离到3株产蛋白酶的嗜热菌SB11、SB31和SC5,属于土芽孢杆菌属(Geobacillus),其蛋白酶活力分别为35.6,26.1和26.6U/mL,最适生长温度为60℃,最适pH为6.0,其中菌株SB31的蛋白酶最适酶反应温度高达80℃,远高于一般动植物来源的蛋白酶。目前,国内关于嗜热菌的研究开展的工作还远远不够,对于印度尼西亚热泉地区的嗜热菌资源的研究至今还未见报道。
本研究室从印度尼西亚3个地区的热泉地区样品中筛选嗜热菌菌株并进行分离纯化,在获得可培养嗜热菌菌株的基础上,通过MSM寡营养盐培养基平板法复筛,获得1株产嗜热蛋白酶菌株PBI,研究发现PBI于55℃下培养72h,其产蛋白酶的酶活力最高可达60.53U/mL,同时对微生物的多样性和嗜热蛋白酶的分类和酶学性质进行了研究,为今后嗜热菌及其酶的开发利用积累资源。
1 材料与方法
1.1 样品来源
样品为印度尼西亚Pantai cermin,Kalianda和Banyuwedang三个地区的热泉水样、泥样以及沉积物样品,将采集的水样、泥样、沉积物样品装入无菌容器中,充氮后于4℃下保存。3个地区热泉的地点和水温分别为:5°37′59″N,105°04′20″E,95~97℃;5°41′50″N,105°36′15″E,62~65 ℃;8°10′38″N,114°35′26″E,44.8~46℃左右。
1.2 方 法
1.2.1 培养基制备
MSM 培养基(Minimal Synthetic Medium):0.1%K2HPO4;0.01%MgSO4·7H2O;0.1%NaCl;0.7% (NH4)2SO4;0.05%酵母粉;1.5%琼脂,1%脱脂奶粉。
1.2.2 菌体的获得和纯化
采集的水样取100μL直接涂布平板,泥样用灭菌海水浸泡、静置后取100μL涂布平板,55℃培养2~3d,观察菌落形态。菌体通过平板划线法进行分离和纯化,获得具有透明圈的菌株。为了得到纯菌落,分离纯化步骤至少进行3次,通过革兰氏染色、镜检及16SrDNA基因测序鉴定获得纯培养菌株,编号后接入斜面保存。
1.2.3 细菌16SrDNA基因的PCR扩增和产物纯化
提取细菌基因组DNA的试剂盒采用酵母基因组DNA提取试剂盒(TIANamp Yeast DNA Kit),由北京天根生物技术有限公司提供。菌株PBI的分子鉴定与系统发育分析中DNA模板的制备、16SrDNA的PCR扩增与序列测定以及系统进化关系的分析均按照林学政等[20]进行。
1.2.4 粗酶液制备
将菌株PBI种子液按1%的接种量接种于含50mL MSM培养基的150mL锥形瓶中,在55℃,150r/min的培养条件下振荡培养72h后,取12 000g离心15min后取上清,即为粗酶液。
1.2.5 嗜热蛋白酶活性检测
采用紫外分光光度-Folin酚法测定蛋白酶粗酶液的酶活。酶活力单位的定义:在40℃,pH值为7.5的条件下,每分钟催化酪蛋白水解产生1μg酪氨酸所需液体酶的酶量为1个活力单位(U/mL)。
1.2.6 酶学性质研究
1.2.6.1 蛋白酶的温度耐受性以及热稳定性
取500μl酶液置于2mL离心管中,将500μL质量分数为2%的酪蛋白溶液作为底物,加入1mL 0.4 mol/L的三氯乙酸(TCA)终止酶反应,并用Folin酚法测定蛋白酶粗酶液的酶活。将酶液在不同的温度下(40,50,60,70,80,90,100 ℃)进行实验,分别保温10,20,30,40,50,60,120,180min后,加入过量0.4mol/L三氯乙酸终止反应,12 000g离心15min,测定酶活,以最大酶活性作为相对酶活性100%,以剩余的酶活性作为评价酶热稳定性的指标。
1.2.6.2 蛋白酶的pH耐受性以及pH稳定性
以质量分数为2%的酪蛋白溶液作为底物,用Folin酚法测定蛋白酶粗酶液的酶活。不同的pH缓冲体系:Na2HPO4-柠檬酸,pH 5.0~7.0;Tris-HCl,pH 7.0~9.0;Glycine-NaOH,pH 9.0~12.0。将500μL酶液与不同pH缓冲液调整pH后的酪蛋白溶液反应,分别于10,20,40,60,80min后测定酶活,以最大酶活性作为相对酶活性100%,以剩余的酶活性作为评价酶pH稳定性的指标。
1.2.6.3 金属离子和蛋白酶抑制剂对酶活性的影响
在蛋白酶与底物的反应体系中,加入不同的金属离子(Ca2+,Mg2+,Mn2+,Fe2+,Fe3+,Cu2+,Zn2+,Ba2+,Sr2+),使其终浓度分别为5mmol/L和10mmol/L;加入蛋白酶抑制剂(EDTA,苯甲基磺酰氟PMSF,亮抑酶肽Leupeptin,胃蛋白酶抑制剂Pepstain A和苄眯Benzamidine)终浓度分别为0.5mmol/L和1 mmol/L,以不加任何金属离子和蛋白酶抑制剂的酶活为100%,检测其剩余酶活。
2 结 果
2.1 菌株的分离纯化
将印度尼西亚Pantai cermin、Kalianda和Banyu wedang 3个地区的热泉水样、泥样以及沉积物样品在MSM培养基中经培养、分离和纯化后获得的菌株,用牙签点到筛选平板上,在55℃条件下静置培养1~2d,菌株PBI能在MSM寡营养盐培养基平板上产生清晰可见的透明圈,透明圈直径和菌落直径的比值为6.4。
2.2 菌株的鉴定
2.2.1 菌株的形态学鉴定
革兰氏染色呈蓝紫色,为革兰氏阳性菌,此菌平板培养菌落近圆形,边缘整齐,不透明,表面光滑无褶皱。显微镜镜检菌株为短杆状,大小为(1~2)×(4~7)μm。
2.2.1 菌株鉴定
将测序结果在GenBank中进行Blast比对,菌株PBI所测得的16SrDNA序列与短杆菌属Brevibacillusborstelensisstrain Mq-17(GU201855)的16SrDNA序列同源性为1375/1375(100%)。因此,鉴定该菌株为短杆菌属菌株(Brevibacillus),命名为PBI,此菌株的16SrDNA序列已上传到GenBank上,序列号为HQ166187。
2.3 培养时间对酶活力的影响
由图1可见,菌株PBI在MSM培养基中生长12h进入对数期,培养液上清液中开始检测到少量嗜热蛋白酶活力,进入到稳定期后酶活力迅速上升,至48h后产酶量趋于稳定,嗜热短杆菌PBI蛋白酶产量与菌株生长具有正相关关系(24~60h)。产嗜热蛋白酶的酶活力最高达到60.53U/mL。

图1 时间对菌株PBI酶活的影响Fig.1 Effects of time on enzyme activity of strain PBI
2.4 温度和pH值对酶活力的影响
以酪蛋白为底物,在不同温度(40~100℃,pH7.5)和不同pH 值(pH5.0~12.0,55℃)条件下测定酶活力,结果见图2~3,由图可见,该嗜热蛋白酶的最适反应温度为60℃,最适反应pH值为8.0~9.0。

2.5 酶的热稳定性
将酶样品分别置于不同温度保温,按一定时间间隔取样测定酶活力。由图4可见,该嗜热蛋白酶在一定温度范围内热稳定性较好,在60℃保温10min后酶活力下降幅度很小,随着温度升高,酶的热稳定性下降,60℃时酶的半衰期为30min,70℃条件下20 min仍保持46.1%的酶活。
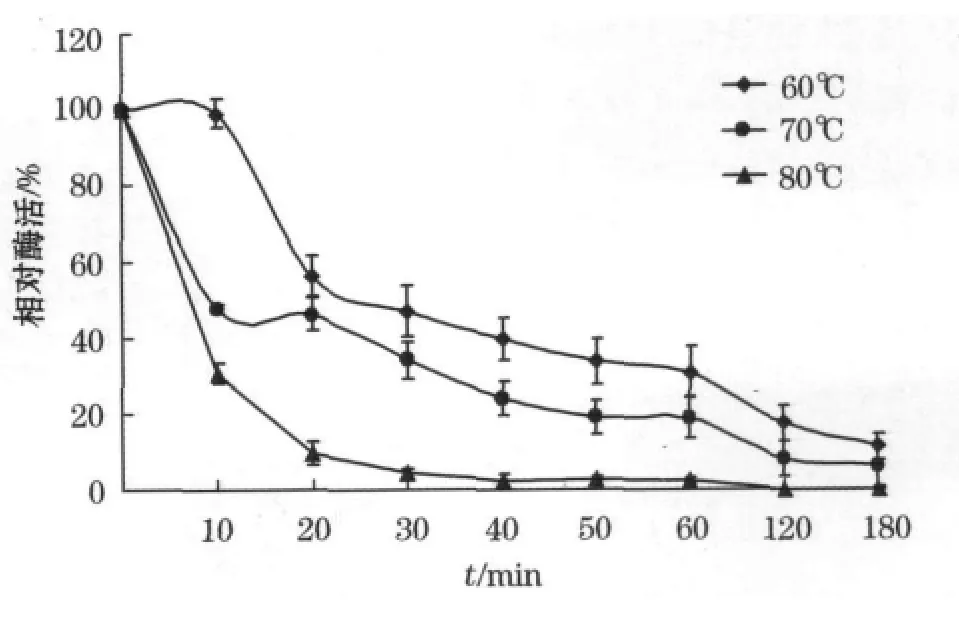
图4 酶的热稳定性Fig.4 Effects of temperature on enzyme stablity

图5 酶的pH稳定性Fig.5 Effects of pH on enzyme stablity
2.6 pH值对酶稳定性的影响
将适量酶液与不同pH值缓冲液混合调整pH值,取500μL于60℃条件下保温一定时间后,按标准方法测定酶活力。由图5可见,在60℃条件下,该酶在pH值为5.0~9.0范围的缓冲液中相对酶活差别不大,说明在这个pH值范围酶活相对稳定,随着时间的延长,酶活力逐渐下降,至80min时最大酶活已降低到不足20%。在强碱性(pH 值分别为10.0,11.0,12.0)条件下分别保温20,40,60,80min后,相对酶活有明显降低,并且随着pH值的增大,下降的幅度也越来越大。
2.7 金属离子对酶活性的影响
本实验研究了Ca2+,Mg2+,Mn2+,Fe2+,Fe3+,Cu2+,Zn2+,Ba2+和Sr2+等金属离子对PBI菌株产嗜热蛋白酶活性的影响,在酶液中分别加入5mmol/L和10mmol/L不同种类的金属离子溶液,依标准方法测定蛋白酶活力,结果见表1。可以看出,低浓度Fe2+(5mmol/L)对酶的活性几乎没有影响,但随着浓度的增加,Fe2+的浓度为10mmol/L时,酶的相对活性仅剩余10%左右。Fe3+,Cu2+和Zn2+对嗜热蛋白酶有较强的抑制作用,当3种金属离子浓度为5mmol/L时,相对酶活性分别仅剩余64.23%,51.20%和46.15%,当离子浓度达到10mmol/L时几乎可使蛋白酶活性完全被抑制,其余几种金属离子也存在着一定的抑制作用。

表1 金属离子对嗜热蛋白酶活性的影响Table 1 Effect of metal ion on thermophilic protease activity
2.8 酶抑制剂对酶活性的影响
本实验研究了蛋白酶抑制剂(EDTA、苯甲基磺酰氟PMSF、亮抑酶肽Leupeptin、胃蛋白酶抑制剂Pepstain A和苄眯Benzamidine)等对PBI菌株所产嗜热蛋白酶活性的影响,在酶液中分别加入0.5mmol/L和1.0mmol/L不同种类的蛋白酶抑制剂,依标准方法测定蛋白酶活力。由表2可见,该嗜热蛋白酶对EDTA敏感,该酶可能是金属离子蛋白酶。苯甲基磺酰氟(PMSF)、亮抑酶肽(Leupeptin)和苄眯(Benzamidine)对该嗜热蛋白酶都有一定程度的影响。

表2 蛋白酶抑制剂对嗜热蛋白酶活性的影响Table 2 Effect of protease inhibitor on thermophilic protease activity
3 讨 论
在本实验中,为了使培养的细菌具有多样性,我们尽量使培养条件接近于其自然环境,除保证温度、湿度外,用其生境的水样经高温消毒后配制培养基,从而保证菌体正常生长,同时采用MSM培养基进行菌株筛选,与LB、2216E培养基相比,降低了其中营养成分浓度以协调因成分过于充足导致优势菌株占据更多的生态位,应用这一方法我们分离到69株嗜热菌,并从中筛选得到6株产嗜热蛋白酶的菌株。
高温微生物具有独特的基因类型、特殊的生理机制及特殊的代谢产物,具有很高的研究价值。有关嗜热蛋白酶产酶条件及酶学性质的研究已有不少,但研究结果有所差异。Qasim和Rani[11]对摩加夫芽孢杆菌(Bacillusmojavensis)进行研究,其产生的碱性嗜热蛋白酶具有较强抗氧化性,最适温度和最适pH值分别为60℃和10.5,在pH值为7.0~11.5的范围内持续48h仍具有良好的稳定性,当温度在60℃,65℃和70℃条件下,半衰期分别为150,15和7min,不受金属离子的影响。Adinarayana等[21]从BacillussubtilisPE-11分离得到丝氨酸属耐高温碱性蛋白酶,最适温度为60℃,最适pH值为10.0,添加10mmol/L浓度的Ca2+有助于提高其温度稳定性。陈启和等[22]从芽孢杆菌属(Bacillussp.EL3)菌株中分离得到1种弹性蛋白酶,最适作用温度和pH值分别为50℃和7.4,该酶在40℃以下保温30min酶活仍较高,在60℃以上酶活全部丧失。在pH值为7.4~9.0的范围内比较稳定,而在pH7.0以下时,酶活下降很快。Cu2+、Zn2+、Al3+能抑制蛋白酶的活性,而Fe3+、Li2+能激活弹性蛋白酶活性,螯合剂EDTA则严重抑制蛋白酶活性。本研究从印度尼西亚热泉样品中分离到1株嗜热蛋白酶产生菌PBI,经培养特征观察和16SrDNA序列分析鉴定,该菌株鉴定为短杆菌属(Brevibacillus),并对其产酶条件及酶学性质进行研究。结果表明,菌株PBI的最适酶活温度为60℃,最适pH值为8.0~9.0,具有较好的热稳定性和pH稳定性,其产嗜热蛋白酶的酶活力最高可达60.53U/mL,60℃和70℃时酶的半衰期分别为30min和10min,在100℃条件下仍能保留26.37%的相对酶活。低浓度Fe2+能增强嗜热蛋白酶的活性,而Fe3+,Cu2+和Zn2+对嗜热蛋白酶活性具有明显的抑制作用,Ca2+的添加未增强酶活性。EDTA可明显抑制酶活性,这说明该酶可能是羧肽酶A/B,而且EDTA是金属离子螯合剂,可螯合酶蛋白的辅基金属离子,因此该蛋白酶酶活性可能受金属离子影响。苯甲基磺酰氟(PMSF)、亮抑酶肽(Leupeptin)和苄眯(Benzamidine)对该嗜热蛋白酶都有一定程度的影响,这可能是抑制剂与酶活性中心以外的丝氨酸、半胱氨酸残基作用而引起酶空间结构发生一定程度改变而影响了酶活力,但2种氨基酸残基应该没有处于该酶的活性中心。胃蛋白酶抑制剂(Pepstain A)使嗜热蛋白酶的活性降低则说明该蛋白酶有一部分是酸性蛋白酶,并且对酶活具有一定抑制作用。
目前,新分离获得的嗜热和极端嗜热微生物的数量正在不断增加,所发现的相关嗜热酶证明在该领域具有巨大潜力[23-24]。嗜热蛋白酶能抵抗碱性及阳离子或非离子表面活性剂,可用于厨房洗涤剂,热稳定的蛋白酶极易耐受这种碱性条件及60℃的温度。在嗜热酶催化的反应条件下(超过70℃),对反应器冷却系统的要求标准降低,减少了能耗,生产中不需要冷却装置,节省了开支,降低了冷却过程中对环境所造成的污染,同时因反应中很少有杂菌生存,可以大大减少各种代谢物对产物的污染[25]。
(References):
[1]RUAN L W,LIU X,YANG H J,et al.Isolation and identification of thermophilic microorganisms[J].Journal of Xiamen University(Natural Sci),2006,45(2):276-279.阮灵伟,刘欣,杨海杰,等.嗜热菌分离筛选及分子分类初探[J].厦门大学学报:自然科学版,2006,45(2):276-279.
[2]PENG Y L,HE P Q,HUANG X H,et al.Isolation,identification and study ofHalomonassp.YD-7from deep-sea hydrothermal vent in Indian ocean[J].Advances in Marine Science,2009,27(3):367-375.彭亚林,何培青,黄晓航,等.印度洋深海海热液区一株盐单胞菌Halomonassp.YD-7的分离鉴定及研究[J].海洋科学进展,2009,27(3):367-375.
[3]LIU Y,HUANG X H,HE P Q,et al.Molecular identification and phylogenetic analysis of cultivable bacteria from Indian ocean hydrothermal vents[J].Advances in Marine Science,2009,27(2):193-200.刘艳,黄晓航,何培青,等.印度洋深海热液区可培养细菌的分子鉴定与系统发育分析[J].海洋科学进展,2009,27(2):193-200.
[4]HE Z Z,PENG Q,CHEN J Y.The thermophiles biology[M].Beijing:Science Press,2000,1-234.和致中,彭谦,陈俊英.高温菌生物学[M].北京:科学出版社,2000,1-234.
[5]WU J,BIAN Y,TANG B,et al.Cloning and analysis of WF146protease,a novel thermophilic subtilisin-like protease with four inserted surface loops[J].FEMS Microbiology Letters,2004,230(2):251-258.
[6]HUANG G R,YING T J,HUO P,et al.Purification and characterization of a protease fromThermophilicbacillusstrain HS08[J].African Journal of Biotechnology,2006,5(24):2433-2438.
[7]SOOKKHEO B,SINCHAIKUL S,PHUTRAKUL S,et al.Purification and characterization of the highly thermostable proteases fromBacillusstearothermophilusTLS33[J].Protein Expression and Purification,2000,20:142-151.
[8]TANG B,ZHOU L F,CHEN X D,et al.Production and some properities of a thermophilic protease fromBacillusstearothermophilusWF146[J].Acta Microbiologica Sinica,2000,40(2):188-192.唐兵,周林峰,陈向东,等.嗜热脂肪芽孢杆菌高温蛋白酶的产生条件及酶学性质[J].微生物学报,2000,40(2):188-192.
[9]KUMAR C G.Purification and characterization of a thermostable alkaline protease from alkalophilicBacilluspumilus[J].Letters in Applied Microbiology,2002,34(1):13-17.
[10]ZHANG M,ZHAO C,DU L X,et al.Molecular cloning of a thermostable neutral protease gene fromBacillusstearothermophilusin a vector plasmid and its expression and purification in Bacillus subtilis[J].Science China C:Life China,2008,38(2):166-172.张敏,赵丛,杜连祥,等.嗜热脂肪芽孢杆菌高温中性蛋白酶在枯草芽孢杆菌中的表达、纯化及其酶学性质的研究[J].中国科学C辑:生命科学,2008,38(2):166-172.
[11]QASIM K B,RANI G.Purification and characterization of an oxidation-stable,thiol-dependent serine alkaline protease fromBacillus mojavensis[J].Enzyme and Microbial Technology,2003,32(2):294-304.
[12]JONAVESLY B,MANJUNALH B R,NAIK G R.Pigeon pea waste as a novel inexpensive substrate for production of a thermostable alkaline proteinase from thermoalkaliophilicBacillussp.JB-99[J].Bioresource Technology,2002,82(1):61-64.
[13]KLUSKENS L D,VOORHORST W G,SIEZEN R J,et al.Molecular characterization of fervidolysin,a subtilisin-like serine protease from the thermophilic bacteriumFervidobacteriumpennivorans[J].Extremephiles,2002,6(3):185-194.
[14]ISHIKAWA K,ISHIDA H,MATSUI I,et al.Novel Bifunctional Hyperthermostable Carboxypeptidase/Aminoacylase fromPyrococcushorikoshiiOT3[J].Applied and Environmental Microbiology,2001:67(2):673-679.
[15]OLEDZKA G,DABROWSKI S,KUR J.High-level expression,secretion,and purification of the thermostable aqualysin I fromThermusaquaticusYT-1inPichiapastoris[J].Protein Expression and Purification,2003,29:223-229.
[16]BEADELL J S,CLARK D S.Probing stability-activity relationship in the thermophilic protease fromThermoplasmaacidphilumby randorn mutagenesis[J].Extremephiles,2001,5(1):3-10.
[17]YAMAGATA A,MASUI R,KAKUTA Y,et al.Overexpression,purification and characterization of RecJ protein fromThermusthermophilusHB8and its core domain[J].Nucleic Acids Research,2001,29(22):4617-4624.
[18]JANG H J,KIM B C,PYUN Y R,et al.A novel subtilisn-like serine protease from Thermoanerobacter yonseiensis KB-1:its cloning,expression,and biochemical properties[J].Extremophiles,2002,6(3):233-243.
[19]ZHANG Y X,ZHAO Y,XU J L,et al.Isolation and characterization of three thermophilic proteases-producing bacteria[J].Chinese Journal of Applied Environmental Biology,2007,13(4):561-564.张燕新,赵印,许敬亮,等.3株高温蛋白酶产生菌的分离与鉴定[J].应用与环境生物学报,2007,13(4):561-564.
[20]LIN X Z,CHEN K S,HE P Q,et al.The effects ofSuaedasalsaL.planting on the soil microflora in coastal saline soil[J].Acta Ecologica Sinica,2006,26(3):801-807.林学政,陈靠山,何培青,等.种植盐地碱蓬改良滨海盐渍土对土壤微生物区系的影响[J].生态学报,2006,26(3):801-807.
[21]ADINARAYANA K,ELLAIAH P,PRASAD D S.Purification and partial characterization of thermostable serine alkaline protease from a newly isolatedBacillussubtilisPE-11[J].AAPS P harmaceutical Science and Technology,2003,4(4):440-448.
[22]CHEN Q H,HE G Q,WU Y L.Screening of elastase-producing strains and primariry studies on fermentation conditions[J].Journal of Zhejiang University:Agric.&Life Sci.,2003,29(1):59-64.陈启和,何国庆,邬应龙.弹性蛋白酶产生菌的筛选及其发酵条件的初步研究[J].浙江大学学报:农业与生命科学版,2003,29(1):59-64.
[23]GUO C L,WANG T,ZHU W,et al.The 16SrRNA ofThermusthermophiles from two high temperature hot springs of West Yunnan[J].Journal of Yunnan University,2003,25(5):458-462.郭春雷,王涛,祝伟,等.滇西二高温温泉中Thermus高温菌的16SrRNA[J].云南大学学报:自然科学版,2003,25(5):458-462.
[24]XUE Y,XU Y,LIU Y,et al.Thermoanaerobactertengcongensissp.nov.,a novel anaerobic,saccharolytic,thermophilic bacterium isolated from a hot spring in Tengcong,China[J].International Journal of Systematics Evolution Microbiological,2001,51:1335-1341.
[25]WANG D M,BAI F Q.The stability of thermozymes and their application prospect[J].Journal of Shandong Agricultural University:Natural Science,2006,37(3):477-478.王冬梅,白复芹.嗜热酶的稳定性及其应用前景[J].山东农业大学学报:自然科学版,2006,37(3):477-478.
Screening and Characterization of a Crude Thermophilic Alkaline Protease From an Isolated Strain ofBrevibacillusPBI in Indonesia's Hot Spring
WANG Shuai1,LIN Xue-zheng1,HUANG Xiao-hang1,ZHENG Li1,ZILDA Dewi Seswita2
(1.TheKeyLaboratoryofMarineBioactiveSubstances,TheFirstInstituteofOceanography,SOA,Qingdao 266061,China;2.ResearchCenterformarineandfisheryproductprocessingandbiotechnology,Jakarta 999006,Indonesia)
Thermophilic bacteria strains were isolated from water samples,soil samples and sediment samples of three Indonesia's hot spring area(Pantai cermin,Kalianda and Banyu wedang)by using MSM oligomedium.A strain of bacterium,by detecting hydrolysis halos of protease and its activity.The protease belonged to thermophilic alkaline protease,which showed high-temperature stability and pH stability.In addition,the results revealed that the optimal temperature and pH were 60℃and 8.0~9.0for protease activity,respectively.The enzyme activity decreased faintly at 60℃for 10min,the enzyme stability declined with increasing temperature,the enzyme half-life is 30min at 60 ℃,enzyme activity remained 46.1%at 70℃for 20min,the enzyme activity was relatively stable in the range of pH5.0~9.0.And the highest protease activity was 60.53U/mL.At 100℃,the protease still remained 26.37%relative enzyme activity.The effects of different metal ions(Ca2+,Mg2+,Mn2+,Fe2+,Fe3+,Cu2+,Zn2+,Ba2+and Sr2+)and protease inhibitor(EDTA,PMSF,Leupeptin,Pepstain A and Benzamidine)on thermophilic protease activity were investigated.It was found that low concentration of Fe3+could promote the production of thermophilic protease.In contrast,the protease activity was inhibited markedly by Fe3+,Cu2+and Zn2+.The thermophilic protease was sensitive to EDTA,its activity was decreased with the increased of EDTA concentration.And the protease activity was also inhibited in a certain extent by PMSF,Leupeptin,Benzamidine and Pepstain A,it showed that the enzyme activity declined was due to the effects of serine,cysteine residues.Based on the above results,the strain PBI had shown interesting properties in producing thermophilic protease.
hotspring;thermophilic bacterium;thermophilic protease;identification
March 16,2011
Q93
A
1671-6647(2012)02-0244-08
2011-03-16
中央级公益性科研院所基本科研业务项目——印尼热泉生态系统微生物多样性及其产嗜热酶研究(2010G13),海洋专性解烃菌Cycloclasticusspp.的代谢特征及协同降解高分子量多环芳烃的研究(2010G23)
王 帅(1983-),女,山东济南人,助理研究员,硕士,主要从事极端环境微生物方面研究.E-mail:wangshuai@fio.org.cn

