硅藻土对重金属离子Mn2+的吸附研究
张伟丽,朱 健,王 平,雷明婧,苏 扬
(中南林业科技大学 环境科学与工程研究中心,湖南 长沙 410004)
硅藻土对重金属离子Mn2+的吸附研究
张伟丽,朱 健,王 平,雷明婧,苏 扬
(中南林业科技大学 环境科学与工程研究中心,湖南 长沙 410004)
以硅藻土为吸附剂,采用静态吸附试验考查了吸附剂浓度、离子初始浓度、吸附质溶液温度、吸附质溶液初始pH值、时间等因素对硅藻土吸附模拟废水中Mn2+的影响。研究表明,硅藻土对Mn2+的最大吸附量可达到4.0486 mg·g-1,效果较好,可被用于去除重金属锰。适当增加吸附剂用量、离子初始浓度、控制吸附温度(<50)、pH值(<6)、延长吸附时间都能提高硅藻土对Mn2+的吸附效果。Langmuir 吸附等温式相比Freundlich吸附等温式能更好的描述硅藻土对Mn2+的吸附过程。硅藻土吸附Mn2+的吸附动力学则符合二级动力学方程。
硅藻土;吸附;Mn2+;吸附等温式;吸附动力学
硅藻土是一种储量丰富的层状硅酸盐天然粘土矿物,是由硅藻遗骸和软泥固结形成的硅质沉积岩。主要由水生单细胞藻类的二氧化硅微体化石组成,具有独特有序排列的椭圆微孔结构,孔隙率高,孔体积大,质量轻,堆积密度小,比表面积大等特性。在环境治理中,硅藻土已被广泛的应用于吸附领域,并且有了较多的研究报道与实践。由于硅藻土表面被大量活性硅羟基所覆盖,在水溶液中硅羟基上的H+会解离出来,使得硅藻土的表面带有一定的负电荷[1-3],这样使其对重金属离子拥有良好的离子交换性和选择吸附性,而被广泛应用于吸附废水中的重金属。已有学者就硅藻土对重金属离子的吸附能力进行了研究,这些离子包括Cu(Ⅱ)、Zn(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Cr(Ⅲ)等[4-10]。为了探明硅藻土对重金属吸附原理及吸附机理,也有学者就硅藻土对重金属离子吸附进行了等温吸附模型研究、吸附动力学研究等[11-12]。这些研究均证明硅藻土在处理重金属污染方面是一种较为理想的吸附剂,不仅方法简单,成本低,而且重金属在脱吸附时的释放率较低[13]。此外,硅藻土还被广泛用于吸附有机物,染料[14-15],废水中细菌[16],还与蛭石、沸石等结合应用于人工湿地处理农村废水[17]。
虽然国内外关于天然粘土矿物硅藻土对重金属吸附的研究有很多,但对于硅藻土吸附锰的研究报道比较少,而锰与其他重金属一样是具有潜在危害的环境污染物。不仅容易造成水体污染,使水质在短时变“黑水”;还可以在水体中生物链富集进入人体,会导致锰中毒,产生一系列疾病[18-19]。因此,在给定条件下,测定和分析硅藻土对重金属锰的吸附能力和去除能力,可为含重金属离子废水处理过程中吸附剂的选择提供理论依据和技术支持。
本研究采用静态吸附试验考查了吸附剂浓度、离子初始浓度、吸附质溶液温度、吸附质溶液初始pH值、时间等因素对硅藻土吸附重金属离子Mn2+的影响。并通过分析相关数据,初步研究了硅藻土对模拟废水中的Mn2+的最佳吸附条件,以及对Mn2+的吸附性能与机制,以期为硅藻土在含Mn2+废水处理上的应用提供必要的数据支持,并为硅藻土深度改性研究提供一定的技术参考。
1 材料与方法
1.1 试验材料
1.1.1 硅藻土
硅藻土由浙江嵊州市华力硅藻土制品有限公司提供,该硅藻土为土黄色,颗粒粒径7.5 μm,比表面积58.0 m2/g,孔径分布为30~400 nm,硅藻土中SiO2的质量分数为64.80%,Al2O3为16.40%,Fe2O3为2.91%。试验用硅藻土经水洗去除杂质后与105 ℃烘干,然后研磨过100目土壤筛,取筛下土放入干燥器中保存备用。
1.1.2 试剂与仪器
含Mn2+的模拟废水配制:准确称取3.077 2 g MnSO4·H2O溶于蒸馏水中,溶解完全后定容至1 000 mL的容量瓶,得到1 000 mg/L的Mn2+标准储备液待用。试验用水为蒸馏水。
仪器主要为AA-7000型火焰原子吸收分光光度计(北京东西仪器分析有限公司);酸度计(pHs-3C,上海精密科学仪器有限公司);TS-1112B大容量恒温培养摇床(天呈);101-1AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司);电子分析天平(奥豪斯公司)。
1.2 试验方法
1.2.1 单因素吸附试验
取不同量的硅藻土(0.1 g、0.2 g、0.3 g、0.4 g、0.5 g、0.6 g、1 g、2 g)于 250 mL的具塞锥形瓶中,加入系列质量浓度(10、20、50、100、150、200、300、600、1 000 mg/L)的 Mn2+标准溶液100 mL,每个质量浓度点设置2个平行样,用0.1 mol/L的HCl和0.1 mol/L的NaOH溶液调整溶液的pH值分别为3.0、4.0、5.0、6.0、7.0、8.0,在温度为 15 ℃、25 ℃、35 ℃、45 ℃、55 ℃、65 ℃下,以200 r·min-1的转速恒温振荡一段时间,取液用中速定量滤纸过滤,再将滤后清液用火焰原子吸收分光光度计测定其中Mn2+的浓度。分别按公式(1)、(2)计算其吸附量和去除率。

式(1) 、(2)中:C0为吸附前水样中Mn2+离子浓度(mg·L-1);Ci为吸附后水样中 Mn2+离子浓度 (mg·L-1);V为水样体积(L);m为硅藻土投加量(g)。
1.2.2 等温吸附试验
取一定量硅藻土(3 g±0.000 5 g)于250 mL的具塞锥形瓶中,加入100 mL质量浓度分别为10、20、50、100、150、200、300、600、1 000 mg/L的Mn2+标准溶液,每个质量浓度点设置2个平行样,用0.1 mol/L的HCl和0.1 mol/L的NaOH溶液调整溶液的pH值为5.0,分别在30 ℃、60 ℃下以200 r·min-1的转速振荡2 h,取液过中速定量滤纸后,用火焰原子吸收分光光度计测定滤后清液中Mn2+的浓度。按公式(2)计算吸附量q。然后分别按公式(3)、(4)以吸附量Qe(mg·g-1)对平衡浓度Ce(mg·L-1)作图,得到等温吸附曲线。

式(3)、(4)中:qe为平衡吸附量(mg·g-1);Ce为吸附质浓度(mg·L-1);KL,KF均为吸附平衡常数;qm为饱和吸附量(mg·g-1);n为常数。
1.2.3 吸附动力学试验
取一定量硅藻土(3 g±0.000 5 g)于250 mL的具塞锥形瓶中,加入100 mL质量浓度为200 mg/L的Mn2+标准溶液,每个质量浓度点设置2个平行样,用0.1 mol/L的HCl和0.1 mol/L的NaOH溶液调整溶液的pH值为5.0,在30 ℃、200 r·min-1的条件下分别振荡5、10、15、20、30、40、60、90、120、150、240、360 min,然后过滤,用火焰原子吸收分光光度计测定滤后清液中Mn2+的浓度。按公式(2)计算吸附量q。然后分别按公式(5)、(6)以吸附量 qe(mg·g-1)对吸附时间 t/(min)作图,得到吸附动力学曲线图。
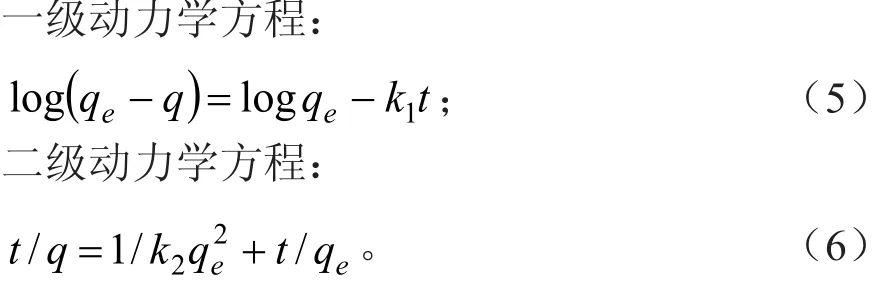
式(5)、(6)中:q为t时刻的吸附量(mg·g-1);t为吸附时间(min);qe为平衡时吸附量(mg·g-1);k1为一级吸附速率常数(min-1);k2为二级吸附速率常数(g·min-1min-1)。
1.3 分析方法
Mn2+浓度的测定采用火焰原子吸收分光光度法。相应的辅助设备有:乙炔-空气燃烧器,空心阴极灯。测定锰元素时燃烧头高度设置为5 cm,波长设定为279.5 nm,狭缝设定为0.2 nm。用酸度计通过0.1 mol/L的HCl和0.1 mol/L的NaOH溶液调整试验溶液的pH值。
2 结果与分析
2.1 硅藻土吸附Mn2+的影响因素
2.1.1 吸附剂浓度对硅藻土吸附Mn2+的影响
在30 ℃,pH=5.0, Mn2+初始浓度C0=100 mg·L-1,200 r·min-1的试验条件下,分别按 1、2、3、4、5、6、10、20 g·L-1的投加量进行吸附试验2 h,试验结果见图1(A)。
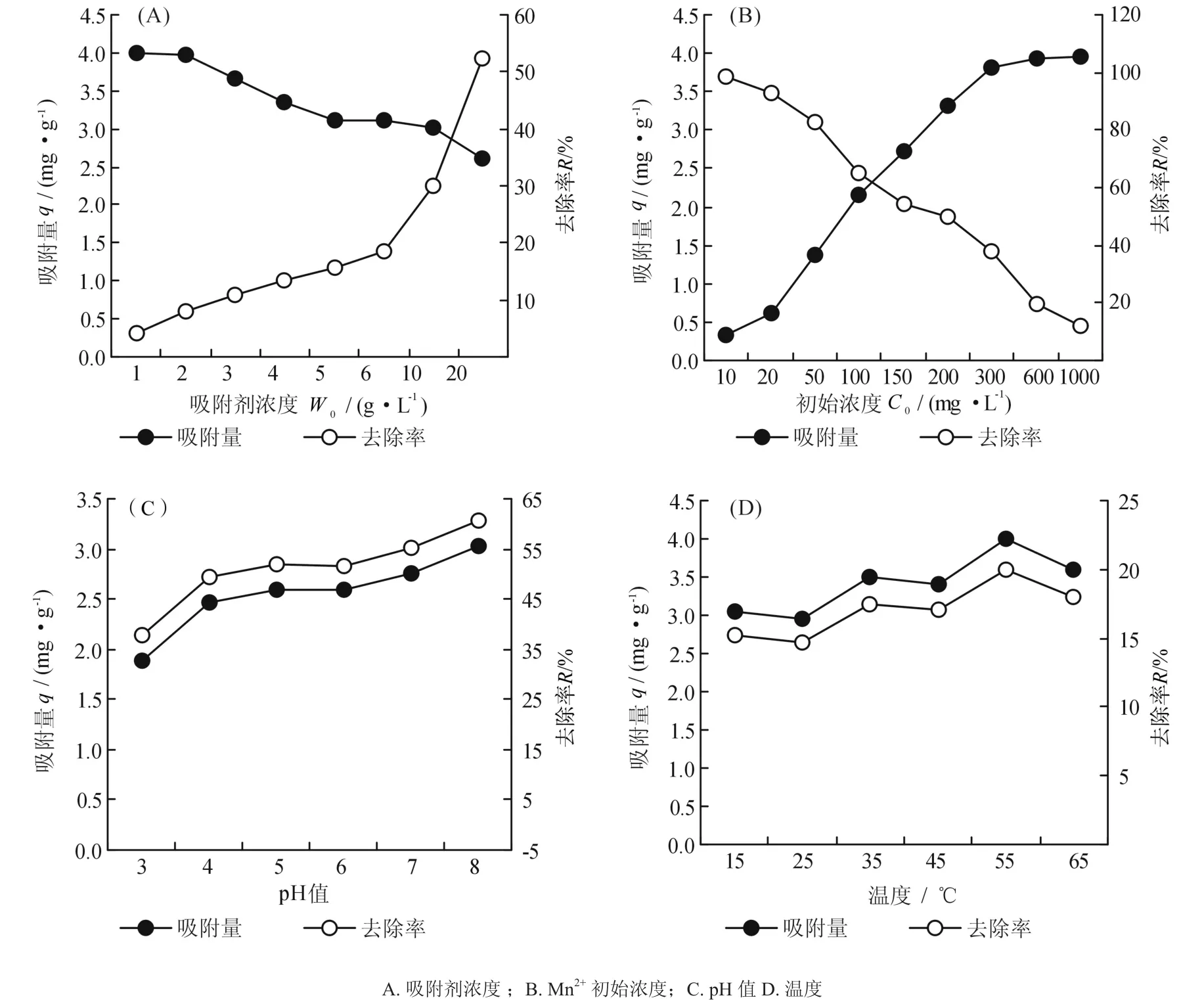
图1 不同因素对硅藻土吸附Mn2+的影响Fig.1 Effects of different factors on adsorption capacity
由图1(A)可看出,当模拟废水中Mn2+浓度一定时,随着吸附剂浓度的增加,硅藻土对Mn2+的去除率增大,但对Mn2+离子的吸附量减小。主要是因为在一定范围内,增加硅藻土的投加量使得溶液中硅藻土总量增加,从而总的吸附点位增多,可以去除更多的Mn2+,故溶液中剩余的Mn2+离子浓度降低,具体表现为随吸附剂浓度的增加而去除率增大。硅藻土对Mn2+离子的吸附量减小,主要是指单位质量的硅藻土对Mn2+离子的吸附量减小,因为在Mn2+初始浓度一定的情况下,随着吸附剂浓度的增加,使得单位质量的硅藻土的吸附点位减小,从而单位质量的硅藻土对Mn2+的吸附量减小。从图中可以看出,硅藻土对Mn2+的吸附量与去除率在10 g·L-1和35%交叉,结合成本上的考虑,本试验选择10 g·L-1为最佳吸附剂浓度,此时对Mn2+的去除率达到35%。
2.1.2 溶液初始浓度对硅藻土吸附Mn2+的影响
在 30℃,W0=30 g·L-1,pH=5.0,200 r·min-1的试验条件下,分别以不同Mn2+初始浓度进行吸附试验2 h,试验结果见图1(B)。
由图1(B)可看出:当吸附剂浓度一定时,随着模拟废水中Mn2+初始浓度的增加,硅藻土对Mn2+的吸附量逐渐增大最后趋于平衡;但硅藻土对Mn2+的去除率逐渐减小。这主要是因为Mn2+初始浓度的增大,使得Mn2+与硅藻土接触的机会增多,从而硅藻土比表面积占有率、孔道饱和率增大,Mn2+的吸附量明显上升。但由于硅藻土对离子吸附增加的量小于溶液中因浓度增加而引起的增加量,所以,去除率呈下降趋势。图中还可看出:当初始浓度增加到300 mg·L-1后,吸附量上升趋势减小,逐渐趋于平衡,达到饱和吸附。结合硅藻土对Mn2+的吸附量和去除率,本试验选择100 mg·L-1为最佳离子初始浓度,此时对Mn2+的去除率达到60%。
2.1.3 吸附溶液pH值对硅藻土吸附Mn2+的影响
在 30 ℃,W0=20 g·L-1,[Mn2+]=100 mg·L-1,200 r·min-1的试验条件下,分别以不同pH值进行吸附试验2 h,研究不同pH值对硅藻土吸附Mn2+的影响。试验结果见图1(C)。
由图1(C)可看出:硅藻土对Mn2+的吸附量和去除率随着溶液pH值的增大而增加。主要是因为在pH值<4.0的酸性条件下,溶液中过多的H+会与Mn2+竞争吸附点位,降低硅藻土的负电性,不利于硅藻土对Mn2+离子的吸附和去除。随着pH值的增大,溶液呈弱酸性或接近中性时,硅藻土对Mn2+离子的吸附量和去除率都比较好。在pH值>7.0的碱性条件下,Mn2+易于水解生成Mn(OH)2沉淀,从而减少废水中的Mn2+浓度,但此时对Mn2+的去除是在沉淀和吸附的协同作用下进行的,已不完全为硅藻土的吸附作用。因此本试验选择pH值=5为最佳溶液pH值,此时对Mn2+的去除率达到53%。
2.1.4 吸附温度对硅藻土吸附Mn2+的影响
在 W0=10 g·L-1,pH=5.0,[Mn2+]=200 mg·L-1,200 r·min-1的试验条件下,分别以不同温度进行吸附试验2 h,试验结果见图1(D)。
由图1(D)可看出:硅藻土对模拟废水中Mn2+的吸附随吸附温度变化较大。在温度<55℃时,随着温度的升高,溶液中离子运动速度加快,活性增加,使得溶液中活化离子增多;温度的的升高还会增加硅藻土表面的硅羟基数目,激活硅藻土的吸附点位,从而促进离子的交换反应,使得硅藻土对Mn2+的吸附量和去除率增大。在温度>55 ℃时,过高的温度使得硅藻土的层间结构发生变化,不利于吸附的进行,硅藻土对Mn2+的吸附量和去除率明显下降。因此本试验选择30 ℃为最佳吸附温度,此时对Mn2+的去除率达到23%。
2.1.5 吸附时间对硅藻土吸附Mn2+的影响
在 30℃,W0=30 g·L-1,pH=5.0,[Mn2+]=200 mg·L-1,200 r·min-1的试验条件下,进行吸附时间对Mn2+吸附影响试验,试验结果见图2。由图2可看出,在吸附反应的初期(15 min),硅藻土对Mn2+的去除率迅速提高,吸附量也明显增加,主要是因为在反应的初期,硅藻土表面的吸附点位较多,Mn2+能够较快的附着到硅藻土表面而被吸附。随着时间的延长,硅藻土表面的吸附点位逐渐减少,使得吸附速度减慢,但吸附量仍在增加。30分钟后硅藻土对Mn2+的去除率和吸附量都基本趋于平衡,达到饱和吸附,此时对Mn2+的去除率达到65%。因此本试验选择30 min作为Mn2+的吸附平衡时间。

图2 吸附时间对Mn2+吸附的影响Fig.2 Effect of adsorption time on adsorption capacity
2.2 硅藻土对Mn2+的吸附机理研究
在 W0=30 g·L-1, pH=5.0,200 r·min-1的 试 验条件下,分别在30 ℃、60 ℃两个温度下进行等温吸附试验。以吸附量qe对平衡浓度Ce作图,得到硅藻土吸附Mn2+的Langmuir吸附等温曲线及Freundlich吸附等温曲线,见图3。
将图3中得到的等温式进行处理,得到参数方程(表1),由表1可知,两种吸附等温式对硅藻土吸附Mn2+的线性拟合程度无论在30 ℃还是60 ℃均很好。在30 ℃试验条件下两种等温式的线性拟合R2分别为0.998 8和0.963 6;在60℃试验条件下两种等温式的线性拟合R2分别为0.970 8和0.963 9,说明硅藻土对Mn2+的吸附过程符合Langmuir吸附等温式及Freundlich吸附等温式,但Langmuir吸附等能够更好的描述硅藻土对Mn2+的吸附机理。
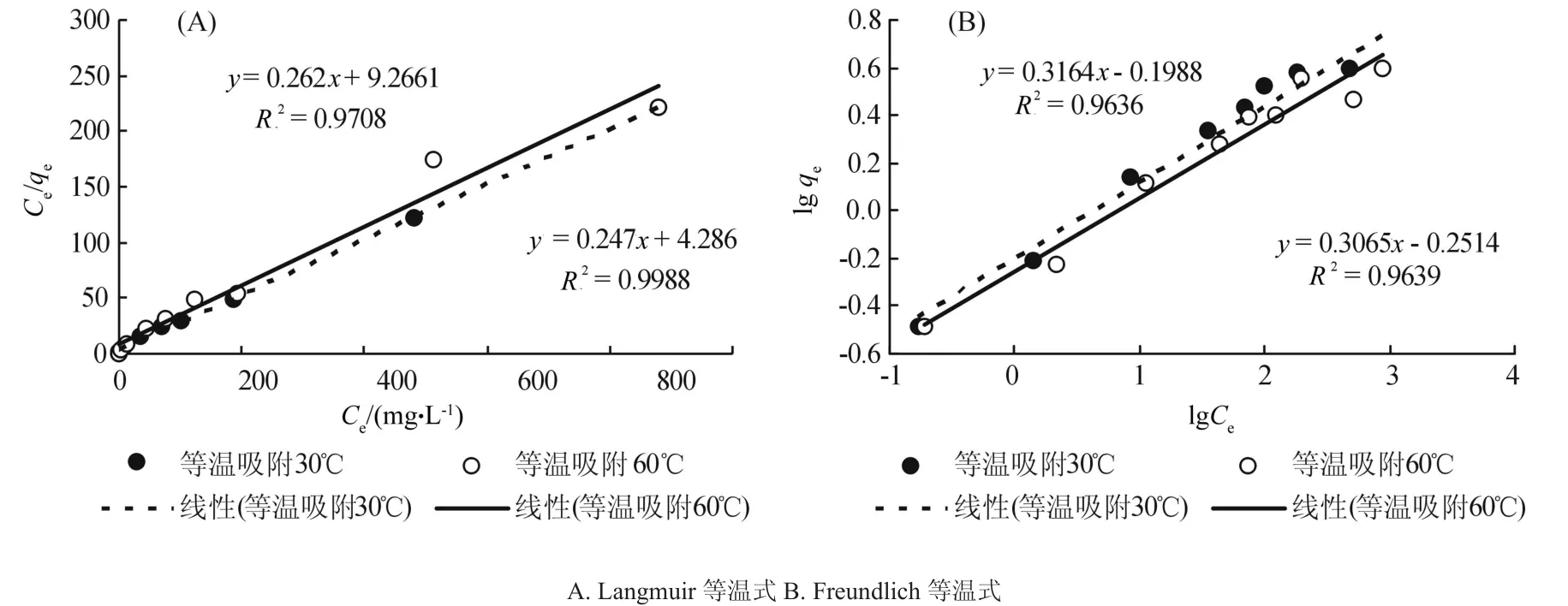
图3 等温吸附曲线Fig.3 Isothermal adsorption curves
由表1可得出,天然硅藻土对Mn2+的最大吸附量qm在两种温度下分别为4.048 6 mg·g-1和3.818 6 mg·g-1,说明硅藻土具有较大的Mn2+吸附容量。同时可以看出不同温度水平下的最大吸附量不同,在30 ℃下要比60 ℃下高出6%,吸附参数K在两种温度下也存在差异,说明吸附等温模型的参数在固-液吸附体系中并不稳定,已有学者表明, Langmuir吸附模型在应用中存在两大问题:吸附剂浓度效应和方程参数不恒定为常数[20-22]。
一般认为,n>1表示吸附为优先吸附[1]。从表1可看出,Freundlich吸附等温式中的参数n在两种温度下均大于3,说明硅藻土对的Mn2+吸附为优先吸附。

表1 两种吸附等温式的相关参数Table 1 Correlation parameters of two adsorption isotherms equations
2.3 硅藻土对Mn2+的吸附动力学
为了研究经典动力学方程对硅藻土吸附重金属离子的适用性,将吸附时间对Mn2+吸附影响试验中得到的数据按公式(5)、(6)进行整理,以吸附量qe对吸附时间t作图,得到硅藻土吸附Mn2+的吸附动力学曲线图,见图4。
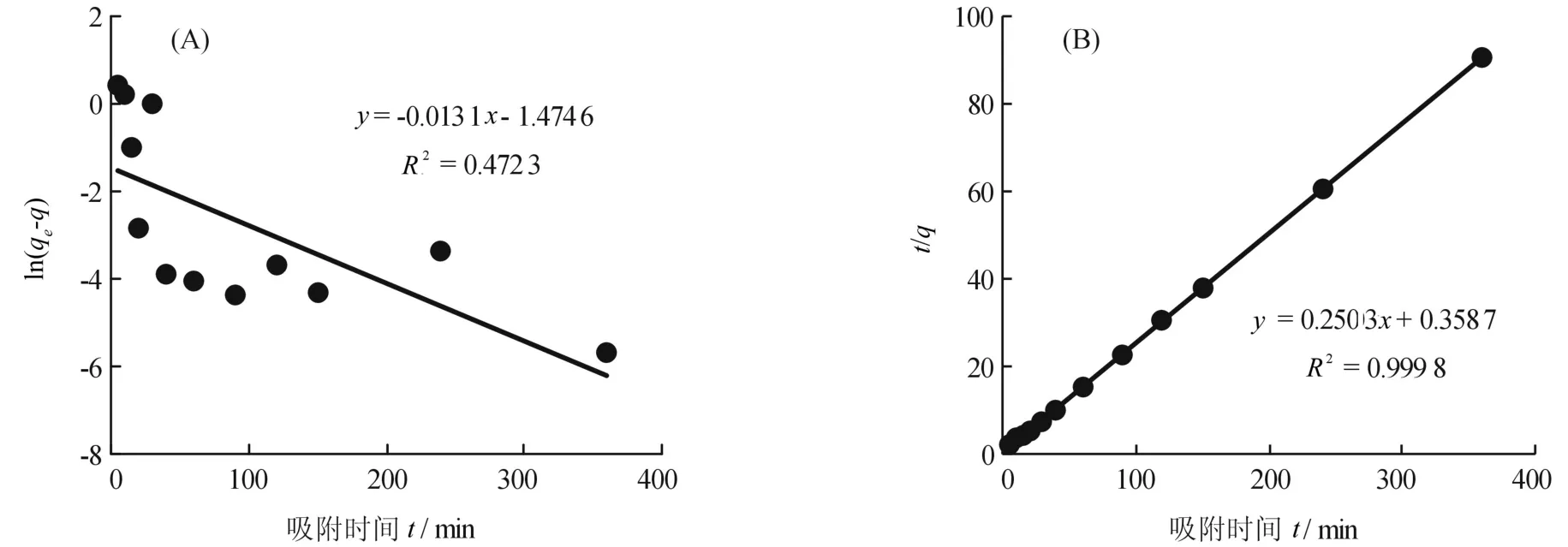
图4 动力学方程拟合曲线(A. 一级动力学方程 B. 二级动力学方程)Fig.4 Fitting curves of different kinetic equations
从图4可知:硅藻土吸附Mn2+的一级和二级动力学方程的线性拟合R2分别为0.472 3和0.999 8,一级动力学方程的拟合效果较差,可能是硅藻土对Mn2+的吸附并不仅靠阳离子交换,而是在多种协同作用下进行的,超出了一级动力学的应用范围。相比之下,二级动力学能够较好的说明硅藻土对Mn2+的吸附动态过程。
3 结 论
(1)硅藻土表面含有的硅羟基结构使得硅藻土颗粒表面带有负电荷,能够吸附废水中的重金属。随着吸附剂浓度的增加,硅藻土对Mn2+的吸附量逐渐减小,去除率逐渐增大;随着离子初始浓度的增加,硅藻土对的吸附量逐渐增大,去除率逐渐减小;所以在应用中因根据实际情况合理的选择硅藻土的用量。硅藻土对Mn2+的吸附量和去除率随着pH值和温度的升高而增大,但在温度大于50℃后开始减小。在30 g·L-1的投加量条件下,硅藻土在30 min内可去除65%的Mn2+。硅藻土吸附Mn2+离子的最优试验条件:硅藻土投加量为10 g·L-1、离子初始浓度为 100 mg·L-1、pH 值为 5.0、吸附温度为30 ℃、平衡吸附时间为30 min。
(2)硅藻土对Mn2+的吸附过程符合Langmuir吸附等温式及Freundlich吸附等温式,拟合程度均较高(R2>0.9)。但Langmuir吸附等温式能够更好的描述硅藻土对Mn2+的吸附过程,最大吸附量可达到4.048 6 mg·g-1。硅藻土对Mn2+的吸附动力并不仅靠阳离子交换,而是在多种协同作用下进行的,则二级动力学相比一级动力学能够更好的说明硅藻土对Mn2+的吸附动态过程。
[1] 袁 鹏. 硅藻土的提纯及其表面羟基、酸位的研究[D].中国科学院博士学位论文, 2001.
[2] 罗智文. 改性硅藻土吸附废水中氨氮和重金属(铬)的研究[D]. 重庆大学, 2006.
[3] 杨 文, 王 平, 朱 健, 等. PAM表面改性硅藻土吸附废水中Pb2+[J]. 非金属矿, 2011, 34(2): 54-55.
[4] 朱 健, 王 平, 罗文连, 等. 硅藻土吸附重金属离子研究现状及进展[J]. 中南林业科技大学学报, 2011, 31(7): 183-188.
[5] 朱 健, 王 平, 罗文连, 等. 硅藻土深度物理改性及对Fe3+吸附性能研究[J]. 硅酸盐通报, 2010, 29(6): 1290-1298.
[6] 朱 健, 王 平, 罗文连, 等. 硅藻土对Fe3+的吸附性能及热力学研究[J].中南林业科技大学学报(自然科学版), 2010,30(12): 108-115.
[7] Wen Yang, Ping Wang, Wen-lian Luo, et al. The Diatomite Modif i ed by PAM and Applied to Adsorb Pb(II) in the Simulated Wastewater[J]. Advanced Materials Research, 2011, 233-235.
[8] 杨 文, 王 平, 王韬远, 等. PAM包覆改性硅藻土吸附模拟废水中的Cd2+[J]. 中南林业科技大学学报(自然科学版),2011, 31(7): 130-135.
[9] Jian Zhu, Ping Wang, Xiaofu Wu, et al. Adsorption of Pb2+ions on diatomite modif i ed by polypropylene acetamide and barium chloride in aqueous solution[J]. African Journal of Agriculture Research, 2012, 7(24): 3614-3620.
[10] 朱 健, 王 平, 李科林, 等. 硅藻土对污染土壤中铅的固定效果及机制[J].中国农学通报, 2012, 28(14): 240-245.
[11] 赵 芳, 吴晓芙, 张艳丽, 等.固液相离子吸附体系中吸附剂浓度效应与langmuir方程的适用性[J]. 环境化学, 2007,26(3): 336-337.
[12] Nagayasu T, Imamura K, N akanish i K. Adsorption characteristics of various organic substances on the surfaces of tantalum, titanium, and zirconium[J]. J. Colloid Interface Sci.,2005, 286: 462-470.
[13] 高俊杰, 梁 锦, 徐 丽, 等. 环境矿物材料对重金属污染的修复研究[J]. 中山大学研究生学刊, 2010, 31(1): 52-57.
[14] 矫 娜, 王东升, 段晋明, 等. 改性硅藻土对三种有机染料的吸附作用研究[J].环境科学学报, 2012, 32(6): 1364-1369.
[15] Al-Ghouti M A, Khraishen M A M. Thermmodynamic behaviour and the effect of temperature on the remove of dyes from aqueous solution using modif i ed diatomite[J]. Journal of Colloid and Interface Science, 2005, 287: 6-13.
[16] 沈岩柏, 朱一民, 谓德洲, 等. 硅藻土对诺卡氏菌的吸附作用[J]. 东北大学学报, 2005, 26(2): 183-185.
[17] 朱 健, 王 平, 罗文连, 等. 组合人工湿地应用于农村生活废水处理工程[J]. 中国给水排水, 2011, 27(12): 49-51.
[18] 杨 宏, 纪 捐, 钟 洁, 等. 生物除锰技术研究进展及应用[J]. 环境科学与技术, 2008, 31(8): 38-41.
[19] 张 明, 施培俊, 杜 建 .农村生活应用水中锰的危害及去除[J]. 西南给排水, 2011, 33(5): 14-16.
[20] Pan G, Krom M D, Herut B. Adsorption-desorption of phosphate on airborne dust and riverborne particulates in east Mediterranean seawater[J]. Environ. Sci.Technol., 2002, 36: 35l9-3524.
[21] Wu Xiaofu, Hu Yueli, Nie Fahui, et al. Ion adsorption components in liquid/solid system[J]. Journal of Environmental Science, 2006, 18: 1167-1175.
[22] 赵 芳, 吴晓芙, 黄中子, 等. 液/固离子吸附体系中的强度因子[J]. 中南林业科技大学学报, 2007, 27(1): 109-110.
Research on adsorption of diatomite to heavy metal ion Mn2+
ZHANG Wei-li, ZHU Jian, WANG Ping, LEI Ming-jing, SU Yang
(Institute of Environmental Science and Engineering Research, Central Couth University of Forestry & Technology,Changsha 410004, Hunan, China)
Using diatomite as an adsorbent, the effects of several factors, including adsorbent concentration, initial iron concentration,adsorbate-solution temperature, initial adsorbate-solution pH value and adsorption time on diatomite adsorption to the Mn2+in the simulated waste-water were examined in the experiment by static adsorption tentative. The results indicate that the maximum diatomite adsorption capacity to Mn2+was 4.0486 mg·g-1, so the diatomite adsorbent can be used for the removal of the Mn2+iron. Further, under the conditions of temperature lower than 50℃ and the pH value less than 6, the performance of diatomite adsorption to Mn2+could be improved with the increases of adsorbent dosage, initial Mn2+concentration and adsorption time. The fi ndings also demonstrate that,compared to the Langmuir adsorption isotherms, Freundlich adsorption isotherm can better describe the adsorption process of diatomite to Mn2+, and that adsorption kinetic of diatomite to Mn2+accorded with second-order equation.
diatomite;adsorption;Mn2+;adsorption isotherms;adsorption kinetic aqueous
S719;X522
A
1673-923X(2012)12-0072-06
2012-06-13
湖南省自然科学省市联合基金重点项目(12JJ8016);湖南省研究生科研创新项目(CX2012B317);环保公益性行业科研专项(200909066);湖南省环境科学重点学科建设基金资助项目(2006180)
张伟丽(1989-),女,硕士研究生,主要从事水体重金属污染控制;E-mail:zhangweili20101027@163.com
王 平(1964-),男,湖南常德人,教授,博士,博士生导师,主要从事生态学领域方面的研究;E-mail:csfuwp@163.com
[本文编校:文凤鸣]

