壳聚糖/α,β-甘油磷酸凝胶微球的制备及性质研究*
臧惠迪,程晓杰,李 阳,李 敬,陈西广
(中国海洋大学海洋生命学院,山东青岛266003)
壳聚糖/α,β-甘油磷酸凝胶微球的制备及性质研究*
臧惠迪,程晓杰,李 阳,李 敬,陈西广**
(中国海洋大学海洋生命学院,山东青岛266003)
以液体石蜡为油相,以壳聚糖/α,β-甘油磷酸凝胶溶液为水相,用乳化法制备了壳聚糖/α,β-甘油磷酸凝胶微球,并对微球形态、粒径分布、溶胀性、蛋白吸附率、溶血率、体外降解率进行了分析。光学显微镜下显示,微球形态圆整,粒径主要分布在100~400μm;扫描电镜显示,微球内部为三维网络状结构,骨架清晰;p H=7.4的PBS缓冲液中干凝胶微球的溶胀率为218.08%,普通壳聚糖微球为70.98%;1和24 h测得凝胶微球的蛋白吸附量分别为13.21和15.68μg/g,普通壳聚糖微球分别为3.71×103和4.83×103μg/g;微球的溶血率小于5%,血液相容性良好;体外降解实验显示,壳聚糖的脱乙酰度、黏度以及溶菌酶浓度对壳聚糖/α,β-甘油磷酸凝胶微球的降解性质产生影响。
壳聚糖;α,β-甘油磷酸;凝胶微球;理化性质
选用合理的栓塞剂对血管介入栓塞治疗至关重要。栓塞剂按物理性状划分,可分为颗粒状栓塞剂、液态栓塞剂、大型栓塞剂、磁性栓塞剂及放射性栓塞剂[1]。颗粒状栓塞剂(包括微球和微囊),具有成球材料多、栓塞效果好[2]、对特定组织器官靶向性高[3]、可与化疗药物结合、可缓释药物等优点[4],因而受到越来越多的重视。按照载体材料不同,可将颗粒栓塞剂分为可生物降解和不可生物降解2种[5]。不可生物降解类微球(粒)以聚乙烯醇为代表,适用于永久性栓塞治疗。可生物降解类微球(粒)具有缓释化疗药物,局部药物浓集,减轻身体不良反应等优势,适用于多次反复栓塞治疗[6-7]。
壳聚糖(Chitosan,CS)具有良好的生物相容性、可降解性、低毒性及低抗原性等特点,被广泛应用于生物医学领域[8]。国内研究者将抗癌药顺铂包裹于壳聚糖微球内,制备出了顺铂壳聚糖微球,已成功应用于肝动脉栓塞的临床治疗[9-10]。环境敏感型水凝胶具有生物相容性好、可生物降解、亲水性强[11]、膨胀系数大等特点,在组织工程和药物缓释领域有着广阔的应用前景[12]。本实验室已成功制备和研究了壳聚糖微球(Chitosan Microspheres,CMs)和壳聚糖/α,β-甘油磷酸水凝胶,本研究在此基础上,采用乳化法制备了壳聚糖/α,β-甘油磷酸凝胶微球(Chitosan/α,β-Glycerophosphate Hydrogel Microspheres,CS/α,β-GP HMs),并对微球的理化性质进行了测试,以期为用于栓塞治疗的凝胶微球选材、制备等基础研究提供理论依据。
1 材料与方法
1.1 材料
壳聚糖,购于金湖甲壳制品有限公司,黏度和脱乙酰度分别为130cps、69.5%,130cps、84%,130cps、93.7%,200cps、95.8%和400cps、92.5%;α,β-甘油磷酸,购于山西运城风陵渡开元药化有限公司;牛血清白蛋白(BSA)、考马斯亮蓝,购于美国Sigma公司;溶菌酶购于日本Boyun Biotech公司;其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 CS/α,β-GP HMs的制备 采用乳化法制备CS/α,β-GP HMs。准确称取一定量壳聚糖,溶于90 mL浓度为0.1mol/L的醋酸溶液中,冰浴中搅拌。用针管滴加入10 m L浓度为50%α,β-甘油磷酸,搅拌均匀,然后倒入600 m L液体石蜡中,加入适量司班、吐温,调转速至900 r/min搅拌,水浴锅加热升温至温敏凝胶成胶温度之上。待液态乳滴变成凝胶微球后,搅拌并降温至10℃以下,静置沉降。收集微球,用温热乙醇洗涤微球,干燥,保存。
1.2.2 CS/α,β-GP HMs形态及粒度分布 采用光学显微镜和扫描电镜观察微球形态,扫描电镜观察微球表面及内部结构,显微计数法测定微球粒径及分布。每次测定样品不少于800个,重复3次。微球的平均粒径计算公式为:。其中:为微球的平均粒径;ni为微球的数量;Di为微球直径。
1.2.3 CS/α,β-GP HMs的溶胀性测定 参照文献[6]制备壳聚糖微球。分别称取50 mg的干燥CMs和CS/α,β-GP HMs,放入10 mL离心管中,加入足量p H=7.4的PBS缓冲液,开始计时,分别间隔5、10、15、20、25、30、40、50、60、70、80、90、120、180 min,将离心管中的缓冲液倒出,用蒸馏水冲洗2次,吸干微球表面水分,称重,根据微球的净增重计算微球的溶胀率。每种微球设3组平行样,重复3次。计算公式为S w=(W s-Wd)/Wd×100%,S w为溶胀率,Wd为初始质量(mg),W s为溶胀后质量(mg)。
1.2.4 CS/α,β-GP HMs的蛋白吸附测定 采用考马斯亮蓝法测定微球吸附蛋白的含量。准确称取CMs和CS/α,β-GP HMs各20 mg,加入1 m L生理盐水充分溶胀后,与1 m L BSA标准液(100μg/m L)混合,分别于37℃温浴1、3、6、9、12、15和24 h。对照组以生理盐水取代BSA溶液。4 000 r/min离心分离弃上清,用生理盐水洗涤沉淀2次,以除去未与微球表面结合的蛋白。加入1m L含1%SDS的生理盐水溶液超声解吸在微球表面的蛋白。离心,取1 m L上清液,加入5 m L考马斯亮蓝G-250,混匀、静置5 min,分光光度法测定在波长595 nm处吸光度值。根据标准曲线方程,计算材料对BSA的蛋白吸附量。
1.2.5 CS/α,β-GP HMs血液相容性检测 通过红细胞溶血实验检测材料的血液相容性。取新鲜人体血液4 m L迅速注入含有0.2 m L肝素抗凝剂的试管中,充分混合,制备抗凝血液,加入5 m L生理盐水稀释备用。实验分为实验组,阳性对照(Positive control,pc)组,阴性对照(Negative control,nc)组,各设3个平行样,其中阳性对照用蒸馏水,阴性对照用0.9%的生理盐水。CMs/α,β-GP的干燥样品为实验材料。准确称取实验材料30 mg,用蒸馏水冲洗多次,去掉微球表面可能残有的杂质,将微球浸泡在3 m L生理盐水中37℃恒温水浴1 h后制成测试悬液。向每个样品中加入预热的抗凝血0.06 mL,轻轻混匀,37℃条件下恒温保存1 h。4 000 r/min离心测试悬液10 min以除去完整的红细胞、红细胞碎片以及样品等固形物。用分光光度法在545 nm处测定上清液的吸光值。样品的溶血率(Hemolysis rate,HR(%))计算公式:HR(%)=,其中,HR(%)为溶血率,为样品组的吸光度值,Dnc为阴性对照组吸光度值,Dpc为阳性对照组吸光度值。
1.2.6 CS/α,β-GP HMs的体外降解实验 准确称取CMs/α,β-GP HMs 50mg,在p H=7.4的PBS中充分溶胀,分离微球,放入10 m L的试管中,带试管称重,初始重量记为M0。向试管中加入一定浓度的溶菌酶溶液10 m L,37℃水浴中恒温振荡。为保持酶活性,每天更换50%的溶菌酶溶液,分别于第1、2、3、4周后取出,倒掉试管内溶液,用蒸馏水冲洗微球,低温烘干,再次带试管称重,所得重量记为Mt。用公式DR(%)=(M0-Mt)/M0×100%,计算微球的降解率,每组样品设3个平行样,重复3次。
1.2.7 统计学分析 实验数据用平均数±标准差表示(珡X±SD),采用EXCEl软件进行统计学分析。组间差异采用单因素方差分析,以P<0.05为具有统计学意义。
2 结果与讨论
2.1 CS/α,β-GP HMs形态学观察
光学显微镜和扫描电镜下观察,CS/α,β-GP HMs形态圆整,分散性良好(见图1);扫描电镜观察显示,其表面有一层较为致密的膜,偶有破损(见图2A);内部为多孔的三维网状结构,骨架清晰,孔径为10μm左右(见图2B)。
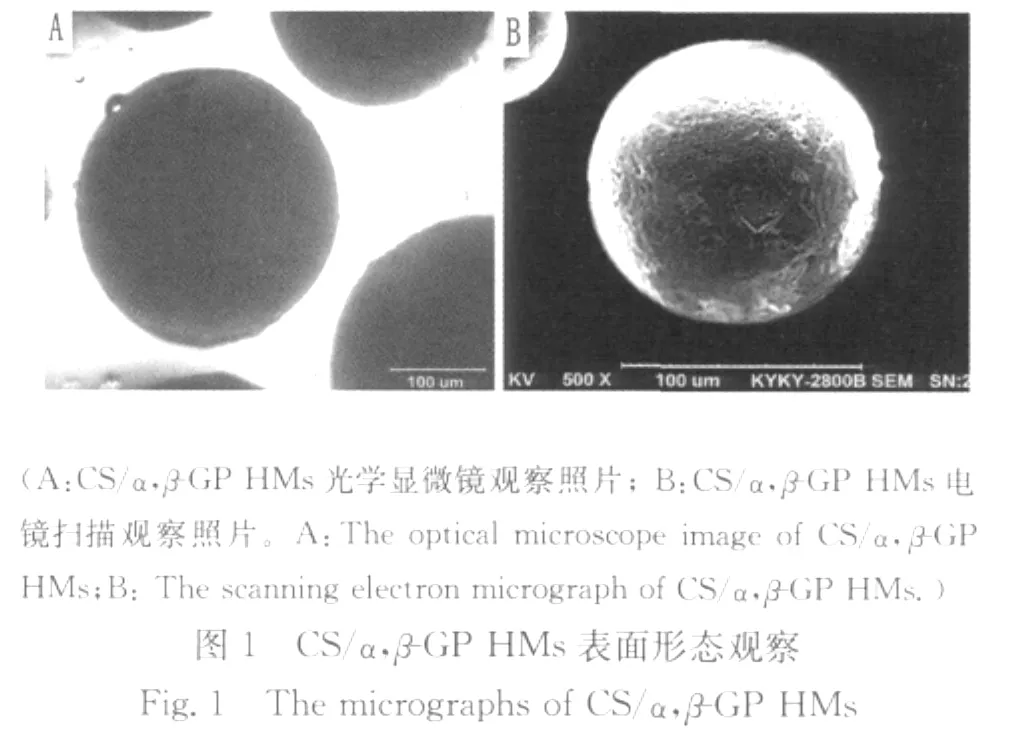
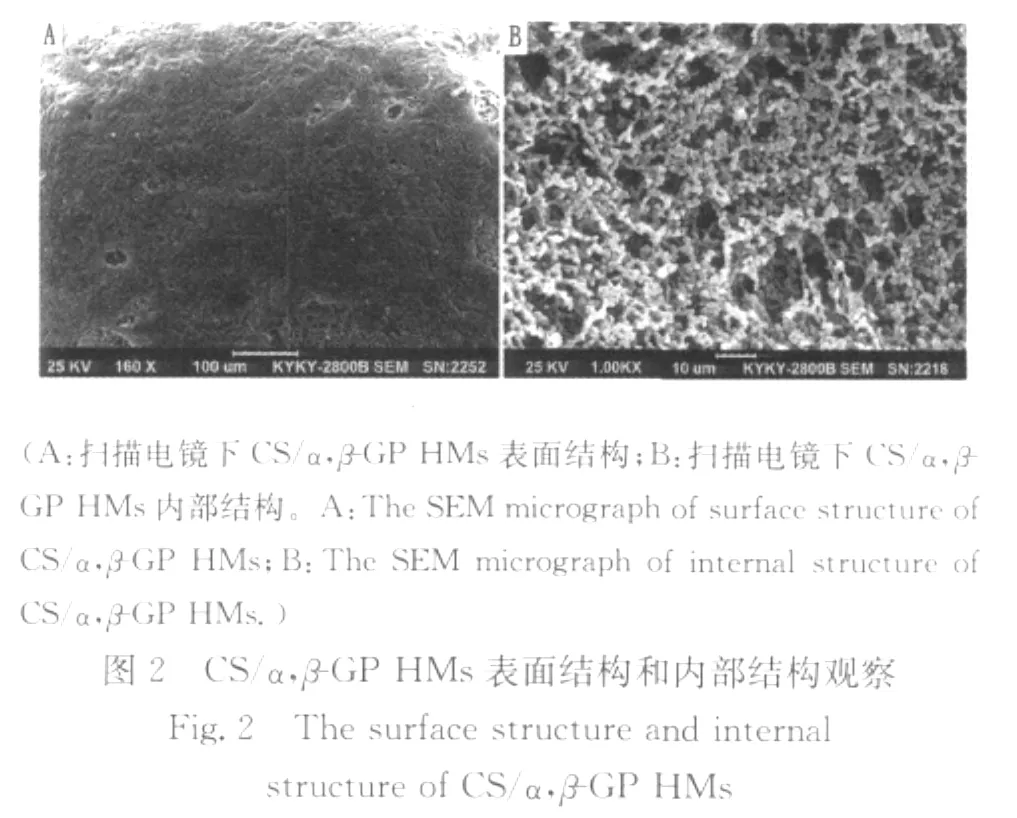
统计结果显示,CS/α,β-GP HMs的平均粒径为(333.58±1.05)μm,粒径分布在100~400μm的微球占总数的87.66%,可根据需要进行分筛,满足不同规格栓塞材料的粒径要求。
我国西部地区政府审计揭示效率实证分析——基于DEA和Malmquist指数模型的研究贺宝成 王家伟20-69
2.2 CS/α,β-GP HMs的溶胀性
CMs的溶胀率(见图3)在25 min达到溶胀最大值70.98%,并逐渐实现溶胀平衡;CS/α,β-GP HMs的溶胀率在35min达到最大值218.08%,约为CMs的3倍。CS/α,β-GP HMs在溶胀的前15min有一个快速吸水增重的过程,吸水量远大于CMs,这是因为CS/α,β-GP HMs具有三维空间网络状结构,亲水性更强,能够吸引更多水分子进入到微球内部[13]。溶胀率的提高有助于微球更好的在血管内进行栓塞,增强栓塞效果。
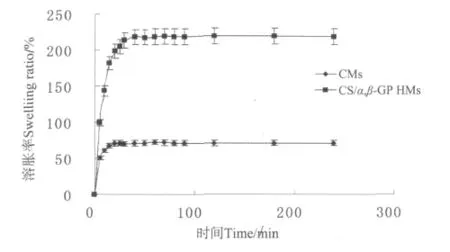
图3 CMs与CS/α,β-GP HMs的溶胀率Fig.3 The swelling ratio of CS/α,β-GP HMs
2.3 CS/α,β-GP HMs的蛋白吸附作用
如图4所示,2种微球对蛋白的吸附都经历了一个升高、降低、再上升高至平稳的过程,其原因可能是在吸附初期,微球对蛋白同时进行着物理吸附和化学吸附,吸附量逐渐增大,由于一些蛋白与微球结合的不牢固,在震荡的过程中出现了解吸附,因此吸附量出现了暂时的下降,而后化学吸附在蛋白吸附的过程中起主要作用,2种微球对蛋白的吸附量逐渐增加直至平稳。
1和24h测得CS/α,β-GP HMs的蛋白吸附量分别为13.21和15.68μg/g,远低于CMs的3.71×103和4.83×103μg/g。

图4 CS/α,β-GP H Ms和CMs的蛋白吸附作用Fig.4 Adsorption of BSA on CS/α,β-GP HMs and CMs
微球对蛋白的吸附过程中主要有3种作用发生,即疏水作用、静电作用和氢键相互作用[14]。壳聚糖本身的氨基使其带正电,此时静电吸引对蛋白吸附性能起主要作用,而α,β-GP的加入,一方面,使得磷酸根在氨基的周围产生了空间位阻,降低了游离氨基与蛋白中阴离子结合的几率,另一方面使得壳聚糖中的一部分游离氨基与磷酸根通过静电吸引相结合,从而大大减少了壳聚糖中与蛋白中阴离子结合的氨基数量,使得微球对蛋白的吸附量大大降低。
2.4 CS/α,β-GP HMs的血液相容性
图5为黏度为130cps、脱乙酰度(Degree of Deacetylation,DD)分别为69.5%、84%、93.7%的壳聚糖制成的CS/α,β-GP HMs的血液相容性结果。3h和6h测得的3种样品的溶血率均小于5%,脱乙酰程度越高,溶血率越高,这可能是因为随着CS的脱乙酰度提高,CS/α,β-GP HMs中能与红细胞膜表面的阴离子结合的氨基阳离子数量增多,导致溶血率增高[15]。

图5不同脱乙酰度CS/α,β-GP HMs的血液相容性Fig.5 The hemolysis of CS/α,β-GP HMs with different DD
图6为用脱乙酰度为(94±2)%,黏度分别为130,200和400cps的壳聚糖制成的CS/α,β-GP HMs的血液相容性结果。6h测得的溶血率分别为3.17%、3.84%和4.32%,壳聚糖的黏度越大,CS/α,β-GP HMs的溶血率越高。
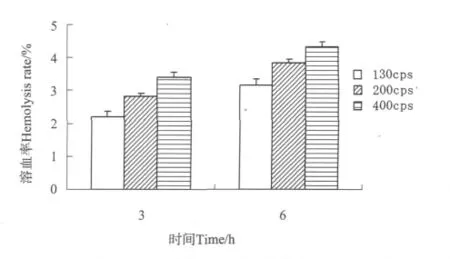
图6 不同黏度CS/α,β-GP HMs的血液相容性Fig.6 The hemolysis of CS/α,β-GP HMs with different dynamic viscosity
血液中微球浓度为1 mg/3 m L和10 mg/3 m L样品的6 h溶血率分别为1.93%和2.81%,溶血率均小于5%,溶血率随着CS/α,β-GP HMs用量的增加而升高(见图7)。
不同材料制得的CS/α,β-GP HMs溶血率测试结果说明,制得的材料均是安全的,符合医用材料对于血液相容性的要求。
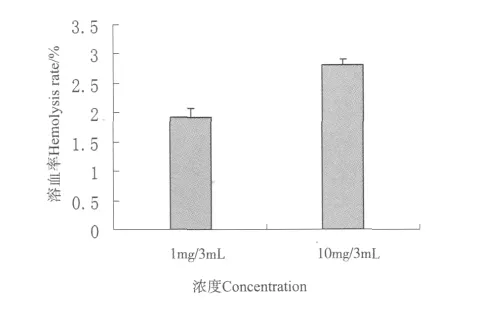
图7 不同浓度下CS/α,β-GP HMs的血液相容性Fig.7 The hemolysis of CS/α,β-GP HMs with different concerntrations
2.5 CS/α,β-GP HMs的体外降解性
壳聚糖的分子链上随机排列着2种残基,即,N-乙酰氨基葡萄糖和氨基葡萄糖,溶菌酶的活性部位对这2种残基有识别作用[16],能够进行水解。因此N-乙酰氨基葡萄糖基团和氨基葡萄糖基团的数量和分布能够显著影响溶菌酶对CS/α,β-GP HMs的降解速度和程度[17]。Are研究发现N-乙酰氨基葡萄糖在酶解中起重要作用,而单一的氨基葡萄糖的存在不会引发酶解反应,因此,脱乙酰程度过低和过高都不利于酶降解的进行[18-19]。
图8为由黏度为130cps、脱乙酰度分别为69.5%、84%、93.7%的壳聚糖制得的CS/α,β-GP HMs的体外降解情况。脱乙酰度为69.5%、84%和93.7%的微球4周累计降解率分别为76%、59.67%和48.33%。其中脱乙酰度为69.5%的样品降解速率最快,脱乙酰度为93.7%样品降解率最慢。张立彦等对脱乙酰度从54.12%~89.12%的壳聚糖样品的酶降解性进行了研究,结果发现脱乙酰度在70%左右的样品具有最好的酶降解性[17],这与本实验结果一致。
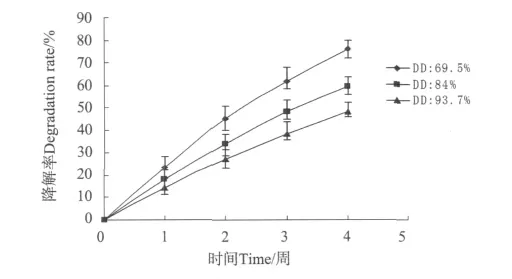
图8 不同脱乙酰度CS/α,β-GP HMs的体外降解Fig.8 Degradation of CS/α,β-GP HMs with different DD
图9为用脱乙酰度为(94±2)%,黏度分别为130、200和400cps的壳聚糖制得的CS/α,β-GP HMs的酶解情况,样品的4周累计降解率分别为48.33%、32%和13.67%,相同条件下,黏度越大,降解速度越慢,降解率越低。这可能是因为壳聚糖黏度越大,分子量越大,分子交联密度越大,壳聚糖中含有的氨基越多,分子间的氢键作用力越强,且结合的越牢固,难以被破坏,同时分子运动受到更大的阻力,增加了已被降解的小分子碎片游离出来的难度。
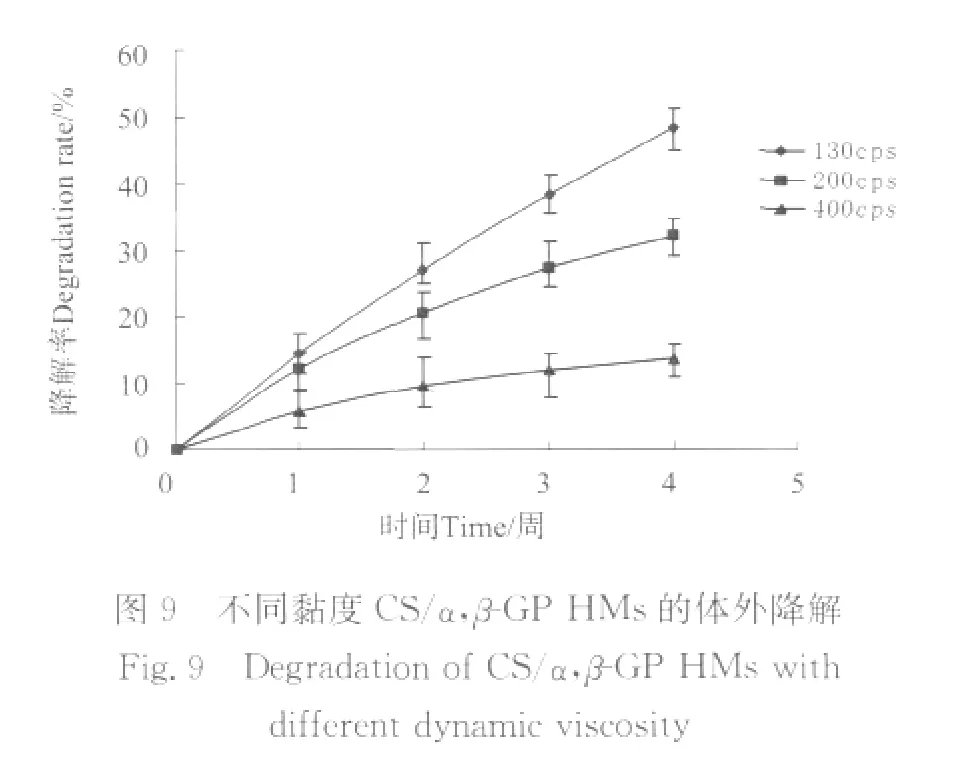

图10为不同浓度溶菌酶溶液中CS/α,β-GP HMs的酶降解情况。降解第1周,2组微球的降解率无明显差别,第2周开始,50μg/m L的溶菌酶作用下的微球的降解速率明显增大,至第4周时仍表现出较强的降解趋势。10μg/m L的溶菌酶作用下的微球在第3周降解率达到40.69%,以后降解率开始下降,第4周降解率仅增加了2.03%,说明酶活性开始下降。第1周内2种试验组的降解率差别微小,可能是因为在制备过程中,微球的表面形成了一层较内部结构相比更为致密和结实的保护膜,增加了降解的难度和时间,使得2组微球的降解率相似;从第2周开始,高浓度溶菌酶的试验组显示了更强的酶活力,降解速率显著大于低浓度溶菌酶试验组,这是因为随着CS/α,β-GP HMs表层的致密结构被水解和破坏,溶菌酶的有效分子能够更多的进入到结构相对疏松的微球内部,更有效的与壳聚糖的N-乙酰氨基葡萄糖和氨基葡萄糖作用进行水解反应。此时,降解速率与酶的浓度成正比。第4周时,溶菌酶浓度为10μg/m L的试验组的降解率明显下降,这也许是因为在前3周酶对壳聚糖的降解中,生成了大量的还原性产物,并生成了部分小分子物质,随着产物的积累和底物的减少,以及酶部分失活,导致反应速率降低。
壳聚糖的脱乙酰度、黏度以及溶菌酶浓度对CS/α,β-GP HMs的体外降解产生较大影响。相同条件下,脱乙酰度为70%左右的壳聚糖CS/α,β-GP HMs具有最高的降解率,脱乙酰度过高或者过低都会降低CS/α,β-GP HMs的降解速率;壳聚糖黏度越大,所制得的CS/α,β-GP HMs的降解速率越慢;提高酶浓度能够增大壳聚糖CS/α,β-GP HMs的降解速率。
3 结语
本研究成功制备了壳聚糖/α,β-甘油磷酸凝胶微球,微球的形态圆整,分散性良好,粒径主要分布在100~400μm,具有良好的溶胀性能,蛋白吸附率低,血液相容性佳,能在溶菌酶溶液中降解。壳聚糖的黏度和脱乙酰度影响微球的性质。该微球的理化性质符合栓塞材料的初步要求,通过进一步优化改进,有望成为一种新型的生物材料。
[1] 沈俊杰,陈自谦,曹建民,等.血管介入栓塞剂的临床应用和研究进展[J].医学研究生学报,2004,17(5):471-473.
[2] Kai Y,Hamada J,Morioka M,et al.The utility of the microcrystalline cellulose sphere as a particulate embolic agent:an experimental study[J].American Journal of Neuroradiology,2000,21(6):1160-1163.
[3] Hidaka K,Nakamura M,Osuga K,et al.Elastic characteristics of microspherical embolic agents used for vascular interventional radiology[J].Journal of the mechanical benaviur of liomedical materials,2010,3(7):497-503.
[4] Beaujeux R,Laurent A,Wassef M,et al.Trisacryl gelatin microspheres for therapeutic embolization,Ⅱ:preliminary clinical evaluation in tumors and arteriovenous malformations[J].American Journal of Neuroradiology,1996,17(3):541-548.
[5] 郭再玉,马廉亭.神经外科血管内治疗颗粒性栓塞材料的研究现状及展望[J].国际神经病学神经外科学杂志,2008,35(2):172-174.
[6] 王爱红.壳聚糖及其乙酰化衍生物微球用于动脉栓塞材料的实验研究[D].青岛:中国海洋大学,2009.
[7] 于开涛,峰兴华.介入栓塞用微球制剂的应用和研究进展[J].介入放射学杂志,2002,11:132-134.
[8] 蒋挺大.甲壳素[M].北京:中国环境科学出版社,1995.
[9] 秦建民,李荫太,胡新,等.顺铂壳聚糖淀粉微球兔胃动脉栓塞的实验研究[J].中华普通外科杂志,2000,15(2):91-94.
[10] 蒲永林,赵延乐,朱建钢,等.顺铂壳聚糖微球肝动脉栓塞化疗的动物实验和治疗肝癌的临床研究[J].北京医科大学学报,1995,27(5):381-383.
[11] 于跃芹,许洋,李延顺.壳聚糖交联温敏性水凝胶的制备与性能[J].高分子材料科学与工程,2009,25(7):133-139.
[12] Yun Pu W,Zhi Wen L.Preparation and Characteration of Chitosan-sodium Caseinate hydrogels[C].Zhengzhou:10th international symposium on biotechnology,metal complexes and catalysis,2008:12-16.
[13] 季兴敏.环境敏感水凝胶的溶胀动力学理论及药物释放动力学研究[D].武汉:武汉理工大学,2007.
[14] Bhattarai N,Gunn J,Zhang M Q.Chitosan-based hydrogels for controlled,localized drug delivery[J].Advanced Drug Delivery Reviews,2010,62(14):83-99.
[15] 王启钊,陈西广,刘成圣,等.壳聚糖的血液相容性[J].中国生物工程杂志,2005,25(增刊):194-198.
[16] 徐磊.壳聚糖-磷酸甘油凝胶系统应用于内耳局部给药的实验研究[D].济南:山东大学,2010.
[17] 张立彦,曾庆孝,李作为.溶菌酶降解壳聚糖条件的研究[J].功能高分子学报,2004,17(3):391-395.
[18] Kristiansen A,Varum K M,Grasdalen H,et al.The interactions between highly de-N-acetylated chitosans and lysozyme from chicken egg white studied by 1H-NMR spectroscopy[J].European Journal of Biochemistry,1998,251(1-2):335-342.
[19] 董岸杰,孙多先.壳聚糖的水解反应动力学研究[J].高分子材料科学与工程,2000,16(2):41-43.
Preparation and Physiochemical Characterization of Chitosan/α,β-Glycerophosphate Hydrogel Microspheres
ZANG Hui-Di,CHENG Xiao-Jie,LI Yang,LI Jing,CHEN Xi-Guang
(College of Marine Life Science,Ocean University of China,Qingdao 266003,China)
A new kind of hydrogel microspheres(CS/α,β-GP HMs))was prepared by emulsion method.Liquid paraffin and chitosan/α,β-glycerophosphate gel solution were used as oil phase and aqueous phase respectively.The morphology of CS/α,β-GP HMs were round with smooth surface.The scanning electron microscopy(SEM)photographs showed that CS/α,β-GP HMs were coated with a layer of comparative dense membrane,and their internal part presented a clearly three-dimensional-network structure.The size of the particles was mainly distributed in the 100~400 m;the swelling rate was 218.08%after the microspheres were soaked in the PBS buffer fluid with the p H7.4,while the swelling rate of chitosan microspheres(CMs)was 70.98%;the amount of protein adsorbed by CS/α,β-GP HMs for 1h and 24h was 13.21μg/g and 15.68μg/g,respectively,while the CMs was 3.71×103μg/g and 4.83×103μg/g;each kind of CS/α,β-GP HMs,prepared with different materials,showed a good blood compatibility,that the hemolysis rate was less than 5%.The deacetylation degree,the molecular weight of chitosan and lysozyme solution concentration influenced the vitro degradation rate of CS/α,β-GP HMs.
chitosan;α,β-glycerophosphate;hydrogel microspheres;characterization
R318.08
A
1672-5174(2012)09-035-06
青岛市市南区科技发展计划项目(2009-2-15-HY)资助
2011-03-31;
2012-05-03
臧惠迪(1985-),女,硕士,研究方向:海洋生物材料
**通讯作者:E-mail:xgchen@ouc.edu.cn
责任编辑 朱宝象

