一个Ds插入标签基因OsPI-PLC2的分子鉴定及表达分析
高志超,栾维江
(天津师范大学a.生命科学学院,b.天津市细胞遗传与分子调控重点实验室,天津 300387)
一个Ds插入标签基因OsPI-PLC2的分子鉴定及表达分析
高志超,栾维江
(天津师范大学a.生命科学学院,b.天津市细胞遗传与分子调控重点实验室,天津 300387)
在前期构建的水稻转座子标签插入突变体库中,鉴定了一个没有明显表型变化的Ds转座子标签系,发现Ds标签插入到一个编码磷脂酰肌醇磷脂酶C(PI-PLC)基因的第6个内含子中,分析该基因编码的氨基酸序列发现其含有已知的PI-PLC所具有的典型的X、Y和C2-like保守结构域,与已知的其它植物的PI-PLC蛋白有较高的同源性.另外,利用RT-PCR对该基因进行了表达分析,结果表明该基因在正常条件下表达量很低,但在胁迫条件下(机械损伤、盐、干旱、低温)或一些信号分子(SA、ABA)的诱导下大量表达,表明该基因参与植物对不良环境条件的信号转导途径,对于植物抵御不良环境条件具有重要作用.
水稻;Ds转座子标签;OsPI-PLC2;表达分析
磷脂酰肌醇磷脂酶C(PI-PLC)是磷脂酰肌醇信号转导通路中的关键酶,它可以催化质膜上的磷脂酰肌醇水解并产生2个第二信使因子:1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DAG).IP3可以使细胞内的Ca2+释放到细胞溶质中,从而使细胞溶质中的Ca2+浓度提高;DG可以激活蛋白激酶C使底物蛋白磷酸化,提高细胞内的pH值及IP3浓度[1].细胞中一系列的信号转导是通过质膜上的受体G蛋白完成的.通过这条通路就可以引起细胞对外界信号的应答,从而使细胞外的刺激转换为细胞内的信号.在植物中,PI-PLC基因已在不同的物种中被克隆,包括拟南芥[2-3]、马铃薯[4]、大豆[5]、碗豆[6]、绿 豆[7]、水 稻[8]、烟 草[9]、玉 米[10]和 苔藓[11]等.目前在植物中所克隆的PI-PLC基因都含有X、Y和C2-like保守结构域,类似于哺乳动物中的δ型PI-PLC,但缺失在哺乳动物中负责PI-PLC膜定向的PH结构域及结合Ca2+的EF-hand结构域.植物中的PI-PLC基因有两种表达方式:一种是组成型表达,如AtPI-PLC2基因,正常条件下可以在各个植物器官中表达[2];另一种是诱导型表达,常常在一些非生物胁迫(包括化学渗透、盐环境、缺氧、干旱胁迫、低温、氧化剂胁迫)诱导下及病虫害条件下激活其表达[3,8,12-15].PI-PLC基因除了在植物信号转导中发挥重要作用外,一些重要的生理作用也被揭示.PI-PLC基因不但可以通过ABA调节气孔的开闭[16-17],而且还可以介导植物的向地性及向光性反应[18-20].另外,Repp等[20]报道在苔藓中PI-PLC基因介导细胞分裂素信号传导,通过基因替换敲除PI-PLC基因后植株表现对细胞分裂素钝感,而且改变了质体的分化,减少了叶绿素的水平.Song等[8]首先从水稻中分离了OsPI-PLC1基因,并分析了其在化学和生物的条件诱导下植物所表现出对不良环境的保护反应.本研究利用玉米转座子Ac/Ds标签系统鉴定出一个磷脂酰肌醇磷脂酶C基因OsPI-PLC2,并分析了该基因在不同诱导条件下的表达.
1 材料与方法
1.1 材料
粳稻品种日本晴(Oryza sativa L.ssp.Japonica cv.Nipponbare);OsPI-PLC2插入标签系47-1,标签系47-1来自于构建的水稻插入突变体库[21].
1.2 方法
1.2.1 水稻基因组DNA的提取
水稻基因组DNA的提取采用卢扬江等[22]的方法,并略作如下改动:吸出的上清中加入0.6倍体积的异丙醇混匀后,室温放置15min.待白色絮状沉淀出现后,10 000r/min离心6min,弃上清后倒置于吸水纸上10min后,于超净台上吹干.吹干的DNA加入200μL重蒸水溶解后,于-20℃冰箱中保存备用.
1.2.2 插入标签旁侧序列的获得
OsPI-PLC2 标 签 系 旁 侧 序 列 用 Tail-PCR(Thermal Asymmololetric Interlaced PCR)[23]扩增获得.Tail-PCR所用Ds5’端3个巢式引物及简并引物序列为:Ds5’-1,5’-GGTGAAACGGTCGGGAAACTAGCTCTAC-3’;Ds5’-2,5’-TCCGTTCCGTTTTCGTTTTTTACCTCG-3’;Ds5’-3;5’-CGGTCGGTACGGGATTTTCC-3’;AD1,5’-NTCGASTWTSGWGTT-3’.扩增第3轮产物经1.2%(质量分数)琼脂糖凝胶电泳检测后,再用UNIQ-10柱式纯化试剂盒(上海生工生物工程公司)纯化后送上海生工生物工程有限公司测序,测序结果在NCBI核酸数据库(http://www.ncbi.nlm.nih.gov/BLAST/)中进行BLAST比对后定位于水稻基因组中的BAC或PAC克隆中.
1.2.3 旁侧序列的PCR验证
旁侧序列定位于水稻基因组中后,利用其旁侧序列所在的PAC克隆P0683F12中的序列设计相应引物,与Ds5’端和Ds3’端特异引物组合扩增标签系47-1基因组DNA,扩增产物用琼脂糖凝胶电泳检测.引物序列为:PI-PLCF,5’-CATGCAGGTAACTAGTGCA-3’;PI-PLCR,5’-CGTCGTTAACTTCTGGGCTC-3’;Ds5’-3,5’-CGGTCGGTACGGGATTTTCC-3’;Ds3 ’-1, 5 ’-ACCCGACCGGATCGTATCGGT-3’.其中引物Ds5’-3与引物PI-PLCF可以扩增出约650bp的目的条带,引物Ds3’-1与引物PI-PLCR可以扩增出约500bp的目的条带.PCR反应体系为20μL,包含10~30ng基因组 DNA,1×PCR buffer,0.2 mmol/L dNTP,0.2μmol/L 引物,1UTaq DNA聚合酶,用重蒸水补至20μL.PCR程序如下:94℃/4min,运 行 30 次 循 环 的 94 ℃/30s,59℃/30s,72℃/30s,之后72℃/10min.
1.2.4 植物材料的诱导处理
需要诱导的植物材料(日本晴)生长在温室中(28℃,自然光条件下),当秧龄4周时用于诱导处理.
信号分子诱导:对植株分别喷施0.1mmol/L脱落酸(ABA)和1mmol/L水杨酸(SA)溶液,并在0、2、4、6、12、24、36h取叶片速冻于液氮中,然后保存于-70℃冰箱中备用.
机械伤害诱导:用钳子挤压植物叶片后分别在0.4、0.5、1、2、4、8、12h取叶片,并取未做伤害处理的植株叶片作对照.
盐胁迫诱导:水稻幼苗根系浸入200mmol/L的NaCl水溶液中,并于0、1、3、7、10、20、28h取样.
干旱胁迫诱导:水稻幼苗生长于撤去自由流动的水的周转箱中,在处理后1、2、3、4、5、6、7d取样,用正常灌水条件下的幼苗作对照.
低温胁迫诱导:水稻幼苗转入4℃可控光照冰箱(Haier SC-182A)中生长,分别在0、1、3、6、12、24、36h取样.
1.2.5 RT-PCR
总RNA采用 TRIzol(Invitrogen,USA)试剂提取,依照试剂说明书的操作步骤操作,提取的总RNA用DNase I(NEB,USA)消化后作为反转录模板.1μg的总RNA用RNA PCR Kit(AMV)Ver3.0试剂盒(TaKaRa,Dalian China)进行反转录,反转录体系依照试剂盒说明配制,反应条件为:30 ℃/10min,42 ℃/30min,99 ℃/5min,5℃/5min.1μL cDNA作为模板进行PCR反应,OsPI-PLC2特异引物序列为IPcF(5’-CACCCATGGAGCTCACATTA-3’)和IPcR(5’-CCGTCACCTTTAGTCTTGTC-3’).PCR 反应条件 为:94℃/3min,运行30次循环的94℃/30s,55℃/30 s,72℃/30s,之后72℃/10min.以水稻Actin作为内参对照基因,引物序列为:ActinF,5’-GACTCTGGTGATGGTGTCAGC-3’; ActinR,5’-GGCTGGAAGAGGACCTCAGG-3’.反应条件为:94℃/3min,运行26次循环的94℃/30s,60℃/30s,72℃/30s,之后72℃/10min.反应结束后,取10μL产物进行琼脂糖电泳检测,确认PCR产物.
2 结果分析
2.1 标签系OsPI-PLC2旁侧序列及插入位点
OsPI-PLC2插入标签系来自于构建的Ac/Ds标签系统插入突变体库[21],利用Tail-PCR扩增其旁侧序列(图1),旁侧序列BLAST比对后发现Ds标签插入到水稻基因组第5染色体的P0683F12克隆中一个预测编码磷脂酰肌醇磷脂酶C(PI-PLC)基因的内含子中(图2),故命名为OsPI-PLC2.该基因有8个外显子,7个内含子,Ds标签插入到较短的第6个内含子中,通过剪接编码成一个由598个氨基酸组成的蛋白质,即磷脂酰肌醇磷脂酶C.

图1 标签系OsPI-PLC2的旁侧序列Fig.1 Flaking sequence of OsPI-PLC2
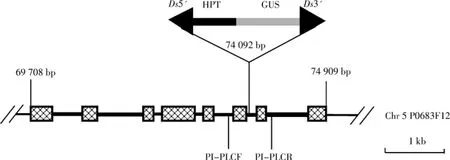
图2 Ds元件在标签系OsPI-PLC2中的插入位置Fig.2 Insertional position of Ds element in OsPI-PLC2tagging line
2.2 OsPI-PLC2标签系插入位点的验证
为了验证Ds元件插入位点的正确性,在Ds标签插入位点的左右两侧各设计一条引物PI-PLCF和PI-PLCR(图2),分别与Ds5’端和Ds3’端组成引物对,对OsPI-PLC2标签系和Ds亲本系(对照植株)进行PCR扩增,如果Ds标签插入到OsPI-PLC2基因中,则PI-PLCF和Ds5’引物对就能扩增出约650bp的目的条带,PI-PLCR和Ds3’引物对能扩增出约500bp的目的条带,如果Ds标签没有插入到OsPI-PLC2基因中,则不能得到相应的目的片段.PCR扩增结果如图3所示,可以看出在OsPI-PLC2标签系插入位点的5’端和3’端都得到了相应的目的片段,但在对照植株中没有扩增出目的片段,表明了插入位点的正确性.
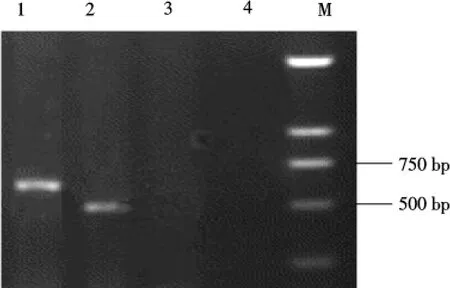
图3 插入位点PCR检测Fig.3 PCR detection for insertional position
2.3 OsPI-PLC2基因所编码蛋白质及同源性比较
图4为OsPI-PLC2蛋白质结构及其PI-PLC蛋白质系统发生树状比对图.

图4 OsPI-PLC2蛋白质结构及其PI-PLC蛋白质系统发生树状比对图a.OsPI-PLC2蛋白结构域;b.PI-PLC蛋白质系统发生树状图Fig.4 Structure and phylogenetic tree of the OsPI-PLC2 protein
图中不同植物PI-PLC蛋白的登录号:拟南芥(AtPI-PLC, AAK25916)、 水 稻 (OsPI-PLC1,AAK01711;OsPI-PLC2,XP_475563)、大豆(Gm-PI-PLC, AAA74441)、 碗 豆 (PsPI-PLC,CAA75546)、玉米(ZmPI-PLC,AAS45137)、马铃薯(StPI-PLC,CAA63954)、小立碗藓(PpPI-PLC,BAD02919).
序列分析表明OsPI-PLC2编码598个氨基酸的蛋白质,含有X、Y催化结构域及Ca2+依赖的蛋白质和磷脂相互作用C2-like结构域(图4a).X、Y结构域具有催化活性位点,可以催化质膜上的4,5-二磷酸磷脂酰肌醇(PIP2)水解产生1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DAG).C2-like结构域位于C端,含有Ca2+特异结合位点,可以激活蛋白激酶使底物蛋白磷酸化.BLAST分析结果表明:OsPI-PLC2蛋白质结构与目前植物中已知的PIPLC蛋白质具有40%~60%的同源性,都含有上述3个保守的结构域.同源比对发现:OsPI-PLC2蛋白质更相似于拟南芥PI-PLC蛋白质,2者在很近距离内聚为一类,但与水稻的OsPI-PLC1差异较大,在较远的距离内才能聚为一类,与苔藓植物的距离最远,两者蛋白质同源性仅为40%(图4b).
2.4 OsPI-PLC2基因的表达
利用RT-PCR对OsPI-PLC2基因的表达进行的研究表明,在正常生长条件下,OsPI-PLC2基因表达量很低,根据其他已知的PI-PLC基因的研究结果,笔者推测该基因可能受一些环境条件的诱导表达.为了探索OsPI-PLC2基因在外界环境条件诱导下的表达情况,作者分别用机械伤害、盐胁迫、干旱胁迫、低温胁迫环境条件诱导及脱落酸、水杨酸信号分子诱导处理后提取RNA,进行RTPCR反应,结果发现:OsPI-PLC2基因在上述条件的诱导下表达量较高,并在不同的时空条件下表达量有所差异,如图5所示.
在干旱胁迫条件下,处理2dOsPI-PLC2基因表达量达最大,之后有所下降,到第7天时表达很微弱;机械伤害后4hOsPI-PLC2基因表达量达峰值;低温胁迫下,OsPI-PLC2基因在处理1h时表达量就有所积累,到12h达峰值;在盐胁迫条件下,OsPI-PLC2基因在处理1h大量表达,3h后迅速下降,到处理28h后表达基本停止;脱落酸处理后4hOsPI-PLC2基因表达量达峰值,而用水杨酸处理后6h达峰值.上述结果表明:OsPI-PLC2基因是诱导型的表达方式,在一些非生物胁迫和信号分子的诱导下该基因大量表达,暗示了该基因参与植物在胁迫条件下信号传导和对不良外界环境的应答反应,这对研究植物抵御外界不良环境具有重要意义.
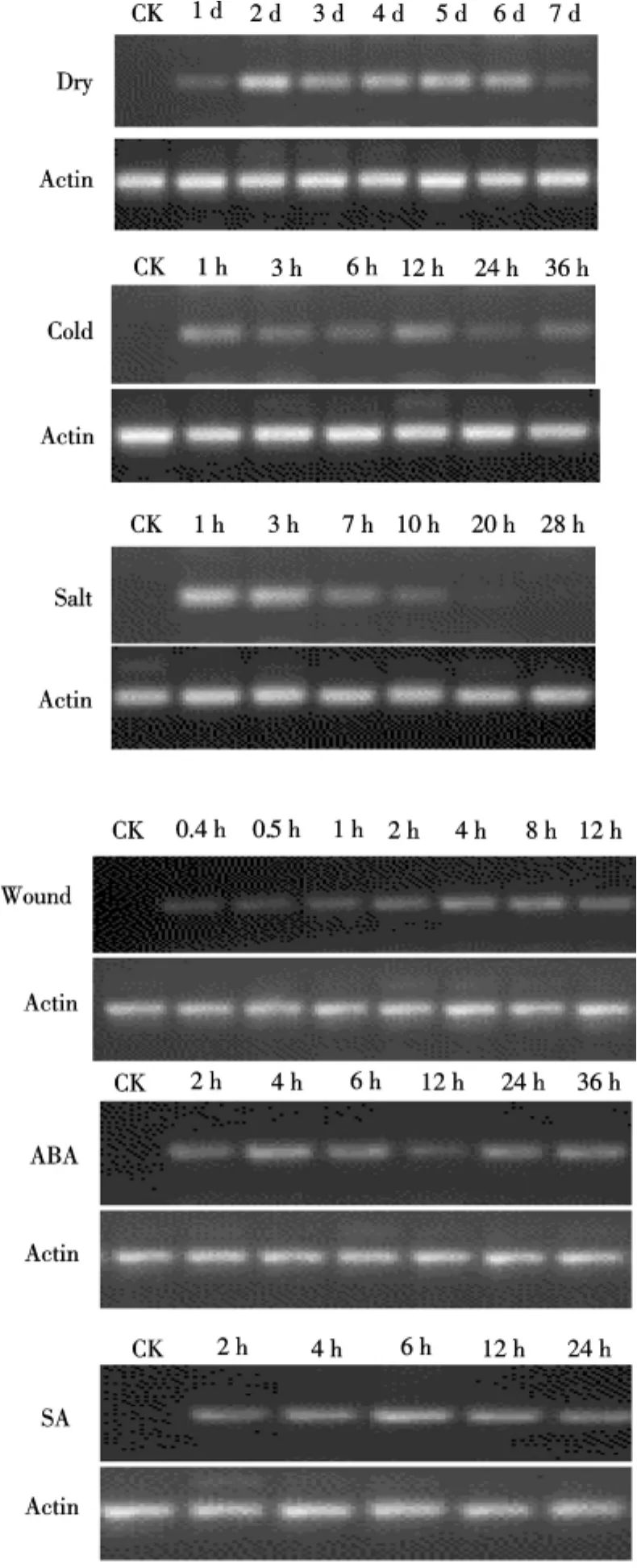
图5 不同条件诱导下的OsPI-PLC2基因的表达Fig.5 OsPI-PLC2expression profile in different induction conditions CK为正常生长条件下未做处理的植株
3 讨论
水稻全基因组测序完成为其功能基因组学研究提供了有利条件.Ac/Ds标签插入突变体库中,通过Tail-PCR方法可以方便获得标签插入位点的旁侧序列,经过BLAST搜寻已知的基因组数据库就可以将插入位点定位于水稻基因组中,从而克隆出由于标签的插入而发生突变的未知基因.本研究中的OsPI-PLC2基因就是利用这种方法鉴定的.Ds标签本身插入OsPI-PLC2基因中,但植株并不表现突变表型,通过已知的序列进行RT-PCR分析,探知其在外界环境条件或其它一些非生物胁迫条件的诱导下才大量表达,参与PI-PLC信号通路.由于基因突变并不表现其表型,用常规的方法(如图位克隆等)很难分离基因,因此利用标签法分离这些不引起表型变化的基因,然后利用反向遗传学探索基因的功能是一条可行的途径.
水稻中OsPI-PLC1已被克隆,该基因也是诱导型表达方式,可以表现出对不良环境的保护反应,尤其是对水稻稻瘟病的抗性诱导具有重要作用[8],本研究通过Ds标签所揭示的OsPI-PLC2也是诱导型的表达方式,从其编码的蛋白质的氨基酸序列上可以看出,虽然二者都含有X、Y催化结构域及Ca2+依赖的蛋白质和磷脂相互作用C2-like结构域,但同源比对发现,OsPI-PLC2与拟南芥的PI-PLC基因更相似,与水稻的OsPI-PLC1同源性较低.这种序列上差异暗示了PI-PLC基因可能还有除了PI-PLC信号通路之外其他方面的功能.例如小立碗藓的PpPI-PLC在同源比对中自成一类,与其他植株的同源性较低,这反映出其在功能上的特殊性,利用反向遗传学发现该基因参与了细胞分裂素信号途径,敲除该基因对重力表现敏感反应.另外还发现燕麦的PI-PLC蛋白参与了根的细胞骨架的建成[24].最近研究发现,拟南芥AtPLC9能参与对环境温度条件的响应,与野生型相比,atplc9突变体表现温度敏感的表型,减少了对热击反应的耐性;而AtPLC9过表达转基因株系表现对温度耐性加强[25].水稻中对于PI-PLC蛋白的研究鲜见报道,目前水稻OsPI-PLC2确切的功能尚不清楚.总的来说,对于植物中的PI-PLC基因的功能绝大多数研究还仅局限于它的PI-PLC信号通路方面的积累,因此对于植物PI-PLC基因的其它功能还有待进一步深入研究.
[1] 汪堃仁,薛绍白,柳惠图.细胞生物学[M].北京:北京师范大学出版社,2002:421-426.
[2] HIRAYAMA T,MITSUKAWA N,SHIBATA D,et al.At-PI-PLC2,agene encoding phosphoinositide-specific phospholipase C,is constitutively expressed in vegetative and floral tissues in Arabidopsis thaliana[J].Plant Mol Bio,1997,34(1):175-180.
[3] HIRAYAMA T,OHTO C,MIZOGUCHI T,et al.A gene encoding aphosphatidylinositol-specific phospholipase C is induced by dehydration and salt stress in Arabidopsis thaliana[J].Proc Natl Acad Sci,1995,92(9):3903-3907.
[4] KOPKA J,PICAL C,GRAY J E,et al.Molecular and enzymatic characterization of three phosphoinositide-specific phospholipase C isoforms from potato[J].Plant Physiol,1998,116(1):239-250.
[5] SHI J,GONZALES R A,BHATTACHARYYA M K.Characterization of a plasma membrane-associated phopshinositidespecific phospholipase C from soybean[J].Plant J,1995,8(3):381-390.
[6] VENKATARAMAN G,GOSWAMI M,TUTEJA N,et al.Isolation and characterization of a phospholipase C delta isoform from pea that is regulated by light in a tissue specific manner[J].Mol Genet.Genomics,2003,270(5):378-386.
[7] KIM Y J,KIM J E,LEE J H,et al.The Vr-PLC3gene encodes a putative plasma membrane-localized phosphoinositidespecific phospholipase C whose expression is induced by abiotic stress in mung bean (Vigna radiata L.)[J].FEBS Lett,2004,556(1):127-136.
[8] SONG F,GOODMAN R.Molecular clone and characterization of rice phosphoinositide-specific phospholipase C,OsPIPLC1,that is activated in systemic acquired resistance[J].Physiol Mol Plant Pathol,2002,61(1):31-40.
[9] PICAL C,KOPKA J,MULLER-ROBER B,et al.Isolation of two cDNA clones for phosphoinositide specific phospholipase C from epidermal peels(accession no.X95877)and guard cells(accession no.Y11931)of Nicotiana rustica[J].Plant Physiol,1997,114(2):747-753.
[10]ZHAI S,SUI Z,YANG A,et al.Characterization of a novel phosphoinositide-specific phospholipase C from Zea mays and its expression in Escherichia coli[J].Biotechnology Letters,2005,27(11):799-80.
[11]MIKAMI K,REPP A,Graebe-Abts E,et al.Isolation of cDNAs encoding typical and novel types of phosphoinositide-specific phospholipase C from the moss Physcomitrella patens[J].J Ex p Bot,2004,55(401):1437-1439.
[12]DEWALD D B,TORABINEJAD J,JONES C A,et al.Rapid accumulation of phosphatidylinositol 4,5-bisphosphate and inositol 1,4,5-trisphosphate correlates with calcium mobilization in salt-stressed Arabidopsis[J].Plant Physiol,2001,126(2):759-769.
[13]LEGENDRE L,YUEH Y G,CRAIN R,et al.Phospholipase C activation during elicitation of the oxidative burst in cultured plant cells[J].J Biol Chem,1993,268(33):24559-24563.
[14]REGGIANI R,LAORETI P.Evidence for the involvement of phospholipase C in the anaerobic signal transduction[J].Plant Cell Physiol,2000,41(1):1392-1396.
[15]TAKAHASHI S,KATAGIRI T,HIRAYAMA T,et al.Hyperosmotic stress induces a rapid and transient increase in inositol 1,4,5-trisphosphate independent of abscisic acid in Arabidopsis cell culture[J].Plant Cell Physiol,2001,42(2):214-222.
[16]HUNT L,MILLS L N,PICAL C,et al.Phospholipase C is required for the control of stomatal aperture by ABA[J].Plant J,2003,34(1):47-55.
[17]STAXEN I,PICAL C,MONTGOMERY L T,et al.Abscisic acid induces oscillations in guard-cell cytosolic free calcium that involve phosphoinositide-specific phospholipase C[J].Proc Natl Acad Sci,1999,96(4):1779-1784.
[18]HARADA A,SAKAI T,OKADA,K.Phot 1and phot 2mediate blue light-induced transient increases in cytosolic Ca2+differently in Arabidopsis leaves.Proc[J].Natl Acad Sci USA,2003,100(14):8583-8588.
[19]PERERA I Y,HEILMARM I,CHANG S C,et al.A role for inositol 1,4,5-trisphosphate in gravitropic signaling and the retention of cold-perceived gravistimulation of oat shoot pulvini[J].Plant Physiol,2001,125(3):1499-1507.
[20]REPP A,MIKAMI K,MITTMANN F,et al.Phosphoinositide-specific phospholipase C is involved in cytokinin and gravity responses in the moss Physcomitrella patens[J].Plant J,2004,40(2):250-259.
[21]LUAN W J,HE C K,HU G C,et al.An efficient fieldscreening procedure for identifying transposants for constructing an Ac/Ds based insertional-mutant library of rice[J].Genome,2008,51(1):41-49.
[22]卢扬江,郑康乐.一种简易的水稻基因组DNA的提取方法[J].中国水稻科学,1992,6(1):47-48.
[23]LIU Y G,MITSUKAWA N,OOSUMI T,et al.Efficient isolation and mapping of Arabidopsis thaliana T-DNA insert junctions by thermal asymmololetric interlaced PCR[J].Plant J,1995,8(3):457-463.
[24]HUANG C H,CRAIN R C.Phosphoinositide-specific phospholipase C in oat roots:Association with the actin cytoskeleton[J].Planta,2009,230(5):925-33.
[25]ZHENG S Z,LIU Y L,LI B,et al.Phosphoinositide-Specific phospholipase C9is involved in the thermotolerance of Arabidopsis[J].Plant J,2012,69(4):689-700.
Characterization and expression analysis of aDs-tagging lineOsPI-PLC2in rice
GAOZhi-chao,LUANWei-jiang
(a.College of Life Science,b.Tianjin Key Laboratory of Cyto-Genetical and Molecular Regulation,Tianjin Normal University,Tianjin 300387,China)
ADs-tagging lineOsPI-PLC2without phenotype change was characterized by rice insertional mutant library.Ds-tag inserted into the sixth intron ofOsPI-PLC2gene which encoded a phosphoinositide-specific phospholipase C protein.The sequence analysis showed that OsPI-PLC2protein contained typical X,Y and C2-like domains which were very conservative in known PI-PLC protein and had high homology with known PI-PLC proteins of other plants.Moreover,the expression pattern ofOsPI-PLC2gene was further investigated by using RT-PCR,and it was demonstrated thatOsPI-PLC2gene exhibited weak expression in normal condition but exhibited strong expression in wound,salt,dry,cold,salicylic acid(SA)and abscisic acid(ABA)induction conditions,suggesting thatOsPIPLC2gene played an important role in stress signal transduction pathway and resisting harmful environment.
rice;Ds-tag;OsPI-PLC2;expression analysis
Q943
A
1671-1114(2012)03-0085-06
2011-12-09
天津市自然科学基金重点资助项目(11JCZDJC17900);天津市教委资助项目(20090609);天津师范大学青年骨干教师学术创新推进计划资助项目(52X09039)
高志超(1987—),男,硕士研究生.
栾维江(1971—),男,副教授,主要从事水稻功能基因组学方面的研究.
(责任编校 纪翠荣)

