生物发光快速测定生乳菌落总数的方法
宋子明,孙中锋,侯彩云,史海莹,金江玉,刘思露
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.教育部北京市共建功能乳品重点实验室,北京 100083;3.北京润德康泰生物科技有限公司,北京 100176)
生物发光快速测定生乳菌落总数的方法
宋子明1,2,孙中锋3,侯彩云1,2,史海莹1,2,金江玉1,2,刘思露3
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.教育部北京市共建功能乳品重点实验室,北京 100083;3.北京润德康泰生物科技有限公司,北京 100176)
为消除利用ATP生物发光法测定生乳菌落总数时非细菌ATP对测定结果的干扰,建立了一种样品前处理方法。利用ATP生物发光法对经过前处理的生乳样品进行检测,结果表明,生乳菌落总数对数值与生乳细菌ATP发光对数值呈现较好的线性关系 (R2=0.982),相关程度为显著相关(P<0.01),说明该前处理方法能够有效排除非细菌ATP的干扰,有利于提高ATP生物发光法定量测定生乳菌落总数准确性。
ATP生物发光法;生乳;菌落总数
0 引 言
生物发光法能够快速测定微生物数量,其反应机理[1]是:荧光素酶以荧光素、ATP和O2为底物,在Mg2+存在时,将化学能转化为光能,发出光量子。ATP既是荧光素酶催化发光的必需底物,又是生物生命活动的能量来源,存在于所有活体细胞中。ATP在一定的浓度范围内,其浓度与发光强度呈线性关系[2],各生长时期的细菌又有较恒定水平的ATP含量[3]。而当微生物死亡后,在细胞内酶的作用下,ATP会很快被分解。因此,可用生物发光法来测定活菌数。
生乳中含有一定量的游离ATP和大量的体细胞,在提取细菌ATP时,也会将体细胞中的ATP提取出来,而以体细胞ATP为主的非细菌ATP量远远高于细菌,会干扰细菌ATP的测定。本研究建立了一种样品前处理方法,能够有效排除非细菌ATP的干扰。
1 材料与方法
1.1 设备与材料
RBL-1生物发光微生物检测仪,MK320干式恒温器,D-37520高速离心机。
体细胞ATP提取剂 (SAE),细菌ATP提取剂(BAE),发光检测液,小鼠骨髓瘤细胞,生乳。
1.2 方法
1.2.1 体细胞ATP提取剂对细菌的影响
取100 μL生乳,均匀涂布于平板计数琼脂培养基上,表面水分干燥后,将平板翻转,置于37℃恒温培养箱中,培养24 h。用无菌超纯水反复冲洗琼脂培养基表面,吸取100 μL生乳细菌,加入液态培养基中,37℃条件下震荡培养4小时,得到生乳细菌的培养液。
取1 mL生乳细菌培养液,12 000 r/min离心1 min,弃上清,加入1 mL无菌超纯水复溶。重复以上操作两次,以除去死亡的细菌和游离ATP。取100 μL生乳细菌,加入到100 μL体细胞ATP提取剂(SAE)或细菌ATP提取剂(BAE)中,于25℃条件下分别反应1,10,20,30 min。 取50 μL反应液,加入到1 mL发光检测液中,测发光值。以生乳细菌加入无菌超纯水的发光值作为对照。
1.2.2 生乳中非细菌ATP的干扰因素的排除
取1 mL小鼠骨髓瘤细胞培养液(体细胞计数为1×106mL-1),2 000 r/min离心5 min,弃上清,加入1 mL无菌生理盐水复溶。再次2 000 r/min离心5 min,弃上清,加入1 mL无菌生理盐水复溶。取100 μL小鼠骨髓瘤细胞液与100 μL体细胞ATP提取剂混合,于25℃条件下分别反应1,5,10,15,20,30 min。 取反应液50 μL加入到1 mL发光检测液中,测定发光值。
取100 μL生乳与100 μL体细胞ATP提取剂混合,于25℃条件下分别反应1,5,10,15,20,30,40,50,60 min。取反应液50 μL加入到1 mL发光检测液中,测定发光值。
1.2.3 ATP生物发光法测定生乳中的菌落总数
取两支离心管,分别加入生乳样品50 μL,加入体细胞ATP提取剂50 μL,混匀,25℃条件下反应30 min。30 min后,向一支离心管中加入无菌超纯水100 μL,向另一支离心管中加入细菌ATP提取剂100 μL,25℃条件下反应1 min。分别取两支离心管中反应液50 μL,加入到1 mL发光检测液中,测定发光值,计算两份反应液发光值之差,即为生乳中细菌ATP的发光值。
对ATP生物发光法测定过的生乳样品细菌进行平板计数,具体步骤如下:用无菌超纯水将生乳样品10倍梯度稀释,根据对样品中细菌量的估计,选择2~3个稀释度的样品稀释液,吸取样品稀释液100 μL,均匀涂布于平板计数琼脂培养基上,每个稀释度做3个平行。37℃培养24 h。选取菌落数在30~300 mL-1之间、无蔓延菌落生长的平板计数菌落总数,每个稀释度的菌落数取3个平板的平均数。
2 结果与分析
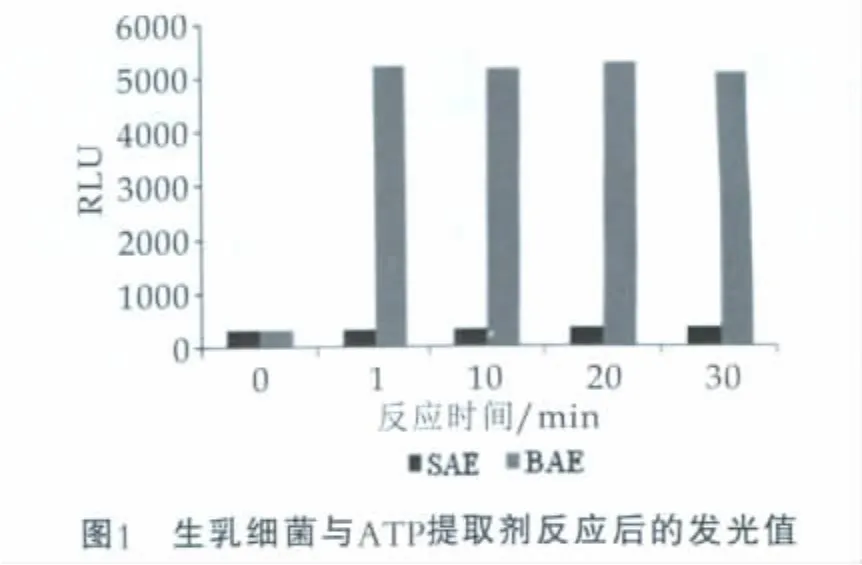
2.1 体细胞ATP提取剂对细菌的影响
当反应时间分别为1,10,20,30 min时, 以反应时间为横坐标,以相应的发光值(RLU)为纵坐标,所得结果如图1所示。由图1可以看出,加入体细胞ATP提取剂(SAE)的生乳细菌发光值随着反应时间的延长,没有明显变化,与空白对照组基本相同,说明体细胞ATP提取剂对生乳细菌无明显影响;加入细菌ATP提取剂(BAE)的生乳细菌发光值在1 min时,即达到峰值,在1 min后,随着反应时间的延长,发光值基本保持不变,说明细菌ATP提取剂对生乳细菌ATP的提取效果明显,1 min内即可完成生乳ATP的提取过程。
2.2 生乳中非细菌ATP的干扰因素的排除
当小鼠骨髓瘤细胞与体细胞ATP提取剂反应时间分别为1,5,10,15,20,30 min时,以反应时间为横坐标,以相应的发光值(RLU)为纵坐标,所得结果如图2所示。由图2可以看出,随着反应时间的延长,小鼠骨髓瘤细胞与体细胞ATP提取剂反应液的发光值逐渐降低,且30 min时的发光值远远低于1 min时的发光值。由于体细胞ATP提取剂的作用,体细胞ATP逐渐被分解,反应液中体细胞ATP量逐渐降低,且30 min时大部分体细胞ATP已被分解掉。

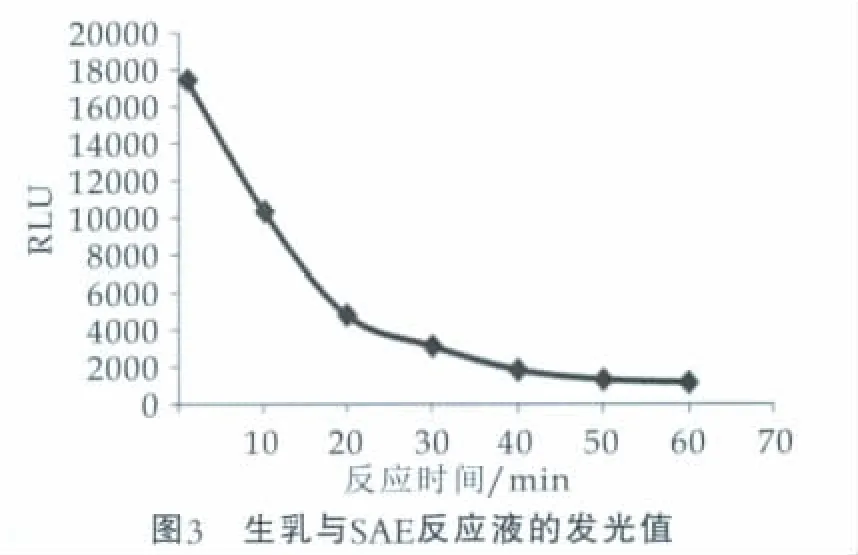
当生乳与体细胞ATP提取剂反应时间分别为1,10,20,30,40,50,60 min时, 以反应时间为横坐标,以相应的发光值(RLU)为纵坐标,所得结果如图3所示。
由图3可以看出,随着反应时间的延长,生乳与体细胞ATP提取剂反应液的发光值逐渐降低。30 min内发光值下降比较明显,30 min时剩余非细菌ATP的发光值已经降到一个相对较低的水平。由于体细胞ATP提取剂的作用,体细胞ATP逐渐被分解,反应液中体细胞ATP含量逐渐降低,且30 min时大部分体细胞ATP已被分解掉。
2.3 ATP生物发光法测定生乳中的菌落总数
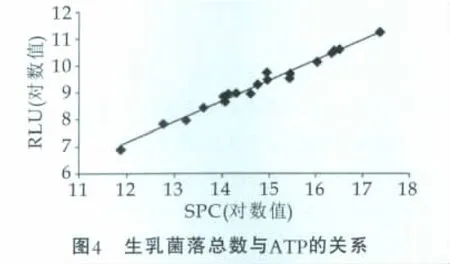
以生样品乳菌落总数的自然对数(SPC)为横坐标,以相应的生乳细菌ATP发光值的自然对数为纵坐标,所得曲线如图4所示,一元线性方程为Y=0.762X-1.983,R2=0.982,P<0.01。
生乳菌落总数对数值与生乳细菌ATP发光对数值呈现较好的线性关系(R2=0.982),相关程度为显著相关(P<0.01),表明本研究所用前处理方法能够有效排除非细菌ATP的干扰,有利于提高ATP生物发光法定量测定生乳菌落总数准确性。
3 讨 论
在利用ATP生物发光法测定生乳样品中菌落总数时,Samkutty等[4]利用体细胞ATP提取剂将体细胞中ATP提取出来,通过滤膜加压过滤,将非细菌ATP被滤掉,以此排除非细菌ATP的干扰。管勇佳等[5]在利用ATP生物发光法测定生乳样品中体细胞数时,为了排除生乳中游离ATP的干扰,首先测定生乳中游离ATP的发光值,然后向生乳中加入体细胞ATP提取剂,测其发光总值,最后用总值减游离ATP的发光值,得到体细胞中ATP的发光值。
本研究中,小鼠骨髓瘤细胞与体细胞ATP提取剂反应时,随着反应时间的延长,反应液的发光值逐渐降低,说明反应液中体细胞ATP逐渐被消除。在体细胞ATP提取剂提取ATP时,体细胞内的ATP水解酶或转化酶同时被释放出来[6],并将ATP水解或转化,因此可以利用体细胞自身的ATP水解酶或转化酶水解或转化非细菌ATP。生乳与体细胞ATP提取剂反应过程中,随着反应时间的延长,反应液的发光值逐渐降低,说明生乳中非细菌ATP逐渐被生乳体细胞内的ATP水解酶或转化酶水解或转化。且反应液的发光值30 min内下降比较明显,30 min时剩余非细菌ATP的发光值已经降到一个相对较低的水平,对生乳中细菌ATP含量测定的干扰相对较小。
本研究得到一种新的样品前处理的方法:生乳与体细胞ATP提取剂反应30 min,测得剩余非细菌ATP的发光值,作为样品本底值;然后加入细菌ATP提取剂,反应1 min,测得ATP发光值,作为总值;总值与样品本底值之差即为生乳中细菌ATP的发光值。利用ATP生物发光法对经过前处理的生乳样品进行检测,结果表明,生乳菌落总数对数值与生乳细菌ATP发光对数值呈现较好的线性关系(R2=0.982),相关程度为显著相关(P<0.01),说明该前处理方法能够有效排除非细菌ATP的干扰,有利于提高ATP生物发光法定量测定生乳菌落总数准确性。
4 结 论
本研究建立了一种生乳样品前处理的方法,大量生乳样品测定表明,该前处理方法能有效排除非细菌ATP的干扰,有利于提高ATP生物发光法定量测定生乳菌落总数的准确性。
[1]MCELROY W D,STREMER B L.Factors Influencing the Response of the Bioluminescent to Adenosine Triphosphate[J].Arch.Biochenl.,1949,22:420-433.
[2]LAROSSA R A.Methods in Molecular Biology,Vol.102:Bioluminescence Methods and Protocols,Totowa[M].New Jersey:Human Press,1998,3-20.
[3]D’EUSTACHIO A J,LEVIN E I.Levels of Adenosine Triphosphate During Bacterial Growth[M].Bacteriol Proc,1967,67:119.
[4]SAMKUTTY P J,GOUGH R H,ADKINSON R W,et al.Rapid Assessment of the Bacteyiological Quality of Raw Milk Using ATP Bioluminescence[J].J.Food Port.,2001,64(2):208-212.
[5]管勇佳,富鑫,陈晓义,等.ATP生物发光技术快速检测牛乳体细胞数[J].中国乳品工业,2010,38(9):49-50.
[6]YANG N Z,HO W M,CHEN Y H,et al.A Convenient One-Step Extraction of Cellular ATP Using Boiling Water for the Luciferin-Luciferase Assay of ATP[J].Analytical Biochemstry,2002,306:323-327.
Research on rapid assessment on aerobic bacterial count of raw milk using ATP bioluminescence
SONG Zi-ming1,2,SUN Zhong-feng3,HOU Cai-yun1,2,SHI Hai-ying1,2,JIN Jiang-yu1,2,LIU Si-lu3
(1.College of Food Science and Nutrition Engineering,China Agricultural University,Beijing 100083,China;2.Key Laboratory of Functional Dairy;Co-constructed by Ministry of Education and Beijing Municipality;Beijing 100083,China;3.Beijing Ruddock Biotech Co.,Ltd,Beijing,100176,China)
When assessing the aerobic bacterial count of raw milk using ATP bioluminescence,the results will be interfered by the abacterial ATP.A new pretreatment method was established in this research.Raw milk samples were pretreated before ATP determination,which was measured in relative light units(RLUs).And the Lumac ATP bioluminescence assay results were compared with standard plate counts(SPCs).The results indicated that ln-transformed SPCs in raw milk had linear correlation with ln-transformed RLUs(R2=0.982),and the correlation level was significant(P<0.01).It was indicated that the pretreatment method established in this research could eliminate interference from the abacterial ATP efficiently,which would increase the accuracy of quantitative determination of the aerobic bacterial count in raw milk using ATP bioluminescence.
ATP bioluminescence;raw milk;aerobic bacterial count
TS252.7
A
1001-2230(2012)09-0039-03
2012-01-04
科技部农业科技成果转化资金项目(2009360070450)。
宋子明(1986-),男,硕士,从事食品质量与安全方面的研究。
孙中锋

