苦马豆素人工抗原对家兔的免疫原性研究
王 帅,陈根元,胡建军,张 玲,马春晖
(新疆生产建设兵团塔里木畜牧科技重点实验室 塔里木大学动物科学学院,阿拉尔 843300)
苦马豆素(swainsonine,SW) 是豆科棘豆属(Oxytropis)和黄芪属(Astragalas)等疯草植物的主要有毒成分[1]。疯草在我国分布广泛,不利于畜牧业的可持续发展。目前对疯草蔓延采取的防除方法主要有人工挖除、化学药剂灭除等,但效果均不理想[2]。而且疯草为豆科植物,营养成分较为全面[3]。家畜采食疯草的初期增膘,可充分说明这一点。
目前利用免疫预防的方法使家畜安全利用疯草,已经成为国内的研究热点[4]。SW分子量小(173),属于半抗原,没有免疫原性,需要将SW与大分子载体蛋白(如BSA)偶联合成人工抗原(如SW-BSA),将合成的人工抗原用于动物免疫,即可诱导动物机体产生抗SW的特异性抗体,使动物获得对疯草的免疫力。试验用人工抗原SW-BSA免疫接种家兔,为制备SW高效价抗体、防治家畜疯草中毒奠定基础。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料与试剂 SW-BSA由新疆生产建设兵团塔里木畜牧科技重点实验室自行制备;弗氏完全佐剂(FAC),弗氏不完全佐剂(FAI),HRP-羊抗兔 IgG ,Sigma;3,3',5,5'-四甲基联苯胺(TMB),Amresco;其余常规试剂均为国产分析纯。
1.1.2 试验兔 土种家兔18只,雌雄各半,体重2.0 kg±0.1 kg,购自塔里木大学动物科学学院实验站。
1.1.3 仪器 PowerWave XS型全波长酶标仪,美国;MR231型高速冷冻离心机,法国Jouan;Direct-Q3型超纯水系统,美国Millipore;BCD-223GB型冰箱,广东科龙电器;FA/4A型电子天平,上海精密电子仪器有限公司。
1.2 试验家兔的处理
试验家兔进入兔舍前,先用84消毒液对兔舍消毒,然后药浴杀灭家兔体表寄生虫;观察7 d后饲喂左旋咪唑驱虫;第14天各兔皮下注射兔瘟疫苗(2 mL/只)。观察10 d后开始正式试验。将试验兔随机分组后打耳缺,18只兔平均分为对照组(A组)、免疫Ⅰ组(B组)、免疫Ⅱ组(C组),每组6只。
1.3 免疫试验
参考童德文等[5]的研究进行免疫试验,对各免疫组使用FAC进行基础免疫,再以相同免疫途径进行首免和加强免疫。各免疫组免疫剂量和次数见表1。攻毒对照组和正常对照组每次注射等体积的抗原乳化液。在每次免疫前1 d对所有试验家兔空腹采血2份,1份以肝素锂抗凝得抗凝血,1份制备血清。第3次加强免疫后每隔7 d采血1次,共采血10次。
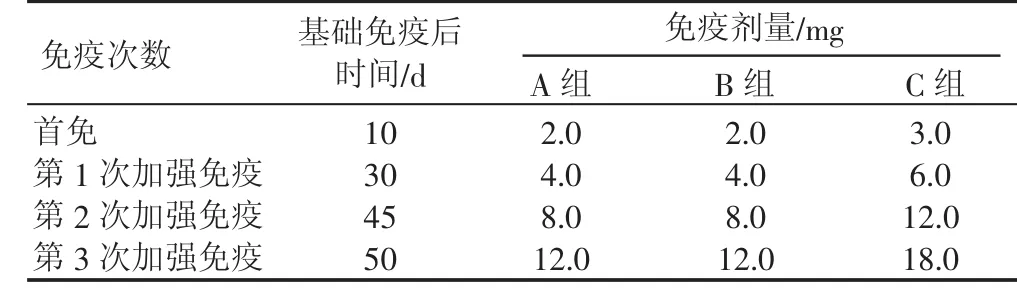
表1 各免疫组的免疫时间和免疫剂量
1.4 试验兔血清抗体效价的测定
应用间接血凝试验(IHA)和间接酶联免疫吸附试验(ELISA)检测试验兔血清抗体效价的变化。IHA条件参考童德文等[5]的研究,红细胞用30μg/L的SW致敏。ELISA条件参考 Watanabe等[6]的研究,测量样品 OD450值(P)与阴性对照孔OD450值(N),以P/N>2.1判定样品为阳性。
1.5 E-玫瑰花环试验
参考杨合生等[7]的研究,计数200个淋巴细胞,凡1个淋巴细胞结合3个红细胞或以上者为1个玫瑰花环阳性细胞,计算玫瑰花环形成率。
1.6 数据分析
试验数据用EXCEL 2007进行处理,数据分析用SPSS 11.5中One-Way ANOVA进行单因素方差分析,差异显著时采用LSD法进行多重比较。
2 结果与分析
2.1 间接IHA结果
间接IHA试验结果见图1。所有免疫家兔均在第1次加强免疫后产生了抗体,随着免疫次数的增加,免疫家兔的血清抗体滴度明显升高。第3次加强免疫后14 d达到最高值。2个免疫组家兔血清抗体变化趋势较为一致,但C组的抗体滴度值始终高于B组。对照组未检测到抗SW抗体存在。
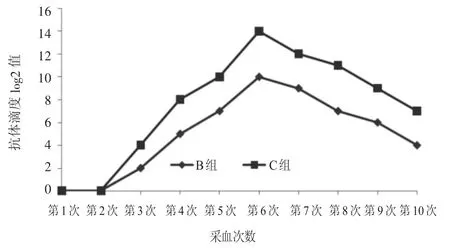
图1 IHA检测家兔血清抗SW抗体效价变化
2.2 间接ELISA结果
间接ELISA试验结果见图2。所有免疫家兔在第1次加强免疫后产生了抗SW抗体,2个免疫组家兔血清抗体滴度的变化趋势与IHA检测基本相同。但第4、6、7、8次采血时B组试验兔抗体滴度低于IHA检测;第4、7次采血时C组抗体滴度低于IHA检测。对照组仍未检测到抗SW抗体存在。
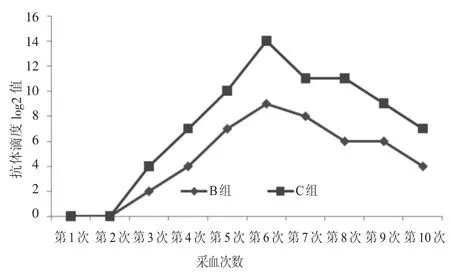
图2 ELISA检测家兔血清抗SW抗体效价变化
2.3 E-玫瑰花环试验结果
免疫试验期内,B组和C组E-玫瑰花环率呈上升趋势,并在第6次采血时达到最高值,然后免疫组E-玫瑰花环率的变化趋势趋于平缓。从第3次采血开始,C组E-玫瑰花环率高于B组,到第9次采血时2组E-玫瑰花环率差异不显著(P>0.05)。对照组E-玫瑰花环率波动较为平缓,但均小于免疫试验组。具体结果见图3。
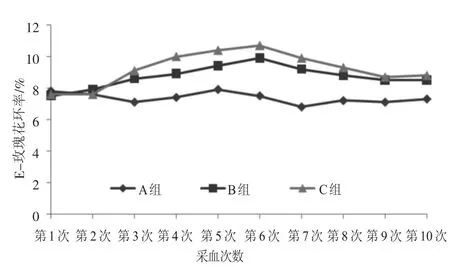
图3 试验兔血清E-玫瑰花环率变化
3 讨论与结论
我国现有棘豆属植物120余种,黄芪属植物280余种,已确定含SW的有10多种[2]。这些含有SW的植物是未来放牧动物的潜在威胁。为了有效预防家畜SW中毒,需要特异、简便的SW和抗SW抗体分析方法。常用的抗体滴度检测方法有放射性免疫测定、酶联免疫测定、间接血凝试验和间接血凝抑制试验测定等。其中酶联免疫测定和间接血凝试验有灵敏性高、特异性强、检测迅速和成本低廉等特点,目前在抗SW抗体的检测方面应用较多[7-8]。本试验检测抗体滴度的方法采用了间接血凝试验和间接酶联免疫测定,2种方法都可以检测到抗体,而ELISA法的准确性稍高[5]。SW免疫学检测方法的确立不仅可用于检测含SW植物不同生长期SW含量的变化,也可用于检测不同家畜对SW的耐受剂量,研究SW的作用机理,并对食品安全进行检查。
人工抗原免疫动物能否产生抗体,不仅与人工抗原的质量和免疫动物个体状况有关,还与免疫程序有关。在一定范围内抗原剂量与免疫反应强度呈正相关,过低与过高都不利于抗体的产生。试验初期使用小剂量抗原免疫动物,一方面考虑SW抗原决定簇较少,另一方面是因为小剂量可以激活高亲和力的淋巴细胞;后期大剂量免疫则是考虑到维持已经产生的抗体和进一步激活更多的淋巴细胞。与其他相关试验相比[5,7-9],本试验抗SW抗体效价的产生时间较为一致,但家兔产生抗体的周期短于山羊,而且抗体效价较高,说明本试验免疫剂量和时间的设计是合理的。
E-玫瑰花环率的变化反应了动物机体免疫力的变化[9],其中主要受T淋巴细胞的影响。免疫组前期E-玫瑰花环率上升,可能是因为人工抗原刺激动物机体细胞免疫表达,从而产生了大量高活性的T淋巴细胞,导致E-玫瑰花环率的增加,说明该免疫反应可以有效阻止进入机体的SW侵害动物的免疫系统。试验中虽然检测到家兔机体有抗SW抗体产生,但该抗体能否保护动物在采食疯草时免于中毒,还有待于试验的进一步证实。
[1]刘志滨.疯草中苦马豆素提取方法研究[D].杨凌:西北农林科技大学,2006.
[2]高木木.新疆棘豆属植物研究[D].新疆石河子:石河子大学,2008.
[3]王帅,胡建军,阿里木别克,等.南疆地区小花棘豆的营养成分分析[J].草业科学,2010,27(5):136-139.
[4]童德文.苦马豆素-BSA的合成及其免疫原性研究[D].杨凌:西北农林科技大学,2001.
[5]童德文,陈德坤,曹光荣.苦马豆素-BSA对家兔的免疫原性研究[J].西北农林科技大学学报:自然科学版,2001,29(5):11-14.
[6]Watanabe H,Satake A,Kido Y,et al.Monoclonal-based-enzyme-linked immunosorbent assay and immunochromatographic assay for enrofloxacin in biological matrices[J].Analyst,2002,127:98-103.
[7]杨合生,童德文,赵红妮,等.苦马豆素抗血清治疗山羊甘肃棘豆中毒的血清学和免疫学指标评价[J].西北农业学报,2008,17(6):6-11.
[8]杨合生,童德文,赵红妮,等.SW-OVA接种家兔血清抗体变化的研究[J].黑龙江畜牧兽医,2009(3):96-97.
[9]Tong D W,Mu P H,Dong Q,et a1.Immunological evaluation of SWHSA conjugate on goats[J].Colloids and Surfaces B:Biointerfaces,2007,58:61-67.

