七氟烷吸入麻醉对大鼠青光眼造模眼眼压的影响
张晓光 杨宏方 陈君毅
青光眼是世界第一位不可逆致盲眼病,眼压(intraocular pressure,IOP)升高是青光眼视神经病变的主要危险因素[1-2]。与成年患者不同,先天性青光眼患儿的IOP测量及手术通常需在全身麻醉下完成。正确测量IOP对先天性青光眼的诊断具有十分重要的意义。有研究[3-5]表明多种全身麻醉药都可以不同程度降低IOP。七氟烷是目前国内外小儿麻醉最常用的吸入麻醉药,且经常使用较高浓度进行吸入麻醉诱导。目前关于七氟烷麻醉前后IOP变化,尤其对青光眼患眼IOP变化的研究尚很少。本研究使用磁性微球前房注射诱导实验性大鼠青光眼模型为研究对象,研究七氟烷对正常眼和青光眼造模眼IOP的影响。
1 材料与方法
1.1 实验动物 所有动物实验操作均遵守复旦大学动物管理委员会关于动物实验的相关规定。选取雄性8~10周挪威褐鼠6只(上海西普尔-必凯实验动物有限公司),饲养于标准实验条件下(12 h∶12 h暗循环,22 ℃,湿度为60%,自由取食、水)。
1.2 IOP测量 实验前对大鼠进行2周清醒状态下IOP测量训练。具体如下:左手从大鼠左侧轻轻握持大鼠,拇指位于大鼠颈后,食指和中指位于大鼠下颌下、前腿前,让大鼠双前腿搭在无名指上,小指不施力。如此握持待大鼠适应2 min后,使用Tonolab回弹式眼压计(Icare,Finland)按照其使用说明在0.4%盐酸奥布卡因滴眼液(贝诺喜,参天制药)局部麻醉下测量大鼠双眼IOP。早晚各1次(上午9:30,晚上9:30),每次获得每只眼睛的3个有效数据后进行平均得到该时段的IOP。训练2周后,待早、晚测得IOP值分别平稳(同时段同眼相差2 mm Hg以内,1 mm Hg=0.133 kPa),对大鼠进行24 h IOP测量,每4 h测量1次。测量点分别为首日的3:30、7:30、11:30、15:30、19:30、23:30,次日的1:30、5:30、9:30、13:30、17:30、21:30,并重复以上时点测量1次。制作24 h眼压曲线,选择平均每日IOP较平稳的时段(8:30~11:30或13:30~17:30)作为实验检测麻醉药物对IOP影响的时段。
1.3 青光眼模型制作 直径为4.5 μm的磁珠(4×108磁珠/mL,Invetrogen Dynabeads M-450 Epoxy,美国)在层流室内经10×Tris缓冲液洗涤、无菌蒸馏水洗涤、平衡盐溶液洗涤,重悬制成浓度为4×109磁珠/mL的磁珠悬浮液,封装并置4 ℃保存待用。对大鼠使用50 mg氯胺酮加12.5 mg甲苯噻嗪/mL混合液肌注进行全身麻醉,剂量为0.1 mL/150 g体质量;同时双眼用0.4%盐酸奥布卡因滴眼液进行表面麻醉。所有大鼠均选择右眼作为青光眼造模眼,左眼作为自身对照眼。使用30 G的微量注射器(25 μL,Hamilton),先预留1 μL空气,然后吸取5 μL已经预先处理好的磁珠(4×109磁珠/mL)。首先使用上述微量注射器沿瞳孔缘平行于虹膜和晶状体表面刺入前房,避免损伤晶状体和虹膜。退出针尖,待房水自由流出后,再次将上述微量注射器经原穿刺口进入前房,并匀速缓慢注入磁珠和空气。空针滞留前房30 s,同时用0.45特斯拉的磁铁将前房内磁珠尽可能均匀地吸引至周边前房一周。拔出微量注射器针头,因前房内有气泡顶压,无房水渗漏现象。对侧眼以同样的方法注入5 μL生理盐水和1 μL空气作为对照。术毕,双眼使用氧氟沙星眼膏(迪可罗,8 mL∶24 mg,沈阳市兴齐制药有限公司)涂眼。24 h后,开始早晚各1次检测大鼠双眼IOP,至昼、夜IOP分别平稳后,进行下一步研究。从造模开始到麻醉实验时间间隔为9~12 d,平均10.33 d。
1.4 麻醉实施 研究均在上午8:30开始。大鼠置于自制透明塑料麻醉箱内吸入七氟烷,以氧气作为载气,通过异氟醚挥发罐后进入麻醉箱,出口处接气体监护仪(Datex Cardiocap II, Datex-Ohmeda, Madison,WI)监测麻醉气体浓度、氧浓度和二氧化碳浓度。调整氧流量,维持吸入氧浓度30%。调整挥发罐刻度和氧气流量。麻醉过程中保持自主呼吸,持续观察大鼠的呼吸频率、肢端和口唇颜色。将鼠尾保留于麻醉箱外,以便观察麻醉深度。测量IOP时,将大鼠从麻醉箱中取出即刻测量并于测量后立即放回麻醉箱。分别于麻醉前即刻(T0)、夹尾反射消失(T1)、夹尾反射消失后10 min(T2)测定造模眼和对照眼的IOP;T2测量后不再将大鼠放回麻醉箱,待其自然苏醒,分别于T2后10 min(T3)、20 min(T4)、30 min(T5)、1 h(T6)测定造模眼和对照眼的IOP。测定方法同实验动物处理部分。
2 结果
大鼠在麻醉过程中自主呼吸保持良好,无发绀表现。自麻醉箱中取出后约5 min,大鼠翻正反射开始恢复。
七氟烷可明显降低造模眼和对照眼的IOP,造模眼IOP降低的程度明显大于对照眼,持续时间长于对照眼(表1)。与麻醉前相比, T1~T6的6个时间点造模眼IOP下降幅度分别为52.6%、51.4%、37.0%、23.1%、16.9%和10.4%;对照眼下降幅度分别为30.1%、37.5%、10.3%、6.6%、3.7%和-7.3%。图1显示了造模眼和对照眼IOP在麻醉前后的变化趋势,造模眼IOP在麻醉后显著下降,且T1~T6的6个时间点IOP均明显低于T0,差异有统计学意义;对照眼麻醉后IOP也显著下降,下降幅度低于造模眼。至T3即大鼠苏醒、翻正反射恢复后,IOP恢复至麻醉前的基础水平。
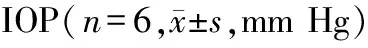
表1 七氟烷麻醉前后
注:a示造模眼与T0相比P<0.001;b示对照眼与T0相比P<0.001

图1. 七氟烷麻醉对造模眼和对照眼IOP的影响
3 讨论
与其他吸入麻醉药相比,七氟烷具有血液和组织溶解性低、无气道刺激、对血流动力学影响小等优点,因此是目前小儿临床麻醉最常用的吸入麻醉药之一[6-7]。先天性青光眼患儿IOP的测量以及手术都需在全身麻醉下完成,因此了解全身麻醉药对青光眼患眼IOP的影响,对于手术必要性和有效性的判断具有重要意义。有研究[8]表明,七氟烷可使成人健康眼的IOP明显下降。Jones等[9]比较了氯胺酮和七氟烷对于先天性青光眼患儿IOP测量的影响,发现使用氯胺酮麻醉诱导后,再使用七氟烷维持麻醉,可使IOP进一步下降28.5%。
磁性微球前房注射是新近报道的一种建立大鼠青光眼模型的有效方法[10-11]。本研究采用了该方法诱导实验性青光眼大鼠模型。在Ding等[12]的研究中发现,对大鼠进行IOP测量的行为训练有助于提高测量的一致性和可靠性,因此本研究在造模之前先对大鼠进行2周的行为训练。随着训练进行,大鼠可以配合IOP测量而无明显挣扎、躲避行为,测得的IOP数值趋于稳定(同时段同眼相差2 mm Hg以内)。此外,既往研究[13]已经证明,使用TonoLab回弹式眼压计可以准确测量清醒状态下挪威褐鼠的IOP。
本研究发现,七氟烷可明显降低大鼠青光眼造模眼和对照眼IOP,且造模眼的降低程度明显高于对照眼。在Jones等[9]对于先天性青光眼患儿的研究中也发现,氯胺酮诱导后IOP越高的患眼使用七氟烷后IOP下降程度越大,虽然差异未发现有统计学意义。此外,本研究发现七氟烷对造模眼的降压效果可持续至大鼠完全苏醒后。这一现象与Ding等[12]报道的另外一种吸入麻醉药异氟烷的作用类似。
IOP的高低由眼内容体积(房水、玻璃体和脉络膜体积)和眼球顺应性(巩膜硬度、眼外肌张力和眼球外压力)等多种因素决定。房水体积又由房水生成速率和流出易度来决定。Artru等[14]研究了不同浓度的七氟烷对兔IOP和房水动力学的影响,发现七氟烷麻醉后的IOP与其他文献报道兔清醒状态下的IOP比较有明显下降。随七氟烷浓度增加,眼球顺应性下降,但IOP无明显改变,房水流出易度、房水生成速度无明显改变。七氟烷对眼球顺应性的影响并不能解释其降低IOP的作用。吸入麻醉药具有显著的松弛肌肉作用,推测其降低IOP的作用可能与松弛眼外肌有关,然而为什么其对造模眼和对照眼的影响不同以及其降低IOP的确切机制,仍有待于进一步研究。
综上所述,本研究发现使用七氟烷吸入麻醉可以显著降低大鼠IOP,其中青光眼造模眼的下降幅度更为显著。同时也提示在对先天性青光眼患儿使用七氟烷全身麻醉下检查时,应充分考虑到该药物降低IOP的作用。
[1]Buckingham BP, Inman DM, Lambert W, et al. Progressive ganglion cell degeneration precedes neuronal loss in a mouse model of glaucoma[J]. J Neurosci, 2008, 28(11): 2735-2744.
[2]Crish SD, Sappington RM, Inman DM, et al. Distal axonopathy with structural persistence in glaucomatous neurodegeneration[J]. Proc Natl Acad Sci U S A, 2010, 107(11): 5196-5201.
[3]Murphy DF. Anesthesia and intraocular pressure[J]. Anesth Analg, 1985, 64(5): 520-530.
[4]Watcha MF, Chu FC, Stevens JL, et al. Effects of halothane on intraocular pressure in anesthetized children[J]. Anesth Analg, 1990,71(2): 181-184.
[5]Lamb K, James MF, Janicki PK. The laryngeal mask airway for intraocular surgery: effects on intraocular pressure and stress responses[J]. Br J Anaesth, 1992, 69(2): 143-147.
[6]McDowall RH, Scher CS, Barst SM. Total intravenous anesthesia for children undergoing brief diagnostic or therapeutic procedures[J]. J Clin Anesth, 1995,7(4): 273-280.
[7]Sarner JB, Levine M, Davis PJ, et al. Clinical characteristics of sevoflurane in children. A comparison with halothane[J]. Anesthesiology, 1995,82(1): 38-46.
[8]Sator-Katzenschlager S, Deusch E, Dolezal S, et al. Sevoflurane and propofol decrease intraocular pressure equally during non-ophthalmic surgery and recovery[J]. Br J Anaesth, 2002, 89(5): 764-766.
[9]Jones L, Sung V, Lascaratos G, et al. Intraocular pressures after ketamine and sevoflurane in children with glaucoma undergoing examination under anaesthesia[J]. Br J Ophthalmol, 2010, 94(1): 33-35.
[10] Samsel PA, Kisiswa L, Erichsen JT, et al. A novel method for the induction of experimental glaucoma using magnetic microspheres[J]. Invest Ophthalmol Vis Sci, 2011, 52(3): 1671-1675.
[11] Sappington RM, Carlson BJ, Crish SD, et al. The microbead occlusion model: a paradigm for induced ocular hypertension in rats and mice[J]. Invest Ophthalmol Vis Sci, 2010,51(1): 207-216.
[12] Ding C, Wang P, Tian N. Effect of general anesthetics on IOP in elevated IOP mouse model[J]. Exp Eye Res, 2011,92(6): 512-520.
[13] Morrison JC, Jia L, Cepurna W, et al. Reliability and sensitivity of the TonoLab rebound tonometer in awake Brown Norway rats[J]. Invest Ophthalmol Vis Sci, 2009, 50(6): 2802-2808.
[14] Artru AA, Momota Y. Trabecular outflow facility and formation rate of aqueous humor during anesthesia with sevoflurane-nitrous oxide or sevoflurane-remifentanil in rabbits[J]. Anesth Analg, 1999,88(4): 781-786.

