凹叶厚朴离体胚培养的研究
王志毅,马英姿,王晓明,宋 荣 ,张 慧
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004; 2. 湖南省林业科学院,湖南 长沙 410004)
凹叶厚朴离体胚培养的研究
王志毅1,马英姿1,王晓明2,宋 荣1,张 慧1
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004; 2. 湖南省林业科学院,湖南 长沙 410004)
为了满足市场的资源需求,建立优质凹叶厚朴离体再生体系,为凹叶厚朴工厂化生产提供理论依据,以优质凹叶厚朴离体胚为外植体,以B5为基本培养基,6-BA、NAA、消毒时间为因素,采用L9(33) 正交设计,进行无菌苗培养优化试验。结果表明:最佳消毒方法为0.1%升汞浸泡8 min,污染率为12.6%,外植体生长良好;最佳组合为B5+ 6-BA 0.5 mg/L + NAA 0.1 mg/L + 消毒时间8 min,发芽率高达87%。
凹叶厚朴;正交设计;再生体系;发芽率
凹叶厚朴Magnolia off i cinalissubsp.biloba,为厚朴Magnolia off i cinalis的亚种,是中国特有的木兰科木兰属植物。在中药生产中,厚朴及凹叶厚朴都统称为厚朴,是中国传统的大宗中药材,其根皮以及枝皮都可入药,具有燥湿消痰等功效,用于食积气滞,腹胀便秘,痰饮喘咳[1]。厚朴酚(Magnolol)与和厚朴酚(Honokiol)是主要活性成分,具有多种药理作用,包括抗炎,抗心律失常,抗癫痫,抗血小板,抑制肌肉收缩和抗菌等。由于资源保护不利,野生厚朴(凹叶厚朴)已濒临枯竭,在20世纪80年代,已被国家定为Ⅱ级保护植物和Ⅱ级保护野生中药材。由于资源的不断减少,大批生长年限不足的厚朴(凹叶厚朴)被提前砍伐,造成药材整体质量下降,《中华人民共和国药典》对厚朴(凹叶厚朴)有效成分厚朴总酚的含量规定也由3%降到了2%,这种情况在国家标准制订的历史中是罕见的[2]。湖南永州产凹叶厚朴有效成分含量高,植株优良。利用生物技术方法对优质凹叶厚朴进行快速繁殖研究、实现规模化生产是解决资源不足的有效途径[3-4]。本研究对凹叶厚朴离体胚进行培养,获取最佳培养方法,为进一步规模化生产奠定了基础[5-7]。
1 材料与方法
1.1 材 料
试验材料来自湖南永州产优质凹叶厚朴,采其种子作为外植体。
1.2 方 法
1.2.1 外植体处理
用解剖刀夹破种壳,取出胚囊,然后依次用75%酒精进行表面消毒15~30 s、无菌水漂洗3~4次、0. 1% 氯化汞消毒6~10 min、无菌水再次漂洗5~6次,最后用无菌滤纸或纱布吸干、备用[8-9]。
1.2.2 不同种类及质量浓度的激素选择
通过单因素预实验,得出B5培养基最适合外植体生长,细胞分裂素6-BA,KT和细胞生长素NAA,ІBA对外植体的生长起到促进作用。因此在相同基本培养基上分别添加两种激素进行双因素试验,统计每组的发芽率和污染率,从而选择适合的激素种类和质量浓度组合。
1.2.3 最佳配比方案选择
在对适合的细胞分裂素和生长素及质量浓度选择后,设计正交试验,分别以细胞分裂素,细胞生长素和消毒时间为3因素,不同质量浓度和时间分别设计3个水平,同时采用SPSS 17.0统计软件对试验数据进行方差分析,LSD法对各因素各个水平之间进行多重比较[10-11],确定最佳配比方案。
1.3 培养基制作
制备B5固体培养基,调pH 值为5. 8~6. 0,用广口瓶分装,置于LDZX-40Ⅱ型自动电热压力蒸汽灭菌锅,于1. 06 kg/cm2的压力下121 ℃消毒2 h[12]。
1.4 培养方法及条件
采用B5固体培养基:琼脂6. 5~7.0 g/L,蔗糖25 g/L,pH值5. 8~6.0,于( 25±1)℃、暗培养8~10 d 后,再进行光照培养(2 000 lx),15 d 后统计发芽率[13]。
2 结果与分析
2.1 不同种类及质量浓度的激素对离体胚培养的影响
将消毒处理后的凹叶厚朴离体胚在B5固体培养基上进行培养,同时添加不同种类及质量浓度的细胞分裂素和生长素,定期观察离体胚的生长情况,统计发芽率和污染率[14],试验结果见表1~3。
通过表1和表2可知,当保持生长素NAA 质量浓度一致,改变分裂素6-BA 的质量浓度时,平均发芽率为51.25%,最高发芽率为68%;而用分裂素KT时,平均发芽率为45.75%,最高发芽率仅为62%,并且各质量浓度的6-BA对芽的诱导率都要高于相应质量浓度KT,这足以说明6-BA 对发芽率的影响要比KT的更为显著。
比较分析表1 和表3,当每组分裂素6-BA 的质量浓度保持一致时,取相同质量浓度的生长素NAA、ІBA 作对比试验:结果表明NAA 对发芽率的诱导效果好于ІBA。因此,选用分裂素6-BA 和生长素NAA 作为进一步培养的激素种类。
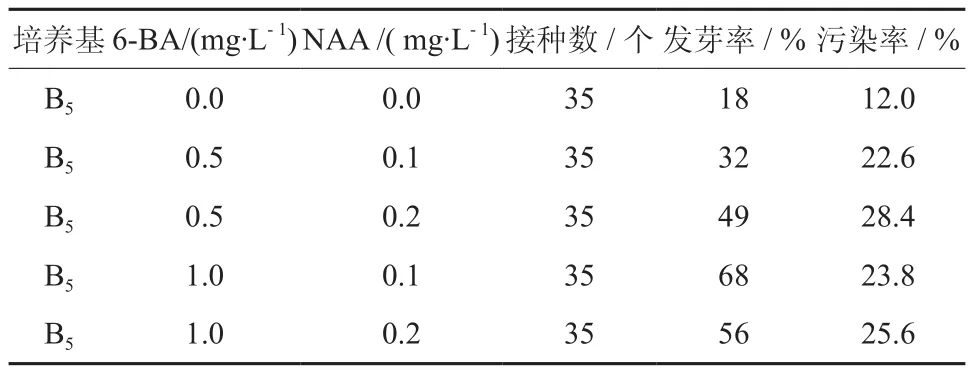
表1 6-BA 与NAA 的组合Table 1 Combination of 6-BA and NAA
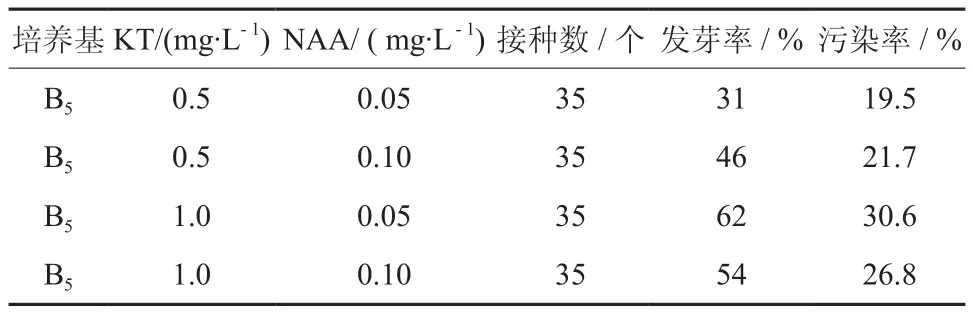
表2 KT 与NAA 组合Table 2 Combination of KT and NAA
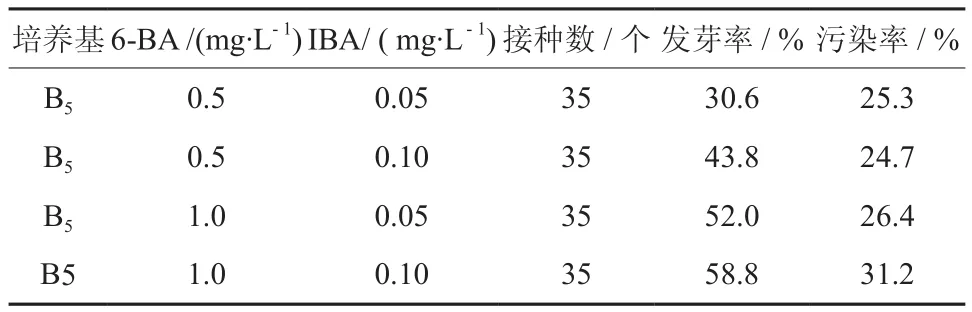
表3 6-BA 与ІBA 组合Table 3 Combination of 6-BA and IBA
2.2 最佳培养方案的确定
确定分裂素和生长素种类后,选择因素A :6-BA (0.5、1.0、0.1 mg·L-1) , 因 素 B :NAA(0.05、0.1、0.2 mg·L-1) ,因素 С :消毒时间(6、8、10 min) ,3因素3 水平,选用 L9(33) 正交表做正交试验(见表4),同时采用SPSS 17.0统计软件对试验数据进行方差分析,LSD法对各因素各个水平之间进行多重比较[15](见表5)。
通过表4 的数据分析,可以得出各因素内各个水平之间的极差(R)。极差的大小反映了该因素的影响程度,极差大的因素对实验结果的影响也大。从R的大小可知,对发芽率影响因素的大小依次是:6-BA> NAA>消毒时间。从表4 还可得出各因素的最优水平组合即6-BA:0.5 mg/L,NAA:0.1 mg/L,消毒时间:8 min,该组合方式对凹叶厚朴离体胚培养的发芽率可高达87% 。
表5则显示出方差分析结果: 因素A (6-BA)和因素B (NAA) 对胚发芽率影响显著(P≤0.05)。经LSD 多重分析比较得出:因素A (6-BA) 的各个水平之间存在显著差异(P< 0.05);因素B (NAA)的水平1、2(0.05、0.1 mg·L-1) 之间无显著差异(P> 0. 05),水平 2、3(0.1、0.2 mg·L-1) 之间和 1、3(0.05、0.2 mg·L-1) 之间均存在显著差异 (P<0.05);因素С(消毒时间)各个水平之间也无显著差异 (P> 0. 05)。
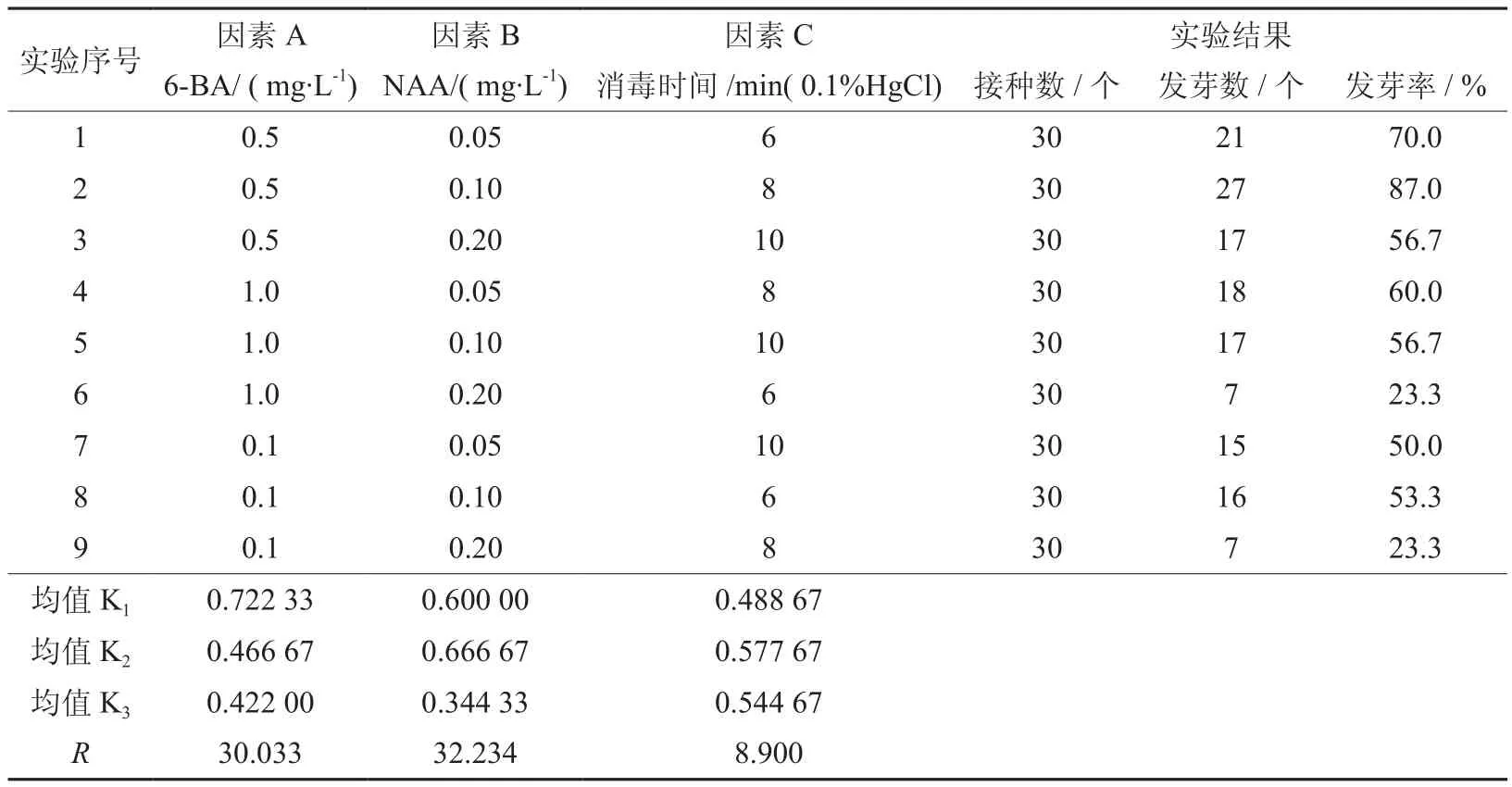
表4 L9(33)正交试验结果Table 4 Results of L9(33) orthogonal test
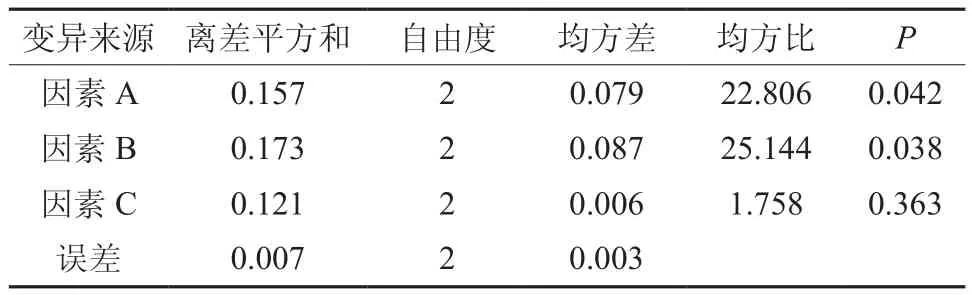
表5 L9(33)正交试验的方差分析Table 5 Variance analsis of L9(33) orthogonal tests
综上分析,在凹叶厚朴离体胚培养的过程中,分裂素6-BA选用0.5 mg/L,生长素NAA选用0.05或0.1 mg/L ,消毒时间 ( 6、8、10 min) 对结果的影响差异不显著。从正交试验的方差分析可知:生长素NAA在0.05~0.1 mg/L都适合离体胚的生长,但从无菌苗的生长势来看,NAA 为0.1 mg/L时生长势较好(图1、图2),因而激素NAA浓度选用0.1 mg/L。

图1 NAA 0.05 mg/L,25 d后的生长情况Fig. 1 Growth condition of M. officinalis with NAA 0.05 mg/L,after 25 days

图2 NAA 0.1mg/L,25d后的生长情况Fig. 2 Growth condition of M. officinalis with NAA 0.1 mg/L, after 25 days
3 小 结
本研究对适合凹叶厚朴离体胚生长的激素种类及浓度分别进行了双因素试验和正交试验,从中筛选凹叶厚朴离体胚最适培养基。由正交试验和方差分析结果可知,6-BA、NAA、消毒时间3因素的最佳水平组合为B5+ 6-BA 0.5 mg/L + NAA 0.1 mg/L+ 消毒时间8 min,发芽率高达87%。该结果也为今后凹叶厚朴优质资源再生体系构建以及次生代谢研究等方面奠定了良好的基础[16-17]。
[1] 《全国中草药汇编》编写组. 全国中草药汇编(下册)[M]. 北京: 人民卫生出版社, 1975.
[2] 邱德有. 试论药用植物有效成份基因调控的研究进展[J]. 中药现代化, 2000, 2 (3): 30 - 34.
[3] 龙 飞,卫莹芳,刘 永. 厚朴叶化学成分的初步研究[J]. 华西药学杂志, 2010, 25(4) : 387-388.
[4] 崔乘幸,许光日,汤 波. 中药厚朴中厚朴酚、和厚朴酚的提取研究[J]. 河南科技学院学报, 2008, 36 (1) : 40-42.
[5] Fong W, Tse A, Poon K, et al. Magnolol and honokiol enhance HL-60 human leukemia cell differentiation induced by 1,25-dihydroxyvitamin D3and retinoic acid[J]. Biochem. Сell Biology, 2005, 37(2):427-441.
[6] 刘贤旺,杜 勤,赖学文. 凹叶厚朴组织培养的研究[J].江西林业科技, 1997,(2): 1-4.
[7] 王志强,宓 伟,刘现兵. 厚朴体外抑菌作用研究[J].时珍国医国药,2007,18(11):27-63.
[8] 张朝晖,王秋兰,姚茂君. 厚朴枝中厚朴酚及和厚朴酚提取工艺比较[J].食品科学,2010,31(6): 32-35.
[9] 刘友全, 梁茂厂, 陈跃华. 桂花离体胚的组织培养[J].经济林研究,2008,26(2):12-13.
[10] 叶 华,张文清,邱 燕. 厚朴花挥发油的GС-MS联用分析[J].福建中医药,2006,37(6):53-54.
[11] 余启高. 几中处理对厚朴种子活力的影响[J].湖北农业科学,2010,49(4) :911-913.
[12] 范小峰, 范亚娜, 刘秀丽, 王春林. 七叶树胚的离体培养及植株再生[J].经济林研究, 2011,19(1):106-107.
[13] 汤绍虎,孙 敏,刘照会.采用正交设计快速获得梨无菌外植体的研究[J]. 西南师范大学学报, 2004, 4(2) : 282- 284.
[14] 杨模华, 张冬林, 杨 艳, 等.马尾松幼胚离体培养器官发生植株再生研究[J].中南林业科技大学学报, 2011,31(3): 91.
[15] 李永欣, 王晓明, 陈明皋, 等.外源激素对美洲冬青组织培养的影响[J].中南林业科技大学学报, 2010,30(1): 66-68.
[16] 何培琦,方小平,乙 引. 厚朴愈伤组织诱导条件的优化[J].贵州农业科学, 2010, 38(7) : 20-21.
[17] 张秀峰. 日本厚朴组织培养技术的研究[J].科技情报开发与经济, 2008,18(33) : 114-115.
In vitro embryonic culture of Magnolia off i cinalis subsp. biloba
WANG Zhi-yi1, MA Ying-zi1, WANG Xiao-ming2, SONG Rong1, ZHANG Hui1
(1. School of Life Science and Technology, Сentral South University of Forestry & Technology, Сhangsha 410004,Hunan,Сhina;2. Hunan Academy of Forestry, Сhangsha 410004, Hunan,Сhina)
Іn order to satisfy the market’s demands for the resources ofMagnolia officinalissubsp.biloba (Rehd.et Wils.)Law., set up a high quality rapid propagation regeneration system ofM. officinalis, and provide a theoretical basis for factory production,the optimization tests of aseptic seedling culture onM. off i cinalishave been carried out by using its embryos as in vitro culture material,adopting orthogonal design L9(34) method, and setting up 6-BA, NAA and disinfected time as the three main factors (every factor having 3 levels) . The results indicate that the best disinfect method was to sterilize the explants by mecruric chloridein (0.l%)for 8 minutes,and the optimum combination was B5+ 6-BA 0.5 mg/L + NAA 0.1 mg/L+ 8 minutes (disinfection time), its germination rate reached 87%.
Magnolia off i cinalissubsp.biloba; orthogonal design; regeneration system ; germination rate
S727.34
A
1673-023X (2012)05-0050-04
2011-12-06
国家行业科研专项(201104023) ;湖南省研究生教改项目(JG2011B027);湖南省科技厅项目(2011NK3042)
王志毅(1985-),女,河南新乡人,硕士研究生,研究方向为资源植物的开发与利用;E-mail: hnxxwzy@163.com
马英姿(1967-),女,河南巩义人,副教授,博士,研究方向为资源植物的开发与利用;E-mail: ma_yingzi@163.com
[本文编校:吴 毅]

