地塞米松对哮喘小鼠气道血管生成及血管内皮生长因子表达的影响
姚红卫,吕丽丽
(1.江苏省常州市第四人民医院呼吸内科 213001;2.徐州医学院附属医院老年科,江苏徐州 221008)
气道重塑是哮喘的重要病理特征之一,目前国内外对气道重塑的研究多集中于平滑肌增生/肥大、基底膜增厚导致的气道壁增厚,对于血管生成等气道血管改变方面的研究尚较少。血管内皮细胞生长因子(VEGF)是一种有效的多功能的血管调节因子,它通过与血管内皮上的特异性受体结合,具有强大的促进内皮细胞增殖、增加微血管通透性、诱导血管生成等多种功能。本研究通过建立慢性哮喘小鼠模型,了解VEGF在哮喘小鼠模型肺组织中的表达和对气道血管生成的作用,以及早期应用地塞米松对气道重塑及VEGF表达的影响,现报道如下。
1 材料与方法
1.1材料 采用4~6周龄的BALB/c小鼠30只,雌性,体质量18~22 g(购自徐州医学院实验动物中心)。饲养条件为清洁级环境,室温为22~25 ℃,自由饮水无鸡卵清蛋白(OVA)进食。
1.2仪器与试剂 OVA(美国Sigma公司),小鼠VEGF ELISA检测试剂盒(深圳晶美公司),兔抗小鼠Ⅷ因子多克隆抗体和Enivision 试剂(即用型,丹麦Dako公司),VEGF 多克隆抗体及SABC免疫组化检测试剂盒(购自武汉博士德生物工程有限公司),奥林巴斯图像采集系统,402A型超声雾化器(江苏鱼跃医疗设备有限公司)。
1.3方法
1.3.1哮喘模型的制备和分组 将30只小鼠按随机数字表法分为3组,每组10只。生理盐水对照组(A组):以生理盐水代替OVA致敏和激发。哮喘组(B组):分别于第0、7、14及21天给小鼠腹腔注射OVA致敏液0.2 mL(含OVA 25 μg硫酸铝钾1 mg)在致敏后第28天,将小鼠置于一容器中(20 cm×40 cm×50 cm),每5只为1组,以2%的OVA溶液雾化激发,每天1次,每次30 min,连续7 d,然后再隔天1次共激发18次;观察小鼠反应,如出现烦躁不安、呼吸急促、流涎、大小便失禁和腹肌痉挛等为阳性反应。地塞米松干预组(C组):每次激发前1 h予地塞米松(2 mg/kg)腹腔注射。
1.3.2标本收集 末次雾化激发24 h后,以5%的水合氯醛0.4 mL腹腔注射麻醉小鼠,分离气管,插入套管针,暴露胸腔,结扎右主气管,用0.3 mL的磷酸盐缓冲液(PBS)行左肺支气管肺泡灌洗,反复3次,回抽率在80%以上,将收集的支气管肺泡灌洗液(BALF)放入1.5 mL的EP管中,低速离心10 min,沉渣以1 mL Hank′s液重悬,行细胞计数。上清液-70 ℃保存待测定VEGF浓度。将右肺组织及气管浸入10%中性甲醛溶液中固定,经漂洗、脱水、包埋制成蜡块,切片后行苏木精-伊红(HE)染色行病理学观察,部分行免疫组化染色。
1.3.3BALF中活性VEGF的测定 应用小鼠VEGF ELISA检测试剂盒检测BALF中VEGF水平,步骤按试剂盒说明书进行。
1.3.4VEGF免疫组化染色 石蜡切片脱蜡至水,3%过氧化氢(H2O2)室温孵育10 min,以消除内源性过氧化物酶的活性,经微波处理,滴加比例为1∶100的VEGF一抗抗体,37 ℃孵育1 h;滴加二抗试剂盒中A液(生物素化山羊抗小鼠IgG),37 ℃孵育20 min;滴加二抗试剂盒中B液(试剂SABC),37 ℃孵育30 min;用二氨基联苯胺(DAB)溶液显色,室温显色,镜下控制反应时间。自来水充分冲洗,HE轻度复染,脱水,透明,封片。PBS代替一抗作为阴性对照。VEGF阳性染色为棕黄色或棕褐色颗粒,主要定位在胞浆。
1.3.5气管血管密度的计算 病理切片采用Envision 法行抗Ⅷ因子免疫组化染色标记血管内皮细胞,操作按试剂盒说明书进行。用PBS代替一抗作阴性对照,以血管内壁出现棕黄色或黄色颗粒状为阳性反应。每个标本观察5张切片,每张切片在显微镜(×1 000)下于黏膜下层、黏膜固有层血管尽可能多的区域选10个视野,计数50个视野中(1 mm2)阳性反应的管腔样结构的总数。计数采取盲法,由两位不知实验分组的医师独立完成。
1.3.6图像分析 肺组织切片在显微镜下放大200倍,每组随机选取直径100~200 μm完整的小支气管横截面30个,采用计算机图像分析系统,测定完整的无软骨支气管横断面的基底膜周径(Pbm,μm)、管壁面积(WAt,μm2),计算支气管管壁厚度(WAt/Pbm)表示气道壁厚度。每张小鼠肺组织切片随机选取10个视野,测定每组肺组织切片中的血管数。
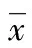
2 结 果
2.1各组小鼠BALF中细胞计数和活性VEGF含量的比较 分析不同组BALF中白细胞总数、EOS百分比及VEGF浓度变化,可见哮喘组明显高于对照组,差异有统计学意义(P<0.05),地塞米松组较哮喘组降低,差异有统计学意义(P<0.05),见表1。
2.2肺组织病理学改变 对照组小鼠气道黏膜正常,管周无炎性细胞浸润,支气管腔规则;与对照组比较,哮喘组气道壁及气道平滑肌明显增厚,黏膜下层增宽,管腔狭窄,黏膜下、支气管及血管周有大量炎性细胞浸润;地塞米松组上述改变明显减轻,炎性细胞浸润明显减少,但部分结构仍有轻微破坏,见封2图1~3。
2.3VEGF蛋白质在小鼠气道和肺内的表达 免疫组化结果显示 哮喘组小鼠气道黏膜上皮细胞、支气管平滑肌、肺泡上皮细胞和血管周围有大量棕黄色VEGF阳性蛋白颗粒表达,对照组VEGF阳性蛋白颗粒较少,地塞米松组VEGF呈弱阳性表达,见封2图4~6 。
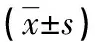
表1 各组BALF中白细胞总数、EOS百分比及VEGF浓度
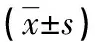
表2 各组气管血管密度、支气管壁厚度及肺组织血管计数的比较
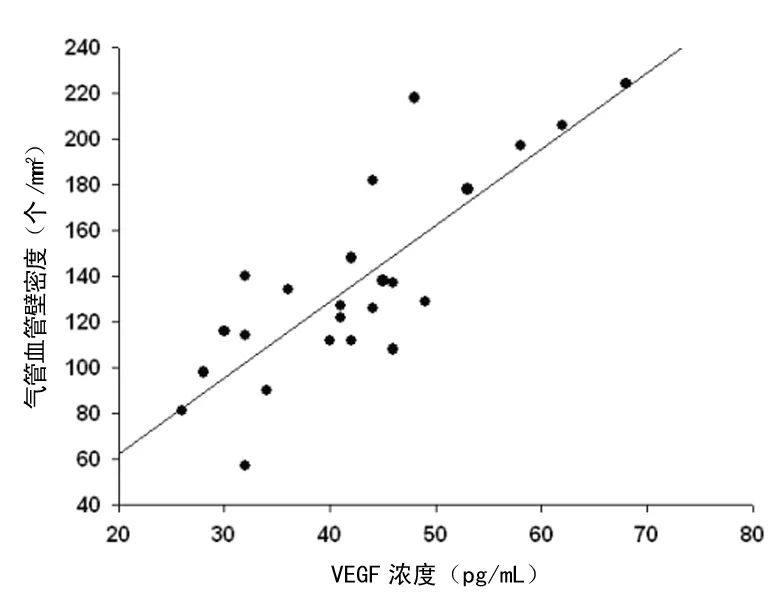
图7 BALF中VEGF水平与气管血管密度成正相关(r=0.814,P<0.05)
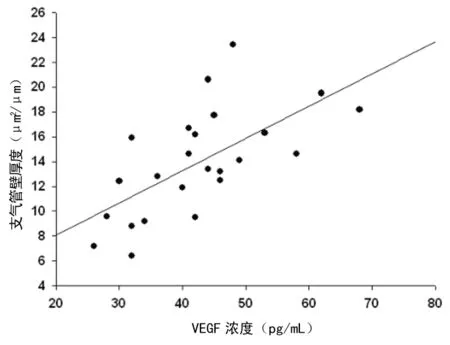
图8 BALF中VEGF水平与支气管壁厚度成正相关(r=0.643,P<0.05 )
2.4各组气管血管密度、WAt/Pbm及肺组织血管计数的变化 抗Ⅷ因子免疫组化染色及图像分析软件显示:哮喘组的气管血管密度、WAt/Pbm及肺组织血管计数明显高于对照组(P<0.05);与哮喘组比较,地塞米松组气管血管密度、WAt/Pbm及肺组织血管计数明显减少(P<0.05),见表2。
2.5相关性分析结果提示 BALF中VEGF的水平与气管血管密度、支气管壁厚度及肺组织中的血管数目皆呈正相关,见图7~9。
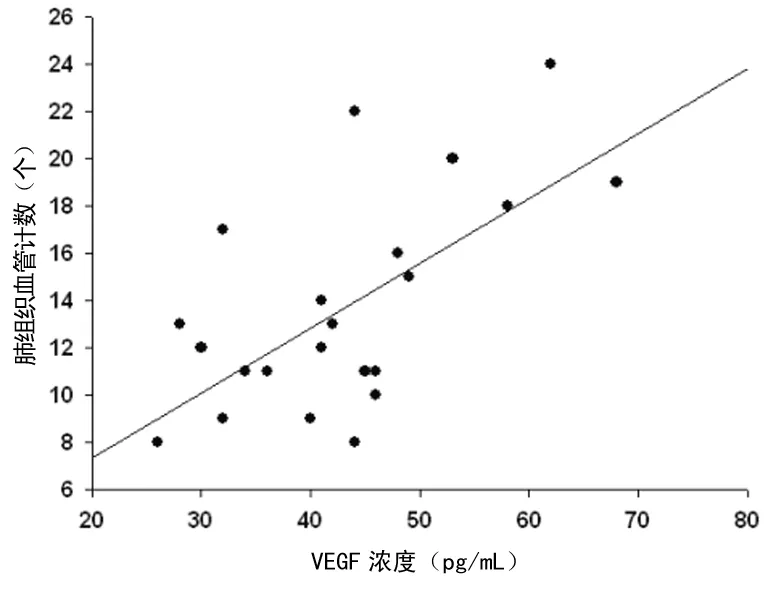
图9 BALF中VEGF水平与肺组织中血管数目成正相关(r=0.650,P<0.05)
3 讨 论
气道血管生成/血管增生是哮喘气道重塑的一个重要病理特征,VEGF是一强有力的刺激血管内皮细胞的生长因子,主要有两大生物学功能:一是增加血管通透性,是已知最强的血管通透剂[1];二是促进血管生成的功能。因此它可能与支气管哮喘的发病密切相关。研究发现过敏原可诱导支气管上皮细胞表达VEGF mRNA,产生较多的VEGF,进而改变气道的通透性,导致气道渗出、水肿[2]。Feltis等[3]发现,在哮喘患者支气管黏膜及BALF中的VEGF水平较对照组明显升高,且与支气管黏膜下的血管数目呈正相关。Gomulka等[4]研究发现,在哮喘患者血清和诱导痰中VEGF 含量均显著升高,VEGF和VEGF受体的水平与新血管的生成密切相关。同样的,刘鑫等[5]研究发现,慢性哮喘模型大鼠的总气管壁、气管内壁及气道平滑肌增厚,肺组织VEGF mRNA及VEGF蛋白的表达增高,提示VEGF可能参与了慢性哮喘大鼠的气道重塑过程。本研究显示,VEGF在小鼠哮喘模型气道及肺组织内呈过度表达,并且BALF中VEGF的水平与气管血管密度、支气管壁厚度及肺组织中的血管数目皆呈正相关。提示测定VEGF水平可能会成为评价哮喘控制情况和气道重塑严重程度很有价值的指标。
糖皮质激素(GCS)是治疗哮喘的有效方法[6]。激素能缓解气道的重塑,其机制之一就是通过降低血管渗透性和血浆蛋白的渗出从而减轻炎症和气道重塑。有研究表明激素能通过GCS受体通路降低VEGF的分泌和表达,而且这种作用是有时间依赖性和剂量依赖性的[7-8]。Chetta等[9]在对30例轻中度哮喘患者予氟替卡松吸入治疗6周后发现,其气道高反应性、症状评分及炎症细胞数均较治疗前明显下降。在体外实验中也发现,激素是VEGF强大的抑制剂,激素能下调哮喘患者气道中促血管生成的炎症介质的水平[10]。本研究在应用地塞米松治疗后,哮喘组BALF中白细胞总数、EOS百分及VEGF浓度显著下降,肺组织内VEGF呈弱阳性表达,其气管血管密度、WAt/Pbm及肺组织内血管计数均显著减少。上述结果提示,地塞米松干预可降低哮喘模型的气道炎症,减缓气道血管生成的过程。
[1]Dvorak HF,Brown LF,Detmar M,et al.Vascular permeability factor/vascular endothelial growth factor,microvascular hyperpermeability,and angiogenesis[J].Am J Pathol,1995,146(5):1029-1039.
[2]Antony AB,Tepper RS,Mohammed KA,et al.Cockroah extractantigen fincreases bronchial airway epithelial plermeability[J].Allergy Clin Immunol,2002,110(4):589- 595.
[3]Feltis BN,Wignarajah D,Zheng L,et al.Increased vascular endothelial growth factor and receptors:relationship to angiogenesis in asthma[J].Am J Respir Crit Care Med,2006,173(11):1201-1207.
[4]Gomulka K,Liebhart J.Vascular endothelial growth factor - structure,function and role in airways inflammation and the clinical course of asthma[J].Pneumonol Alergol Pol,2009,77(6):549-553.
[5]刘鑫,梅全慧,刘希,等.VEGF、HIF-1α在大鼠慢性哮喘模型中的表达及地塞米松的干预效应[J].重庆医学,2010,39(22)3013-3015.
[6]Korideck H,Peterson JD.Noninvasive quantitative tomography of the therapeutic response to dexamethasone in ovalbumin-induced murine asthma[J].J Pharmacol Exp Ther,2009,329(3):882-889.
[7]Nomura S,Kanazawa H,Hirata K,et al.Relationship between vascular endothelial growth factor and angiopoietin-2 in asthmatics before and after inhaled beclomethasone therapy[J].J Asthma,2005,42(2):141-146.
[8]Bandi N,Kompella UB.Budesonide reduces vascular endothelial growth factor secretion and expression in airway(Calu-1) and alveolar(A549) epithelial cells[J].Eur J Pharmacol,2001,425(2):109-116.
[9]Chetta A,Zanini A,Foresi A,et al.Vascular component of airway remodeling in asthma is reduced by high dose of fl uticasone[J].A m J Respir Crit Care Med,2003,167(5):751-757.
[10]Wen FQ,Liu X,Manda W,et al.Th2 Cytokine-enhanced and TGF-β-enhanced vascular endothelial growth factor production by cultured human airway smooth muscle cells is attenuated by IFN-γ and corticosteroids[J].J Allergy Clin Immunol,2003,111(6):1307-1318.

