组织型纤溶酶原激活物在进展期大肠癌组织中的表达与微血管密度的相关性研究*
顾 敏,孟信春,王 强,杨清平
(1.重庆市长寿区中医院普外科 401220;2.重庆市长寿区人民医院普外科 401220;3.重庆市长寿区人民医院病理科 401220)
组织型纤溶酶原激活物(t-PA)由血管内皮细胞合成分泌,可以选择性激活与纤维蛋白结合的纤溶酶原而发挥纤溶作用,近年来发现t-PA能够通过激活细胞外基质中的蛋白质酶联反应来降解微血管基膜及细胞外基质,从而阻碍微血管的生成。国内多家研究数据显示癌组织中t-PA浓度明显低于正常组织。本文通过检测癌组织浸液中t-PA浓度及癌组织微血管密度(MVD),初步探讨t-PA在肿瘤浸润转移过程中的调节机制。
1 资料与方法
1.1一般资料 选取2008年6月至2010年8月本院大肠癌患者手术切除的标本60例。患者术前检查未发现远处转移,术前未接受放化疗,无急性肠梗阻患者,经肠道准备后行标准大肠癌根治术。肉眼见肠管浆膜层、直肠系膜或邻近组织有浸润。病理证实癌组织浸润肠管全层,包括高中低分化腺癌及黏液腺癌。切取外缘癌组织为研究组,另取距肿瘤5 cm以上的正常肠管组织20例为对照组。
1.2方法 将外缘癌组织分为两等分,分别检测组织型纤溶酶原激活物及微血管密度。t-PA检测采用发色底物法,试剂购自上海太阳生物技术公司。将癌组织剪成细小碎块,按比例加入PBS液后研碎,获取组织匀浆,离心后取上清液检测。MVD检测采用免疫组化SP法,鼠抗人CD34单克隆抗体及试剂盒购自武汉博士德生物工程公司。每张切片在100低倍光镜下挑选微血管分布最密集区,然后在200高倍光镜下计算5个视野的微血管数目取平均值。
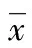
2 结 果
进展期大肠癌外缘癌组织浸液t-PA浓度低于癌旁正常肠管组织(P<0.01),外缘癌组织的微血管密度高于正常(P<0.01)。相关性分析显示,t-PA浓度与MVD呈负相关(r=-0.570 8)。
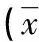
表1 研究组和对照组t-PA浓度及微血管密度的比较±s)
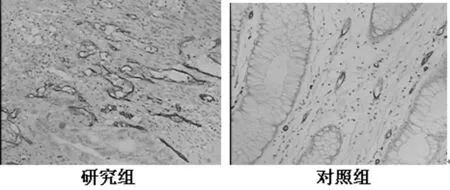
图1 SP染色,CD34定位于血管内皮细胞的细胞膜与细胞质,研究组的密度明显高于对照组
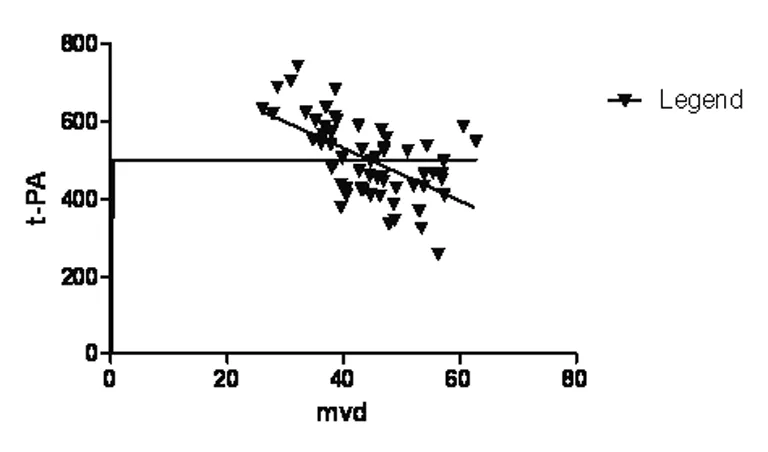
图2 大肠癌组t-PA浓度与MVD的相关性分析
3 讨 论
肿瘤的生长和浸润转移同时存在细胞外基质的降解和微血管基膜的生成两种微观过程。这两种过程由大量的信号分子来综合调控。有研究证实,乙酰肝素酶、尿激酶型纤溶酶原激活物、基质金属蛋白酶等能够介导降解细胞外基质的活性分子在癌组织中大量表达。而多项研究发现,作为尿激酶型纤溶酶原激活物的同类型物质,组织型纤溶酶原激活物同样能介导细胞外基质的降解,却在肿瘤组织中低表达。
本研究严格选取已浸润浆膜层的进展期大肠癌外缘癌组织作为检测对象,因为进展期的肿瘤生长较为成熟,肿瘤内各种活性因子表达较高,而处于外缘的癌组织侵袭性更强,血管生成更为密集,并且我们除外了急性肠梗阻的病例,因肠管扩张组织水肿能改变被检测物的浓度,故检测结果具有代表性。本研究发现,在外缘癌组织中的t-PA浓度确实明显低于正常组织,而微血管密度却显著高于正常。
正常情况下t-PA 及PAI-1分布在血管腔表面,并且存在动态平衡调节着血浆纤溶活性,由于新生微血管内皮细胞结构功能不完整,t-PA 能够扩散至腔外,从而能够降解微血管基膜及细胞外基质,阻碍微血管的生成。笔者认为肿瘤组织通过某种信号介导降低血管内皮细胞的t-PA合成分泌,同时增加PAI-1的表达,阻断t-PA对新生微血管基膜的降解,有助于新生内皮细胞的稳定附着,从而促进微血管的生成。并且t-PA浓度降低后造成纤溶酶活性减低,造成局部的高凝状态,高凝状态可以减少免疫细胞的造访,可以提供相对稳定的物理环境以维持各种活性因子的浓度,有利于肿瘤细胞的复制和微血管的生成。
[1]吴庆玉,徐德胜.数种恶性肿瘤患者血浆t-PA浓度分析[J].北京医科大学学报,1996,28(3):234.
[2]Hu K,Yang J,Tanaka S,et al.Tissue-type plasminogen activars acts as a cytokine that triggers intracellular signal transduction and induces matrix metalloproteinase-9 gene expression[J].J Biol Chem,2006,281(4):2120-2127.
[3]Diaz VM,Hurtado M,Thomson TM,et al.Specific interaction of tissue-type plasminogen activator(t-PA) with annexin II on the membrane of pancreatic cancer cells activates plasminogen and promotes invasion in vitro[J].Gut,2004,53(7):993-1000.
[4]Poon RT,Ng IO,Lau C,et al.Tumor Microvessel Density as a Predictor of Recurrence After Resection of Hepatocellular Carcinoma:A Prospective Study[J].J Clin Oncol,2002,20(7):1775-1785.
[5]刘大林,陈国玉.胃癌组织中微血管密度和尿激酶型纤溶酶原激活物的意义[J].江苏医药杂志,2003,29(1):53-54.
[6]何旭,胡志恒.尿激酶型纤溶酶原激活物系统与肿瘤关系的研究进展[J].海军医学杂志,2005,26(1):75-77.
[7]卢兴国,张桂娣.肝癌组织浸液尿激酶性和组织型纤溶酶原激活物的检测[J].基础医学与临床,2003,25(5):572-573.
[8]沈友进,尹俊.组织型纤溶酶原激活剂研究进展[J].广东医学 2008,29(9):1581-1584.
[9]Casslén B,Bossmar T,Lecander I.Plasminogen activators and plasminogen activator inhibitors in blood and tumor fluids of patients with ovarian cancer[J].Eur J Cancer,1994,30A(9):1302-1309.
[10]De Cremoux P,Grandin L,Diéras V,et al.Urokinase-type Plasminogen Activator and Plasminogen-activator-inhibitor Type 1 Predict Metastases in Good Prognosis Breast Cancer Patients [J].Anticancer Res,2009,29(5):1475-1482.

