促红细胞生成素对脑缺血再灌注大鼠脑内NF-κB表达的影响研究
牟 华
(辽宁医学院,辽宁锦州 121001)
脑缺血再灌注损伤是指脑缺血恢复血液再灌注后,其缺血性损伤反而进一步加重的现象。脑缺血再灌注损伤是一个复杂的病理过程,可造成脑细胞损伤,引起严重神经功能障碍,在临床上具有较高致残率和病死率。目前,临床常用的治疗药物虽然在一定程度上有助于减轻损伤和促进脑功能的恢复,但仍不能令人满意[1]。促红细胞生成素(erythropoietin,EPO)作为中枢神经系统的一个营养及保护因子,能对多种脑损伤模型起保护作用[2]。其机制可能是通过减轻损伤后炎症反应,抑制一氧化氮(NO)的合成及抗自由基,抑制神经细胞凋亡及抗氧化等作用对抗脑缺血再灌注损伤产生保护作用[3-4]。本研究拟通过研究EPO对大鼠脑缺血再灌注后脑组织中核因子-κB(NF-κB)表达水平的影响,为进一步了解EPO对脑缺血再灌注损伤保护机制提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级成年SD大鼠45只,体质量250~300 g,购自辽宁医学院实验动物中心,雌雄不限。
1.1.2主要试剂与药品 重组人促红细胞生成素购自深圳生鹏生物科技有限公司;水合氯醛购自东北制药总厂;红四氮唑(TTC)、NF-κB免疫组织化学检测试剂盒、TUNEL凋亡检测试剂盒购自武汉博士德生物工程有限公司;DAB 显色试剂盒购自上海润成科技有限公司。
1.1.3主要仪器 HQP-2158J型切片机、HTP-100E烘片机购自武汉海瑞特有限公司;双目光学显微镜购自日本Olympus公司。
1.2方法
1.2.1实验动物分组与给药 45只大鼠随机分为假手术组、脑缺血再灌注模型组(模型组)与EPO治疗组(治疗组),每组15只。假手术组、模型组于再灌注前给予腹腔注射生理盐水,治疗组于再灌注前腹腔注射EPO(3 000 U/kg)。所有大鼠均单笼饲养,自由饮水摄食。
1.2.2动物模型建立 模型组与治疗组参照相关文献采用改良线栓法[5]将SD大鼠制成一侧大脑中动脉(MCA)阻断缺血再灌注损伤模型。于大鼠腹腔注射10 g/L戊巴比妥钠(40 mg/kg)麻醉,仰卧位固定,聚维酮碘消毒手术区后,于颈部正中切开,分离右侧颈总动脉、颈外动脉和颈内动脉,用动脉夹夹住颈总动脉并结扎颈外动脉,在颈总动脉分叉处向颈内动脉插入尼龙线约(18.5±1.0)mm,至MCA起始部位出现明显阻力感以完全阻断血流,然后松开动脉夹,并结扎颈内动脉。术后缝合伤口,2 h后拔出尼龙线,即造成大鼠局灶性脑缺血再灌注损伤模型。模型成功的标志为爬行时向左转圈或左侧跌倒者,提尾时左前肢内收屈曲。未达到上述标准者为大鼠MCA缺血再灌注模型制作失败,不纳入实验组。凡有蛛网膜下腔出血者均不纳入实验组。假手术组不插入尼龙线和结扎血管,其他步骤同上。
1.2.3神经功能缺损评分 于缺血再灌注后4、12、24 h,对各组大鼠的神经功能缺损进行评分,评分标准参考文献[6]:0分为无神经损伤症状;0.5 分为竖毛,轻度运动低下;1分为前肢屈曲,运动障碍;2分为行动不协调,屈曲姿势,向对侧转圈;3分为偏瘫,向对侧倾倒,不能站立行走;4分为痉挛,嗜睡,意识丧失;5分为死亡。
1.2.4脑梗死体积的检测 再灌注24 h后,用10%水合氯醛麻醉大鼠,断头取脑,生理盐水冲洗后-20 ℃放置5 min,然后用双面刀片沿冠状切面切成5片,每片厚度 2 mm,置入盛有1%的TTC溶液中,37 ℃水浴30 min后置入10%多聚甲醛中固定。梗死部分呈苍白色,正常部分呈红色。拍照并输入电脑,用图像处理软件计算脑梗死体积以及占同侧大脑半球百分比。
1.2.5免疫组织化学检测各组大鼠脑组织NF-κB蛋白表达情况 再灌注24 h后液氮处死大鼠,断头取大脑海马组织,4 ℃多聚甲醛固定、脱水、浸蜡包埋后切成厚约3 μm的连续冠状石蜡切片。经二甲苯脱蜡,梯度乙醇脱水处理,3%过氧化氢溶液阻断过氧化物酶活性,抗原修复,蒸馏水漂洗,加入适量的NF-κB一抗,漂洗、加二抗、PBS冲洗,DAB显色,苏木素复染细胞核,透明、封片等步骤,在光学显微镜下观察,NF-κB蛋白表达阳性细胞的细胞质或细胞核内出现棕黄色的颗粒,高倍镜下每张切片随机取10个不重复视野,显微照相,记取阳性细胞,输入计算机进行图像分析。
1.2.6TUNEL法检测各组大鼠脑细胞凋亡率 取海马冠状石蜡切片,常规二甲苯、乙醇脱蜡,严格按照试剂盒说明书进行操作。光学显微镜下观察细胞核中有棕黄色颗粒者为阳性凋亡的细胞。高倍镜计数10个不重复视野中的细胞总数和凋亡阳性标记细胞数,计算百分率。

2 结 果
2.1缺血再灌注后各组神经功能缺损评分 从缺血后再灌注4、12、24 h后神经功能评分可见,治疗组与模型组大鼠4 h时神经功能评分比较,差异无统计学意义(P>0.05);12、24 h时治疗组大鼠评分均有降低,差异有统计学意义(P<0.05),结果见表1。
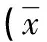
表1 各组大鼠神经功能缺损评分比较±s,分)
△:P<0.05,与治疗组同时间点比较。
2.2各组脑梗死体积比较 缺血后再灌注24 h,TTC染色后发现,假手术组大鼠脑组织呈均匀的红色,无梗死灶;模型组大鼠脑组织出现苍白色梗死灶,梗死边界整齐、清晰;治疗组大鼠脑组织梗死灶边界不整齐,模糊不清。治疗组脑梗死体积小于模型组,差异有统计学意义(P<0.05),见表2。
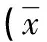
表2 各组脑梗死体积比较±s)
△:P<0.05,与治疗组比较。
2.3各组大鼠脑组织NF-κB蛋白表达情况 经免疫组织化学检测可见,再灌注24 h内,模型组与治疗组NF-κB蛋白表达有增加,但是治疗组NF-κB蛋白表达比模型组低,差异有统计学意义(P<0.05),见表3。

表3 各组NF-κB蛋白表达情况比较,%)
△:P<0.05,与治疗组同时间点比较;★:P<0.05,与假手术组同时间点比较。
2.4各组大鼠脑组织神经元凋亡细胞比较 应用TUNEL法检测各组大鼠脑组织神经原细胞凋亡情况,光学显微镜下观察凋亡细胞主要表现为细胞质或细胞核黄染,核固缩,有大量棕黄色颗粒。在缺血再灌注后4、12、24 h时,与模型组比较,治疗组大鼠平均凋亡细胞显著降低,差异有统计学意义(P<0.05),见表4。
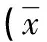
表4 各组神经元凋亡细胞比较±s,%)
△:P<0.05,与治疗组同时间点比较;★:P<0.05,与假手术组同时间点比较。
3 讨 论
脑缺血再灌注损伤的发生与多种因素有关。NF-κB是一类普遍存在的转录因子,激活后可和许多基因启动子区域的固定核苷酸序列结合而启动基因转录功能,通过调解编码细胞因子、细胞黏附分子和一些生理与病理状态下急性期蛋白的基因转录,在机体免疫应答、炎症反应等方面发挥重要作用[7-8],其作用很可能是通过多条信号转导通路产生综合效应。研究表明,NF-κB激活可导致脑缺血再灌注神经元凋亡,其机制尚不明确,可能是NF-κB的持续激活诱导细胞促凋亡基因的表达,导致神经元凋亡[9-10],并且,NF-κB激活后可诱导多种细胞因子、黏附分子和趋化因子等的高表达,从而加重脑缺血再灌注损伤。因此,抑制NF-κB激活可成为防治脑缺血再灌注损伤的新策略。
EPO作为中枢神经系统一种很有前途的神经保护剂,目前,在临床治疗脑血管病中的应用日益受到关注。本研究观察到,通过EPO治疗,治疗组大鼠脑组织中NF-κB蛋白表达明显低于模型组,表明EPO可降低缺血脑灌注模型大鼠脑中NF-κB蛋白表达;通过TUNEL法检测凋亡细胞证实EPO可通过减少神经元凋亡而起到神经保护作用。而缺血再灌注后各组大鼠神经缺损评分与脑梗死体积检测表明,EPO对脑缺血再灌注损伤具有保护作用。因此,从以上实验结果可知,EPO可通过抑制NF-κB蛋白表达,减少神经细胞凋亡,从而起到保护大脑的作用。其抑制NF-κB蛋白表达的机制尚需进一步研究。
[1]张立颖,张剑辉.脑缺血的药物治疗研
究进展[J].中国医院药学杂志,2006,26(2):199-201.
[2]聂晶,杜亮,黄燮南,等.天麻素对大鼠脑缺血再灌注损伤的保护作用[J].华西药学杂志,2010,25(4):423-425.
[3]杨彦玲,朱文侠,陈雅慧,等.促红细胞生成素对脑缺血/再灌注损伤的保护作用[J].中国应用生理学杂志,2010,26(2):152-153.
[4]Kumral A,Gene S,Ozer E,et al.Erythropoietin downregulates bax and DP5 pro-apoptotie gene expression in neonatal hypoxie-isehemie brainInjury[J].Biol Neonate,2005,89(3):205-210.
[5]吴松笛,耿晓英,丁桃英,等.改良线栓法制作大鼠局灶性脑缺血再灌注模型的实验研究[J].陕西医学杂志,2006,35(10):1316-1318.
[6]Gonzalez FF,Mc Quillen P,Mu D,et al.Erythropoietin enhances long-term neuroprotection and neurogenesis in neonatal stroke[J].Dev Neuro Sci,2007,29(3):321-323.
[7]李昌植.栓线法制备MCAO模型大鼠研究进展[J].中国医学研究与临床,2007,5(11):59-63.
[8]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:214-234.
[9]Panwalkar A,Verstovsek S.Nuclear factor-kappa B modulation as a therapeutic approach in hematologic malignancies[J].Cancer,2004,100(8):1578-1589.
[10]郭东琳,周红.NF-κB在蛋白酶激活受体介导的信号通路中的作用研究进展[J].临床检验杂志,2010,28(6):453-454.

