水飞蓟素对野百合碱诱发肺动脉高压大鼠肺血管重构的保护作用
杨 勇,吕进泉,赵文生
(江苏大学附属医院儿科,江苏镇江 212001)
肺动脉高压(pulmonary hypertension,PH)是由于肺循环受限引起肺血管阻力进行性增加,最终导致右心衰竭的综合征。病情进展迅速,预后极差[1]。本研究通过大剂量外源性水飞蓟素干预经腹腔注射野百合碱(MCT)复制的肺动脉高压大鼠模型,观察肺动脉高压大鼠模型的肺血管重构及Fas mRNA的表达变化,探讨水飞蓟素对肺动脉高压大鼠模型肺血管重构的保护作用及机制。
1 材料与方法
1.1实验动物 雄性Sprague Dawley(SD)大鼠24只,体质量230~250 g,由江苏大学实验动物中心提供。
1.2仪器与试剂 MCT(美国Sigma公司);水飞蓟素(天津天士力制药股份有限公司),Medlab-U/8C502生物信号处理系统(南京美易科技有限公司);Bio-Rad实时定量PCR仪C1000(伯乐生命医学产品有限公司);α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(武汉博士德生物工程有限公司,货号:BM0002);RT试剂盒(Fermentas中国公司,货号:K1622);荧光定量PCR试剂盒(东洋纺生物科技有限公司);TUNEL凋亡试剂盒(南京凯基);Fas引物序列(扩增产物198 bp,上海生工生物工程有限公司):上游5′-TGA AGA CAT CCT TGA GCC TTG-3′,下游5′-AGA TTC ATT GGC ACA CTT TCA G-3′;β-actin引物序列(扩增产物207 bp,上海生工生物工程有限公司),上游5′-CAC CCG CGA GGT CAA CCT TC-3′,下游5′-CCC ATA CCC ACC ATC ACA CC-3′。
1.3实验动物分组、模型制备与干预 随机分为正常对照组(C组)、MCT诱发肺动脉高压模型组(M组)、水飞蓟素治疗组(S组),每组8只。MCT先溶于1 mol/L浓盐酸,加去离子水,然后用1 mol/L的氢氧化钠调pH至7.4,最终配置成浓度20 mg/mL野百合碱溶液。M组、S组大鼠一次性腹腔注射MCT 60 mg/kg,C组一次性腹腔注射生理盐水3 mL/kg。将水飞蓟素用生理盐水配成50 mg/mL溶液,S组自第2天开始按照水飞蓟素每次150 mg/kg,每天灌胃3次,共27 d。M组和C组用生理盐水每次2 mL/kg,每天灌胃3次。
1.4观测指标及检测方法
1.4.1右心导管法测定平均右心室收缩压(right ventricular systolic pressure,RVSP) 28 d后,记录大鼠质量,右心导管法测定平均肺动脉压,大鼠以200 mg/mL乌拉坦麻醉(2.5 mL/kg)后用聚氯乙烯导管插入右颈外静脉,缓慢进入右心房、右心室,导管内加入肝素盐水,测压导管接压力传感器记录压力变化。
1.4.2心肺组织取材 完成肺动脉压测量后,取出分离心肺组织。测量心指数:分离右心室,除去心耳、心房,用滤纸吸去血液、盐水。分别称取右心室和左心室加室间隔的质量,右心室肥大指数(right ventricular hypertrophy index,RVHI)=右心室质量/(左心室质量+室间隔质量)。右肺以40 g/L多聚甲醛固定,常规石蜡包埋后切片,用HE染色、α-SMA免疫组织化学染色、TUNEL法检测肺动脉平滑肌细胞凋亡。左肺置于液氮中冻存,用于Fas mRNA半定量RT-PCR检测。
1.4.3HE染色 肺组织石蜡切片常规脱蜡至水,HE染色,脱色透明后,中性树胶封片。显微镜下观察肺动脉大体形态变化。
1.4.4肺动脉α-SMA免疫组织化学染色 肺组织石蜡切片常规脱蜡至水,SP法检测α-SMA抗原的表达,1∶100稀释一抗,DAB显色。胞质棕黄色着色为阳性信号。采用Image-Pro Plus图像分析系统,随机选取50~100 μm血管20根,取平均光密度值(平均光密度值=累积光密度/面积)评价肺小动脉平滑肌细胞增殖程度。
1.4.5TUNEL法检测大鼠肺动脉平滑肌细胞凋亡 肺组织切片脱蜡至水,参照TUNEL凋亡试剂盒说明书进行操作。结果判定:显微镜下随机选取50~100 μm左右的肺动脉,计数500个肺动脉平滑肌细胞中的凋亡细胞数,求得凋亡指数(AI)。AI=凋亡细胞数/总细胞数×100%。
1.4.6肺组织Fas mRNA RT-PCR检测 采用Trizol法提取肺组织总RNA,核酸蛋白分析仪测总RNA的纯度。cDNA第一链的合成和荧光定量PCR过程采用RT试剂盒和荧光定量PCR试剂盒,按照说明书操作。扩增反应条件:95 ℃预变性1 min,按下列步骤扩增40个循环,95 ℃变性5 s,56 ℃退火30 s,72 ℃延伸30 s;最后一个循环后,72 ℃延伸10 min。

2 结 果
2.1RVSP及RVHI的变化 与C组相比,MCT诱发28 d后,M组的RVSP 及RVHI明显升高(P<0.05)。经干预后,S组RVSP及RVHI低于M组(P<0.05),见表1。
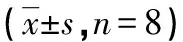
表1 3组大鼠RVSP 和RVHI变化的比较
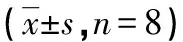
表2 3组大鼠肺动脉平滑肌细胞α-SMA、凋亡指数及肺组织Fas mRNA表达的比较
2.2肺组织HE染色、α-SMA免疫组织化学染色、细胞凋亡指数、Fas mRNA相对表达量 HE染色所见:C组(封3图1A)肺动脉管壁菲薄;S组(封3图1B)肺动脉管壁较C组明显增厚,但较M组薄,炎症细胞浸润减轻;M组(封3图1C)肺动脉管壁明显增厚,管腔狭窄,大量炎症细胞浸润。与M组(封3图2A)比较,C组(封3图2B)α-SMA表达低(P<0.01)、Fas mRNA表达高(P<0.01)、细胞凋亡指数升高(P<0.05),S组(封3图2C)α-SMA表达低(P<0.01)、Fas mRNA表达高(P<0.01)、细胞凋亡指数稍升高,见表2。
3 讨 论
目前,研究认为,炎症、过氧化物、遗传基因等多种因素损伤肺微小动脉内皮细胞是肺动脉高压(PAH)发生的始动环节[2]。肺动脉内皮细胞功能紊乱、平滑肌细胞和纤维原细胞活化、血管壁细胞间交互作用、循环祖细胞黏附、血管壁的持续性收缩是PAH血管重构主要机制[3]。SD大鼠腹腔注射MCT后,药物经肝脏代谢生成五元杂环的吡咯MCT,可特异性损伤肺血管内皮细胞,引起内皮细胞功能障碍、血管平滑肌细胞增生、肺动脉压力增高,复制肺动脉高压模型[4]。
本实验给予大剂量水飞蓟素干预S组大鼠后,S组大鼠粪便稍有稀烂改变,1周后好转,未见其他不良反应。给予大剂量水飞蓟素干预S组大鼠,大鼠RVSP下降,肺血管重构的病理改变减轻,说明大剂量水飞蓟素干预可以减轻肺动脉高压模型大鼠肺血管的重构,改善肺动脉高压症状。其机制可能为:(1)抗氧化作用。氧化损伤可以通过损伤血管内皮、促进肺动脉平滑肌细胞增殖、促进血管外基质增生等多条途径参与肺血管重构[5]。活性氧(reactive oxygen species,ROS)是细胞内重要的具有氧化还原潜能的氧衍生物,参与血管平滑肌细胞增殖、分化、凋亡、迁移等多种功能调控[6]。水飞蓟素具有良好的抗氧化和自由基清除活性[7]。水飞蓟素可以抑制细胞与组织ROS的产生,并促进细胞组织产生超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px),通过抑制氧自由基的过度产生和促进氧自由基降解酶生成抑制细胞损伤及血管重构。(2)抗炎作用。研究显示炎症反应参与了肺动脉高压的发生及发展过程,中性粒细胞等炎症细胞、IL-1、IL-6、TNF-α、PDGF、VEGF等炎症因子均参与了内皮细胞损伤及血管壁重构[8-10]。水飞蓟素可以通过抑制NF-κB的转录活性、清除活性氧自由基等机制抑制炎症反应[11-12]。本实验观察到大剂量水飞蓟素干预后肺微小动脉周围炎症反应减轻,证实水飞蓟素可以通过抗炎作用减轻血管重构。(3)本实验研究发现水飞蓟素干预MCT诱发PAH模型大鼠可以提高肺组织Fas mRNA表达,肺动脉血管平滑肌细胞凋亡增多,可部分调节血管平滑肌的增殖与凋亡平衡,具体机制尚不明确[13]。(4)基质金属蛋白酶(matrix metalloprotenases,MMPs)大量分泌可以降解弹力纤维,破坏正常胶原结构,诱发肺小动脉重构。水飞蓟素可以通过降低细胞MMPs表达水平,抑制胶原合成,发挥对组织的保护作用[14-15]。
本实验结果显示大剂量水飞蓟素可以减轻MCT诱发肺动脉高压大鼠模型肺组织炎症细胞浸润,促进肺动脉高压大鼠肺组织Fas mRNA表达,提高肺动脉高压大鼠肺血管平滑肌细胞凋亡,降低RVSP,减轻肺动脉重构变化,对MCT诱发的肺动脉高压大鼠具有保护作用。
[1]MclaughlinVV,ArcherSL,BadeschDB,etal.ACCF/AHA2009expertconsensusdocumentonpulmonaryhypertension[J].JAmCollCardiol,2009,53(17):1574-1619.
[2]Tuder RM,Abman SH,Braun T,et al.Development and pathology of pulmonary hypertension[J].J Am Coll Cardiol,2009,54(1):1-9.
[3]Morrell NW,Adnot S,Archer SL,et al.Cellular and molecular basis of pulmonary arterial hypertension[J].J Am Coll Cardiol,2009,54(1):21-31.
[4]熊迈,姚尖平,徐颖琦,等.两种大鼠肺动脉高压模型肺血管重塑的血流力学、组织学和体视学指标变化[J].中华实验外科杂志,2009,26(8):1043-1045.
[5]刘斌,彭军.氧化应激和肺动脉高压血管重构[J].中国动脉硬化杂志,2011,19(6):539-542.
[6]魏倩萍,邓华聪.活性氧簇调控的信号通路与糖尿病肾病[J].重庆医学,2005,34(3):446-448.
[7]韩玫瑰,韩子明,郭勇.水飞蓟素对大鼠肾小管间质纤维化的影响及作用机制探讨[J].细胞与分子免疫学杂志,2011,27(3):339-344.
[8]卢献灵,何建国.肺动脉高压的炎症发病机制[J].中华结核和呼吸杂志,2009,32(11):862-865.
[9]董旭,王钢,王怀良,等.蛋白激酶C亚型在慢性“炎症性”肺动脉高压大鼠肺动脉中的表达[J].解放军医学杂志,2007,32(6):558-560.
[10]丁晶,曾超美,杜军保.气体信号分子与肺动脉高压的发病机制[J].实用儿科临床杂志,2009,24(13):1026-1029.
[11]王占海,沈凌鸿,陈向东,等.水飞蓟素对脂多糖性大鼠急性肺损伤的拮抗作用[J].中国病理生理杂志,2007,23(2):280-283.
[12]陈晓英,王玉林,王伟.核因子-κB抑制剂PDTC在肺动脉高压中的作用[J].山东大学学报:医学版,2008,47(1):55-63.
[13]陆俊羽,姚伟,钱桂生,等.Fas和FasL在Na/H交换器-1抑制诱导缺氧大鼠肺动脉平滑肌细胞凋亡中的作用[J].中国危重病急救医学,2005,17(9):515-518.
[14]王蕾蕾,王国贤.水飞蓟素对糖尿病大鼠心肌损伤的保护作用[J].中国动脉硬化杂志,2010,18(8):625-629.
[15]曾红军,庞玉生,梁秀安.基质金属蛋白酶-1、9在小儿先天性心脏病肺血管重构中的作用[J].广西医学,2009,31(10):1409-1411.

