低频超声对大鼠颊囊黏膜溃疡组织SOD、MDA含量的影响*
杨明聪,范小平,王 春
(重庆市口腔疾病与生物医学研究中心/重庆医科大学附属口腔医院牙周黏膜科 401147)
随着社会的进步,人们的生活节奏越来越快,工作与生活压力也越来越大,复发性口腔溃疡的发病率逐年升高,其患病率已高达20%左右,在口腔疾病中仅次于龋病和牙周病,位居第三。口腔溃疡发作时疼痛明显,为此,寻求一种简便、安全、快捷的治疗方法具有重要的临床意义。人们发现局部治疗是口腔溃疡最有效的治疗方式,但受口腔特殊环境的影响,疗效存在局限性[1]。近年来,随着超声医学的迅速发展,超声作为一种安全有效的治疗手段,已广泛应用于临床。研究发现低频超声具有显著的空化作用,能破坏角质层的脂质双分子层结构,增加皮肤黏膜通透性,即具有显著的增透效应[2];同时,低频超声的机械振荡可对组织产生按摩及松懈作用,增强组织局部血液循环,刺激成纤维细胞、巨噬细胞及血管的生成,加速创面愈合[3]。本研究拟通过构建大鼠颊囊黏膜溃疡模型,观察低频超声对溃疡愈合时间及溃疡组织中超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malondialdehyde,MDA)含量的影响,客观评价低频超声在大鼠颊囊黏膜溃疡治疗中的效果,为低频超声应用于临床口腔溃疡的局部治疗提供实验依据。
1 材料与方法
1.1材料 健康清洁级Sprague-Dawley(SD)大鼠36只,雌雄各半,体质量(180±20) g,由重庆医科大学动物实验中心提供(CQLA-0749);SOD、MDA测定试剂盒购自南京建成生物实验材料研究所;甲基紫精(100 mg)为美国Sigma公司产品。实验仪器包括:双目光学显微镜(Olympus)、低频超声治疗仪(重庆海扶公司,ZY型,工作频率为1.00~1.10 mHz,单路晶片输出声功率为0.11~3.50 W,脉冲占空比为50%,脉冲输出频率为1 kHz)、721 A型分光光度计(江苏)、台式离心机(江苏)。
1.2方法
1.2.1大鼠颊囊黏膜溃疡模型的建立及分组 36只大鼠随机分为对照组(n=6)及大鼠颊囊黏膜溃疡模型组(n=30);适应性饲养及正常光照1周后,改良陈谦明等[4]介绍的制备动物溃疡模型方法,将溃疡模型组大鼠用10%水合氯醛(3 mL/kg)经腹腔静脉注射麻醉后,取仰卧位固定于简易手术台上,用平齿镊撑开上、下颌,暴露颊囊,用5号皮试针将10 mmol/L的甲基紫精溶液0.25 mL分别注入左、右颊囊的黏膜下约0.80 cm处,最后,用100 ℃、直径为5 mm的铁钉在左右颊囊热损伤处理3 s,24 h后制成大鼠颊囊黏膜溃疡模型。根据不同的处理方式,将颊囊黏膜溃疡模型大鼠随机分为溃疡组(n=6)、药物组(n=6)及低频超声组(n=18);低频超声组大鼠按超声波输出功率再分为1.10、1.58、2.06 W组,每组6只。
1.2.2处理方法 对照组及溃疡组大鼠正常饲养,不做任何处理;药物组大鼠在乙醚麻醉下用1%碘甘油局部涂擦溃疡处[5],1次/天,连续3 d;低频超声组按超声波输出功率分别给予相应的脉冲低频超声处理90 s(在大鼠颊囊溃疡对应外侧皮肤处涂超声偶联剂后,将超声探头置于颊囊外侧皮肤),1次/天,连续3 d。
1.2.3大鼠颊囊黏膜溃疡愈合时间的观察 处理结束24 h后,各组随机选取3只大鼠进行溃疡愈合时间的观察,持续8 d。
1.2.4大鼠颊囊黏膜溃疡组织匀浆的制备 各组处理结束24 h取余下的3只大鼠用10%水合氯醛(3 mL/kg)经腹腔静脉注射麻醉,用注射针头蘸取甲紫在溃疡上下左右四限处刺入黏膜,标记溃疡部位和面积大小,取两侧黏膜溃疡组织,用4 ℃生理盐水漂洗,除去血液,滤纸拭干后称质量,将组织剪碎,置于匀浆器中加入生理盐水,将其研磨成10%的组织匀浆,随后将匀浆液离心10 min(3 000 r/min),取上清液进行检测。
1.2.5大鼠颊囊黏膜溃疡组织中SOD、MDA含量的检测 按检测试剂盒说明,采用分光光度法测定样品管的吸光度值,计算组织中SOD、MDA的含量。计算公式为:
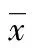
2 结 果
2.1大鼠颊囊黏膜溃疡的愈合时间 采用改良陈谦明法,24 h后大鼠颊囊部位出现明显溃疡。各组大鼠颊囊黏膜溃疡的愈合时间见图1。溃疡组大鼠在观察第7天开始有溃疡愈合,第8天完全愈合;药物组大鼠在观察第6天有2只愈合,第8天全部愈合;低频超声组均在观察第4天开始有溃疡愈合,第6天全部愈合。药物组及低频超声组大鼠颊囊黏膜溃疡的平均愈合时间均比溃疡组短(P<0.05),但不同功率低频超声组大鼠颊囊黏膜溃疡的愈合时间比较,差异无统计学意义(P>0.05)。
2.2大鼠颊囊黏膜溃疡组织中MDA、SOD含量的比较 处理结束24 h后,各组大鼠颊囊黏膜溃疡组织中MDA、SOD含量有一定差异。SOD含量低频超声组较溃疡组显著升高(P<0.05),与对照组,、药物组比较差异无统计学意义(P>0.05),溃疡组较对照组显著降低(P<0.05);MDA含量低频超声组较溃疡组显著降低(P<0.05),与对照组、药物组比较差异无统计学意义(P>0.05),溃疡组较对照组显著升高(P<0.05),见表2。
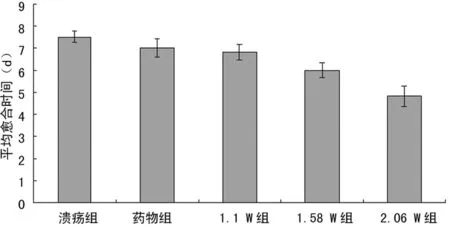
图1 各组大鼠口腔溃疡的愈合时间
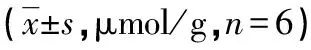
表2 各组大鼠颊囊黏膜组织中MDA、SOD含量的比较
3 讨 论
近年来,越来越多的资料表明,口腔黏膜病的发病率逐年升高。同时由于其发病因素的不确定性及治疗方法的复杂性,该疾病的治疗日渐成为广泛关注的课题,尤其是口腔黏膜病中发病率最高的口腔溃疡更是人们关注的重点,因其发病原因不清楚,多采用对症治疗以及对可能的病因进行治疗。对症治疗主要是以局部治疗为主,常受到口腔特殊环境的限制。
研究报道的口腔溃疡发病因素甚多,尚无统一认识,推测其可能是多因素作用的结果,研究发现氧自由基可能与其发病有关。氧自由基的化学性质活跃,能攻击细胞膜上的脂肪酸,产生过氧化物而引发疾病。但是,由于人体内存在自由基清除酶如SOD、过氧化氢酶等,正常情况下机体产生的自由基可迅速被SOD、过氧化氢酶清除,从而使体内环境维持在一个稳定的水平[6-7]。SOD活性反映机体清除氧自由基的能力,但当机体受到外在因素刺激时,自由基的产生与清除失衡,自由基产生过多,使组织损伤,引发疾病[8-10]。研究发现复发性口腔溃疡患者的SOD活性较健康者明显降低,而脂质过氧化物含量显著升高,提示在复发性口腔溃疡的发病机制中,氧自由基的大量产生以及SOD活性的下降可能是引起组织破坏的一个重要环节[11]。SOD活性下降,其清除氧自由基的能力下降,脂质过氧化物产生过多。而MDA是脂质过氧化反应的最终产物,其产生的MDA会使体内SOD活性进一步降低,过氧化物歧化反应清除自由基的能力进一步下降,使氧自由基的产生和消除不能达到平衡,产生脂质过氧化物不良反应,进一步加重病情。因此,测定SOD和MDA的含量变化可以间接反映氧自由基在体内的生成和清除情况以及对组织的损伤程度和体内抗氧化防御作用的功能状况[12]。本实验结果显示,大鼠颊囊黏膜溃疡时,SOD活性明显下降,MDA含量明显升高,当用功率为1.10、1.58、2.06 W低频超声处理后,颊囊黏膜溃疡组织SOD含量有显著升高,而MDA含量明显下降,提示低频超声可能通过对体内SOD活性的影响而对氧自由基的产生和消除发挥一定的平衡作用。低频超声组与药物组比较,SOD活性及MDA含量的差异无统计学意义,说明低频超声对口腔溃疡的作用与药物对口腔溃疡的作用相似,均对口腔溃疡的愈合起促进作用。
低频超声的温热效应及空化效应可能刺激组织中酶的活性,从而提高机体的抗氧化能力。本实验结果表明,采用1.10、1.58、2.06 W低频超声处理大鼠颊囊黏膜溃疡后,其溃疡愈合时间有所缩短,其中2.06 W组的愈合时间最短;脉冲低频超声输出功率为1.10,1.58、2.06 W处理组与溃疡组比较,组织中SOD含量显著升高(P<0.05),而MDA含量则相反,在溃疡组织中其含量显著增高,低频超声处理后其含量降低(P<0.05)。提示在安全剂量范围内,不同功率的低频超声可使溃疡组织中氧自由基的产生和消除重新达到平衡,从而促进溃疡的愈合。
综上所述,脉冲低频超声在治疗口腔溃疡时,对溃疡愈合时间及溃疡组织中SOD及MDA的含量有一定影响,可促使氧自由基的生成和清除重新达到平衡,对口腔溃疡的愈合发挥一定的促进作用。选择输出功率为1.10~2.06 W的脉冲低频超声治疗口腔溃疡安全可行。
[1]李秉琦.口腔黏膜病学[M].2版.北京:人民卫生出版社,2006:85-90.
[2]Becker BM,Helfrich S,Baker E,et al.Ultrasound with topical anesthetic rapidly decreases pain of intravenous cannulation[J].Acad Emerg Med,2005,12(4):289-295.
[3]Mitragotri S,Coleman M,Kost J,et al.Transdermal extraction of analytes using low-frequency ultrasound[J].Pharm Res,2000,17(4):466-470.
[4]陈谦明,李秉琦.氧自由基对口腔黏膜损伤的动物实验研究:——动物模型的建立[J].华西口腔医学杂志,1993,11(1):62-64.
[5]冯燕,刘荣明.Smecta治疗口腔黏膜复发性阿弗他溃疡的临床探讨[J].口腔医学纵横杂志,2000,16(2):134-135.
[6]程茜,刘建国,郭玉书,等.银杏叶提取物对大鼠复发性口腔溃疡模型超氧化物歧化酶的影响[J].现代口腔医学杂志,2007,21(6):613-615.
[7]Okabe M,Saito S,Saito T,et al.Histochemical localization of superoxide dismutase activity in rat brain[J].Free Radiol Biol Med,1998,24(9):1470-1476.
[8]Gonzales R,Auclair C,Voisin E,et al.Superoxide dismutase,catalase,and glutathione peroxidase in red blood cells from patients with malignant diseases[J].Cancer Res,1984,44(9):4137-4139.
[9]Breuing KH,Bayer L,Neuwalder J,et al.Early experience using low-frequency ultrasound in chronic wounds[J].Ann Plast Surg,2005,55(2):183-187.
[10]Kawalec JS,Hetherington VJ,Pfennigwerth TC,et al.Effect of a diode laser on wound healing by using diabetic and nondiabetic mice[J].J Foot Ankle Surg,2004,43(4):214-220.
[11]Liu J,Zeng X,Chen Q,et al.An evaluation on the efficacy and safety of amlexanox oral adhesive tablets in the treatment of recurrent minor aphthous ulceration in a Chinese cohort:a randomized,double-blind,vehicle-controlled,unparallel multicenter clinical trial[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,102(4):475-481.
[12]Sasaki A,Mabuchi T,Serizawa K,et al.Different roles of nitric oxide synthase-1 and -2 between herpetic and posttherapeutic allodynia in mice[J].Neuroscience,2007,150(2):459-466.

