16种EPA-PAHs复合污染土壤的菌群修复
李 政,赵朝成,张云波,赵东风
(中国石油大学化学化工学院,山东青岛 266555)
16种EPA-PAHs复合污染土壤的菌群修复
李 政,赵朝成,张云波,赵东风
(中国石油大学化学化工学院,山东青岛 266555)
通过富集筛选获得一组PAHs降解混合菌群和3株降解单菌,利用变性梯度凝胶电泳(DGGE)技术分析混合菌群的组成,对16种多环芳烃(PAHs)复合污染土壤进行生物修复,同时考察混合菌群和单菌株在PAHs复合污染土壤中的生物修复效果。结果表明:混合菌群主要由3株已分离获得的降解单菌和5株未可分离培养的单菌组成;经过30 d的生物修复,混合菌群对土壤中总PAHs的降解率(54.17%)高于单一菌株(28.40%,31.95%,24.64%),并且对高相对分子质量PAHs的降解表现出了较大的优势,4环、5环、6环PAHs的降解率分别可达到71.26%、39.76%和42.86%;利用混合菌群来修复16种PAHs复合污染的土壤,可以避免一些未可分离培养的关键菌株的丢失,使PAHs的降解更加全面有效。
多环芳烃;污染土壤;混合菌群;生物降解
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是由两个或两个以上芳香环稠合在一起的一类化合物[1]。环境中的PAHs主要来源于石油污染、油轮泄漏、汽车尾气,以及煤、石油等天然燃料的不完全燃烧等。由于部分PAHs对生物具有“致癌、致畸变和致突变”作用,美国环境保护署(EPA)将其中16种PAHs确定为优先控制的有机污染物。PAHs的强吸附性使得它们在土壤环境中长期残留和积累[2],再通过呼吸直接进入人体,或者进入大气颗粒物、水和生物体等其他环境介质,间接影响人体健康[3]。虽然PAHs在环境中可以通过挥发、光解、化学氧化、吸附等多种途径去除,而生物修复技术因其经济性和二次污染少等特点成为处理该类污染物的最有效方法[4-6]。目前已发现多种微生物具有降解单一PAHs的能力[7],如鞘氨醇菌属(Sphingomonassp.)、假单胞菌属(Pseudomonassp.)、分枝杆菌属(Mycobacteriumsp.)和红球菌属(Rhodococcussp.)等,而环境中PAHs通常以多种组分同时存在,呈现其复合污染现象[8],并且高分子量PAHs(4~6环PAHs)对微生物生长有强抑制作用,生物可利用性很低[9],增加了降解的难度。研究[10]表明,混合菌群作为一种多菌体共存的生物群体,在其生长过程中能分解有机物,同时依靠各种微生物之间相互共生增殖及协同代谢作用降解环境中的有机物,并能激活其他具有净化功能的微生物,从而形成复杂而稳定的微生态系统。笔者通过富集培养,从PAHs长期污染的土壤中获得一组PAHs降解菌群,运用变性梯度凝胶电泳(DGGE)技术对该菌群的组成进行分析,并进一步验证此菌群对土壤中16种EPA-PAHs生物降解效果。
1 试验材料与方法
1.1 试验材料
正己烷(色谱纯)、16 EPA-PAHs混合标准样品等购自美国Supelco公司。
BUCHI R-210旋转蒸发仪(瑞士步琪有限公司),HZQ-HA水浴振荡器(哈尔滨东联电子技术开发有限公司),GC-6890型气相色谱仪配火焰离子检测器(FID)(美国安捷伦公司),GCMS-QP2010型气相色谱-质谱联用仪(日本岛津公司),KQ-400KDB型高功率数控超声波清洗仪(昆山市超声仪器有限公司)。
从新疆克拉玛依油田百口泉油区原油处理污泥池附近采集多年污染的土壤。采用棋盘式五点采样法,取浅层(0~20 cm)土壤,每点取样量大体一致,将各点取出的样品等量混合,装入样品袋中密封备用。土壤样品于暗处风干后过2 mm筛,冰箱4℃保存。土壤的基本物理化学性质为:pH值7.84,含水率27.3%,总有机质含量1.351%,总氮含量0.158%,总磷含量0.042%,总钾含量0.243%。
无机盐培养基(MSM):Na2HPO4、KH2PO4、NaNO3、MgSO4、CaCl2、FeSO4的质量浓度分别为0.6、0.2、4.0、0.3、0.01、0.01 g/L,酵母膏0.5 g/L,琼脂20 g/L(固体培养基用),pH值为7.2~7.4。
PAHs-MSM培养基:提取物经旋转蒸发后过硅胶柱净化,高纯氮气吹干后重新溶解于适量丙酮,移取一定的用丙酮溶解的PAHs母液(10 g/L)到已灭菌的MSM中,待丙酮挥发后使用。
1.2 PAHs降解菌群的富集筛选
将10 g土壤样品加入100 mL已灭菌的MSM中,经30℃、160 r/min摇床避光培养10 d后,将其5%(体积分数)转接至PAHs-MSM培养基中继续富集培养,连续转接5次至降解菌群结构趋于稳定。
采用稀释涂布法从富集培养后期的混合培养液中分离单菌,将丙酮溶解的PAHs母液(10 g/L)均匀涂抹于固体MSM培养基上,待丙酮自然挥发后使用。分离纯化的单菌用16SrDNA进行PCR扩增,扩增产物回收纯化后测序,并将测序结果在NCBI网站上进行核苷酸同源性比较,找出最为接近的细菌种类,确定菌株的种类范畴。
试验用菌剂为菌悬液,即在无菌条件下将处于对数生长期的菌液室温下5000 r/min离心10 min,收集菌体,用磷酸盐缓冲液清洗,5000 r/min再次离心10 min,反复清洗3次以上,制成菌悬液,含菌量为1.0×108CFU/mL。
1.3 PAHs降解菌群的PCR-DGGE分析
收集第五次转接后的混合菌群培养液,74 μm筛绢过滤去除残留PAHs干扰,8 000 r/min离心10 min收集菌体。采用TIANGEN细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取混合菌群的DNA。采用引物341F-GC/517R扩增细菌16SrDNA基因,用于 PCR-DGGE分离。变性梯度为30%~60%,在电压80 V下电泳12 h。DGGE条带的切胶测序操作参照文献[11]。对所得DNA序列与Genbank数据进行BLAST比对,获得最相似序列信息。
1.4 土壤中PAHs的生物降解
将10 g风干的土壤样品加入含有20 mL已灭菌MSM的三角瓶中,接种5 mL菌悬液,于室温下160 r/min摇床避光培养30 d。通过称重三角瓶的质量差,每3 d补充一次无菌水。同时做不接种菌悬液的对照试验(CK),并且所有的试验均设3个平行。
1.5 土壤中PAHs的分析
(1)PAHs提取方法。参照EPA(方法3550超声波提取、方法3630硅胶净化和方法8310多环芳烃分析)[12-14],用高压灭菌的玻璃离心管采集泥浆样品,4000 r/min离心5 min,置于冷冻干燥机干燥48 h后,称取2 g干土于玻璃离心管中,加入10 mL二氯甲烷与丙酮的混合溶剂(体积比为1∶1),超声萃取20 min后在4000 r/min条件下离心5 min,收集萃取液,如此连续超声萃取3次。合并萃取液过无水硫酸钠除去水分后用旋转蒸发仪将萃取液浓缩,更换溶剂为正己烷,然后过硅胶柱净化,收集洗脱液,再次浓缩,用高纯氮气定量至1 mL待测。
(2)PAHs分析方法。取PAHs混合标准样品(100 mg/L)用正己烷依次逐级稀释,配成5.00、2.00、1.00、0.50、0.20、0.10 g/L的标准系列溶液。
色谱条件:进样口温度290℃;接口温度290℃;色谱柱HP-5弹性石英毛细管色谱柱(30 m×0.25 mm ×0.25 μm);程序升温:60℃保持2 min,以6℃/min升到270℃,保持20 min;载气:高纯氦气,吹扫流速1.10 mL/min,柱前压力65.2 kPa;不分流进样。
质谱条件:离子源温度为200℃,溶剂延迟时间6 min,检测器电压为1 kV,电子轰击源(EI),电离电压70 eV,扫描模式为选择性离子方式(SIM)。
2 结果分析
2.1 PAHs降解菌群的富集筛选
通过对污染土壤中PAHs降解菌的富集培养,获得了一组可以降解PAHs的菌群,命名为KO5。通过稀释涂布法从该菌群中分离获得3株可培养单菌,分别记为KO5-1、KO5-2、KO5-3,其16SrDNA鉴定结果如表1所示。

表1 PAHs降解菌的16SrDNA鉴定结果Table 1 Phylogenetic affiliations of PAHs-degrading bacteria
这3株可培养单菌所属的红球菌属(Rhodococcussp.)、鞘氨醇单胞菌属(Sphingomonassp.)和芽孢杆菌属(Bacillussp.)是目前已经富集分离并鉴定的PAHs降解菌。Grzegorz Pasternak等[15]以PAHs为主要成分的煤焦油污染土壤中筛选获得一株Rhodococcus erythropolisB10,对多环芳烃及杂环芳烃均有较好的降解效果。另有多项报道[16-18]也证实了该菌属降解 PAHs的能力。鞘氨醇单胞菌属(Sphingomonassp.)是降解芳香族化合物的主要菌属[19],能够降解利用荧蒽、萘、菲[20]以及苯并蒽、苯并[a]芘[21]等。芽孢杆菌属(Bacillussp.)也具有降解PAHs的能力[22-23]。
分别提取混合菌群KO5与3株单菌的DNA一起进行DGGE分析,比较这些单菌在混合菌群中的位置,如图1。图1表明,混合菌群KO5由8个主要的单菌株组成,并且3株降解单菌条带均能与KO5中的条带相对应,KO5-1对应Band 3,KO5-2对应Band 2,KO5-3对应Band 6。对主要条带进行测序分析,确定了这些菌株的可能分类,结果见表2。
PCR-DGGE技术可以直观地反应微生物的群落结构[24-25],能够检测到不易分离培养的优势菌株,揭示混合菌群的结构组成。由表2可知,混合菌群KO5包含3株不可培养细菌(Band 1、Band 7、Band 8)、3株已分离获得的降解单菌,以及一株假单胞菌(Band 4)和一株苍白杆菌(Band 5)。假单胞菌属(Pseudomonassp.)是PAHs降解的重要菌属,该菌属下的很多降解菌能以四环PAHs为唯一碳源和能源生长[26],并且产生的胞外多糖能够提高PAHs的生物可利用性[27]。有关苍白杆菌属(Ochrobactrumsp.)在降解方面的报道比较少,主要集中在苯系物的降解[28-29],说明这一属可能具有使芳香环裂解的相关功能。
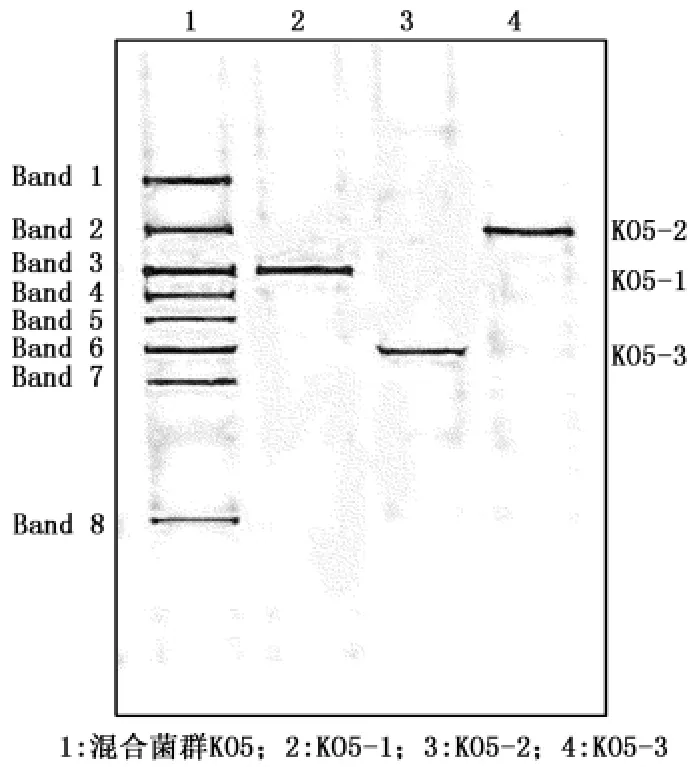
图1 混合菌群KO5与单菌株的DGGE图谱Fig.1 DGGE analysis of microbial consortium KO5 and isolates

表2PAHs降解菌群DGGE条带序列分析Table 2 Sequence analysis of PAHs-degrading microbial consortium from dominant DGGE bands
2.2 土壤中PAHs的生物降解
从新疆克拉玛依油田百口泉油区原油处理污泥池附近采集的土壤样品中检测到干土中总PAHs的质量分数为18.59×10-6(表3),回收率为87.6%。总PAHs包括16种EPA-PAHs,其中3环PAHs占34.53%(质量分数 6.42×10-6),4环 PAHs占 39.64%(质量分数 7.37×10-6),5环 PAHs占19.36%(质量分数3.6×10-6)。带有4~6个苯环的高分子量 PAHs(high molecular weight,简称HMW-PAHs)占63.31%,这些化合物具有沸点高,不易挥发,水溶性低,容易被土壤或底泥中的有机质吸附,遗传毒性高,难降解,环境中留存时间长的特点[30]。

表3 土壤样品降解前后16种EPA-PAHs的质量分数Table 3 16 EPA-PAHs mass fraction of contaminated soil before and after inoculatiion 10-6
土壤样品经过30 d生物修复其中总PAHs在不同处理下的降解效果如图2所示。由图2可知:与对照试验组相比,添加的微生物对总PAHs的降解效果明显;混合菌群KO5对总PAHs的降解率均高于单一菌株。
16种EPA-PAHs降解前后在土壤中的含量见表3(表中数据为平均值±标准方差,n=3)。对其中不同环数PAHs的降解情况作统计,结果见图3。由表3和图3可知,经过30 d的生物修复,所有添加微生物处理的土壤样品中PAHs的质量分数均低于对照土壤,而添加混合菌群KO5处理的土壤样品中PAHs的质量分数明显低于添加单一菌株处理的土样。土壤中2~3个苯环的低相对分子质量PAHs (LMW-PAHs)的含量较初始土样有所降低,而高相对分子质量PAHs(HMW-PAHs)的含量几乎不变,这是由于土壤样品未作灭菌处理,其中固有的微生物对LMW-PAHs有一定的利用。分别添加单一菌株KO5-1、KO5-2和KO5-3的处理中,2~4环PAHs的质量分数均有明显的降低,其中对3环PAHs的降解率在28.57%~56.07%,而对5环PAHs,仅KO5-2对其有大于20%(22.45% ~29.41%)的降解效果。在添加混合菌群KO5的处理中,3环PAHs的降解率(40.21%~52.02%)与单菌株的处理相近,而4环PAHs的降解效果(47.93%~71.26%)明显高于单菌株的处理(4.04%~39.76%)。混合菌群 KO5对5环 PAHs的降解率为32.73% ~58.43%,对6环PAHs茚并(1,2,3-cd)芘和苯并(ghi)苝的降解率分别为37.78%和42.86%。随着苯环数增加,混合菌群和单菌株对PAHs降解效率均逐渐降低,这是因为HMW-PAHs分子结构复杂,稳定性高,水溶性低,PAHs的沉积物-水分配系数增大,易于被土壤颗粒吸附,难于被微生物利用[31]。

图2 土壤中总PAHs的降解率Fig.2 Degradation efficiency of total PAHs in soil
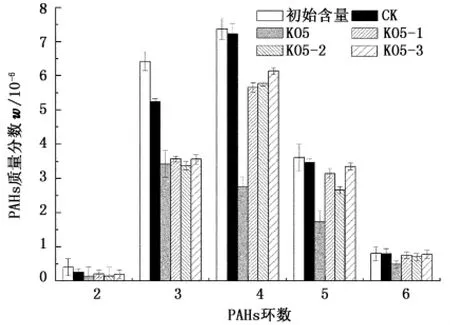
图3 土壤中不同环数PAHs降解前后的质量分数Fig.3 Mass fraction of different-ring PAHs in soil before and after degradation
微生物的降解底物谱是生物修复时选择微生物的重要因素,微生物能够利用或降解的污染物越多,在生物修复中的利用价值就越大[8]。混合菌群KO5对土壤中的LMW-PAHs和HMW-PAHs均有较好的修复效果,降解底谱比较广,具有较好的应用前景。
PAHs的生物降解有两种方式:一是微生物以LMW-PAHs作为唯一的碳源和能源,将其完全矿化;二是微生物以共代谢的方式降解HMW-PAHs,包括靠降解其他有机物提供能源,通过其他微生物协同作用,以及先经别的物质诱导产生相关酶系,才能降解相应化合物[32]。本文中筛选得到的混合菌群KO5对HMW-PAHs的降解可能是微生物降解和其中多株单菌共代谢共同作用的结果。在被污染的土壤中存在着经自然选择优化过的混合菌群,其中不同菌株的功能和作用通过长期的演化稳定下来。在混合菌群KO5中形成了一种较为稳定的细菌群落结构,一些不可分离培养的菌株(如Band l、Band 7、Band 8所代表的菌株)可能对PAHs的降解起着重要的作用,但在目前培养条件下无法通过分离得到。因此直接利用混合菌群来修复PAHs污染的土壤,避免一些未可分离培养的关键菌株的丢失,对HMW-PAHs的降解更加有效。当然,混合菌群结构复杂,如何保持它降解能力的稳定性或优化其降解条件值得进一步的研究。
PAHs污染土壤的微生物修复是一个复杂的过程,其中高效的PAHs降解菌是必不可少的。有研究[33]表明,从受PAHs污染的土壤中筛选得到的土著菌较外源菌更能有效降解其中的PAHs。表面活性剂的添加可以提高PAHs在水相中的溶解度,进而增强生物利用性,加速环境中PAHs的降解进程[34-35]。添加维持一定的C∶N∶P营养物质及某些微量营养元素对微生物的生长非常重要,通过提高微生物活性可实现PAHs降解高效化[36]。土壤的受污染时间也影响PAHs生物降解,可能是由于其影响土壤对PAHs的吸附与解吸,土壤与PAHs接触时间越长,PAHs越不容易从土壤中解吸,PAHs对微生物的毒性减小,缩短了微生物的适应期,从而缩短PAHs生物降解的停滞期,提高PAHs的矿化程度[37-38]。此外,土壤含水量、土壤pH值、土壤通气状况、环境温度、修复时间等因素都影响微生物修复效果[39-40]。
3 结论
(1)从土壤样品中检测到16种EPA-PAHs,质量分数为18.59×10-6,其中含有4~6个苯环的高分子量PAHs占63.31%,说明土壤受HMW-PAHs污染较为严重。
(2)以土壤中PAHs提取物为唯一碳源,经过长期富集培养,获得了一组PAHs降解菌群,包含3株已分离获得的降解单菌,分别为红球菌属(Rhodococcussp.)、鞘氨醇单胞菌属(Sphingomonassp.)和芽孢杆菌属(Bacillussp.),3株不可培养细菌(Uncultured bacterium clone),以及一株假单胞菌(Pseudomonassp.)和一株苍白杆菌(Ochrobactrumsp.)。
(3)经过30 d的生物修复,土壤中的PAHs得到有效降解,混合菌群对土壤中总PAHs的降解率高于单一菌株,并且混合菌群对HMW-PAHs的降解表现出了较大的优势,4环、5环、6环PAHs的降解率分别可达到71.26%、39.76%和42.86%。利用混合菌群来修复PAHs污染的土壤,避免一些未可分离培养的关键菌株的丢失,对16种EPA-PAHs复合污染土壤的修复更加有效。
[1]BAMFORTH SM,SINGLETONI.Bioremediation of polycyclic aromatic hydrocarbons:current knowledge and future directions[J].Journal Chemical Technology Biotechnology,2005,80(7):723-736.
[2]JONESK C,De VOOGT P.Persistent organic pollutant (POPs):state of science[J].Environmental Pollution,1999,100:209-221.
[3]MENZIE CA,POTOKI B B,SANTIODONATO J.Exposure to carcinogenic PAHs in the environment[J].Environmental Science and Technology,1992,16:1278-1284.
[4]YUANSY,CHANG JS,YENJH,et al.Biodegradation of phenanthrene in river sediment[J],Chemosphere,2001,43:273-278.
[5]CERNIGLIA CE.Biodegradation of polycyclic aromatic hydrocarbons[J].Current Opinion in Biotechnoloy,1993,4:331-338.
[6]POTINO,VEIGNIE E,RAFINC.Biodegradation of polycyclic aromatic hydrocarbons(PAHs)byCladosporium sphaerospermumisolated from an aged PAH contaminated soil[J].FEMSMicrobiology Ecology,2004,51: 71-78.
[7]HARITASH A K,KAUSHIK CP.Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):a review[J].Journal of Hazardous Materials,2009,169:1-15.
[8]毛健,骆永明,滕应,等.高分子量多环芳烃污染土壤的菌群修复研究[J].土壤学报,2010,47(1):163-167.
MAO Jian,LUO Yong-ming,TENG Ying,et al.Bioremediation of soil contaminated by high-melecular-weight PAHs with a microbial consortium[J].Acta Pedologica Sinica,2010,47(1):163-167.
[9]LOTFABAD SK,GRAY MR.Kinetics of biodegradation of mixtures of polycyclic aromatic hydrocarbons[J].Applied Microbiology and Biotechnology,2002,60:361-365.
[10]TAMNF,GUO CL,YAU C,et al.Biodegradation of polycyclic aromatic hydrocarbons(PAHs)by microbial consortia enriched from mangrove sediments[J].Water Science and Technology,2003,48(8):177-183.
[11]WILMSR,SASSH.Deep biosphere-related bacteria within the subsurface of tidal flat sediments[J].Environ Microbiol,2006,8(4):709-719.
[12]Method 3550B:Organic extraction and sample preparation[S].Washington:USEPA,1996:1-15.
[13]Method 3630C:Solid gel cleanup[S].Washington: USEPA,1996:1-15.
[14]Method 8310:Polynuclear aromatic hydrocarbons[S]. Washington:USEPA,1996:1-13.
[15]PASTERNAK G,RUTKOWSKI P,SLIWKA E,et al. Broad coal tar biodegradative potential ofRhodococcus erythropolisB10 strain isolated from former gasworks site[J].Water Air&Soil Pollution,2011,214:599-608.
[16]李晓斌,孙寓姣,王红旗,等.焦化厂污染土壤中多环芳烃降解菌群解析[J].化工学报,2010,61(2): 477-483.
LI Xiao-bin,SUNYu-jiao,WANG Hong-qi,et al.A-nalysis of PAHs-degrading bacteria from contaminated soil at a coking plant[J].CIESCJournal,2010,61 (2):477-483.
[17]WALTERU,BEYERM,KLEINJ,et al.Degradation of pyrene byRhodococcussp.UW1[J].Applied Microbiology and Biotechnology,1991,34:671-676.
[18]BOUCHEZ M,BLANCHET D,VANDECASTEELE JP.An interfacial uptake mechanism for the degradation of pyrene by aRhodococcusstrain[J].Microbiology,1997,143:1087-1093.
[19]BARANIECKI CA,AISLABLE J,FOGHT JM.Characterization ofSphingomonassp.Ant17,an aromatic hydrocarbon-degrading bacterium isolated from antarctic soil[J].Microbial Ecology,2002,43(1):44-54.
[20]STORY SP,PARKERSH,KLINE JD,et al.Identification of four structural genes and two putative promoters necessary for utilization of naphthalene,phenanthrene,and fluoranthene bySphingomonas paucimobilisvar.EPA505[J].Gene,2000,260(1/2):155-169.
[21]ZYLSTRA G J,KIME.Aromatic hydrocarbon degradation bySphingomona yanoikuyaeB1[J].Journal of Industrial Microbiology&Biotechnology,1997,19:408-414.
[22]AITKENMD,STINGFELLOW W T,NAGELRD,et al.Characteristics of phenanthrene-degrading bacteria isolated from soils contaminated with polycyclic aromatic hydrocarbons[J].Canadian Journal Microbiology,1998,44(8):743-752.
[23]SU D,LI P J,STAGNITTI F,et al.Biodegradation of benzo[a]pyrene in soil byMucorsp.SF06 andBacillussp.SB02 co-immobilized on vermiculite[J].Journal of Environmental Sciences,2006,18(6):1204-1209.
[24]MUYZERG.DGGE/TGGE a method for identifying genes from natural ecosystems[J].Current Opinion in Microbiology,1999,2(3):317-322.
[25]KATSIVELA E,MOORE E RB,MAROUKLI D,et al. Bacterial community dynamics during in-situ bioremediation of petroleum waste sludge in landfarming sites[J].Biodegradation,2005,16,169-180.
[26]KAZUNGA C,AITKENMD.Products from the incomplete metabolism of pyrene by polycyclic aromatic hydrocarbon-degrading bacteria[J].Applied and Environmental Microbiology,2000,66(5):1917-1922.
[27]RODRIGUESA C,WUERTZ S,BRITO A G,et al. Three-dimensional distribution of GFP-labeledPseudomonas putidaduring biofilm formation on solid PAHs assessed by confocal laser scanning microscopy[J].Water Science and Technology,2003,47(5):139-142.
[28]LECHNERU,BAUMBACH R,BECKERD,et al.Degradation of4-chloro-2-methylphenolby an activate sludge isolate and its taxonomic description[J].Biodegradation,1995,6:83-92.
[29]SONG B,PALLERONI NJ,HAGGBLOMMM.Isolation and characterization of diverse halobenzoate-degrading denitrifying baeteria from soils and sediments[J]. Applied and Environmental Microbiology,2000,66(8): 3446-3453.
[30]HUGHESJB,BECKLESD M,CHANDRA SD,et al. Utilization of bioremediation processes for the treatment of PAH-contaminated sediments[J].Journal of Industrial Microbiology and Biotechnology,1997,18:152-160.
[31]LU X Y,ZHANG T,FANG H H P.Bacteria-mediated PAH degradation in soil and sediment[J].Applied Microbiology and Biotechnology,2011,89:1357-1371.
[32]于秀艳,丁永生.多环芳烃的环境分布及其生物修复研究进展[J].大连海事大学学报,2004,30(4): 55-59.
YU Xiu-yan,DING Yong-sheng.Advances of studies on the enviromental distribution of polycycl ic aromatic hydrocarbons and its bioremediation[J].Journal of Dalian Maritime University,2004,30(4):55-59.
[33]LI X J,LI P J,LINX,et al.Biodegradation of aged polycyclic aromatic hydrocarbons(PAHs)by microbial consortia in soil and slurry phases[J].Journal of Hazardous Materials,2008,150:21-26.
[34]DOONG RA,LEI W G.Solubilization and mineralization of polycyclic aromatic hydrocarbons byPseudomonas putidain the presence of surfactant[J].Journal of Hazardous Materials,2003,B96:15-27.
[35]TIEHMA,STIEBERM,WERNERP,et al.Surfactant-enhanced mobilization and biodegradation of polycyclic aromatic hydrocarbons in manufactured gas plant soil[J].Environmental Science&Technology,1997,31(9):2570-2576.
[36]RANX,OBBARD JP.Biodegradation of polycyclic aromatic hydrocarbons in oil-contaminated beach sediments treated with nutrient amendments[J].Journal of environmental quality,2004,33:861-867.
[37]MACELOD CJA,SEMPLE K T.The adaptation of two similar soils to pyrene catabolism[J].Environmental Pollution,2002,119(3):357-364.
[38]HATZINGERP B,ALEXANDERM.Effect of aging of chemicals in soil on their biodegradability and extractability[J].Environmental Science& Technology,1995,29(2):537-545.
[39]张银萍,王芳,杨兴伦,等.土壤中高环多环芳烃微生物降解的研究进展[J].微生物学通报,2010,37 (2):280-288.
ZHANG Yin-ping,WANG Fang,YANG Xing-lun,et al.Recent advances in biodegradation of high-molecular weight PAHs in soil[J].Microbiology China,2010,37 (2):280-288.
[40]CHENJF,WONG MH,WONG Y S,et al.Multi-factors on biodegradation kinetics of polycyclic aromatic hydrocarbons(PAHs)bySphingomonassp.a bacterial strain isolated from mangrove sediment[J].Marine Pollution Bulletin,2008,57:695-702.
Bioremediation of 16 EPA-PAHs combined contaminated-soil with microbial consortium
LI Zheng,ZHAO Chao-cheng,ZHANG Yun-bo,ZHAO Dong-feng
(College of Chemistry and Chemical Engineering in China University of Petroleum,Qingdao266555,China)
For bioremediation of polycyclic aromatic hydrocarbons(PAHs)combined contaminated-soil,a microbial consortium and three strains were isolated from PAHs contaminated-soil containing sixteen USEnvironmental Protection Agency priority control PAHs.Denaturing gradient gel electrophoresis(DGGE)was used to analyze the structure of the microbial consortium,and the biodegradation effect of PAHs mixtures with the inoculation of mixed microbial consortium and single strain was studied.The results show that the consortium is mainly composed of three isolated strains and five uncultured bacterias. After 30 days bioremediation,the degradation efficiency of total PAHs by microbial consortium(54.17%)is higher than any single strain's(28.40%,31.95%,24.64%).Microbial consortium shows a great advantage in degradation of high relative molecular mass PAHs,and the degradation efficiencies of four-rings,five-rings and six-rings PAHs are 71.26%,39.76%,42.86%,respectively.Microbial consortium is capable of degrading PAHs which can avoid the loss of key strains and has a good application prospect in the bioremediation of PAHs contaminated-soil.
polycyclic aromatic hydrocarbons;contaminated-soil;microbial consortium;biodegradation
X 53;X 172
A
10.3969/j.issn.1673-5005.2012.01.032
1673-5005(2012)01-0175-07
2011-08-25
中国石油天然气集团公司科学研究与技术开发项目(2008D-4704-2)
李政(1983-),女(汉族),山东日照人,博士研究生,研究方向为石油污染土壤生物修复。
(编辑 刘为清)

