银溶胶均相成核过程的研究
胡 芳,孟 卫
(中国药科大学 物理化学教研室,南京 211198)
银溶胶均相成核过程的研究
胡 芳,孟 卫*
(中国药科大学 物理化学教研室,南京 211198)
利用紫外光谱测定了柠檬酸钠还原硝酸银制备银溶胶的成核诱导期,考察了溶液温度和过饱和度对反应诱导期的影响.结合均相成核理论,得到当溶液的过饱和浓度大于或等于4×108时体系为均相成核过程.结果表明,诱导期随着温度和过饱和浓度的上升而下降.同时计算出不同反应温度下纳米银的固-液界面张力,并与经验理论模型的数据结果加以比较,实验预测结果低于模型值.本实验通过测定银溶胶制备过程中银离子的浓度变化验证了紫外光谱测定反应诱导期的可行性.
银溶胶;均相成核;诱导期;界面张力;紫外光谱
纳米银是一种近年来新兴的功能材料,由于其在抗菌、催化、电化学、生物学等领域的独特应用,越来越受到人们的关注.纳米银的材料特性除了和纳米银制备的历史过程有关,更重要的是与纳米银的大小和形状有关.纳米银的制备主要有物理方法和化学方法.物理方法有高能机械球磨法、光照法、蒸发冷凝法等.化学制备方法有液相化学还原法、电化学还原法、光化学还原法等.最为常用的化学方法是在稳定剂存在的条件下,以合适的还原剂还原硝酸银得到纳米银粒子.还原剂包括硼氢化钠,柠檬酸钠,抗坏血酸,水合肼等,其中既环保又方便的还原剂是柠檬酸钠,在反应过程中,柠檬酸钠既是还原剂同时也是稳定剂.
根据经典的成核理论,纳米银的尺寸可以通过结晶反应的动力学过程进行控制,但目前对于柠檬酸钠还原硝酸银制备银纳米粒子的结晶过程的研究却未见报道.固体的成核过程是固-液相变过程中最为重要的现象,由于受到微观领域研究手段等因素的限制,对于成核过程的直接微观研究仍然非常困难.但是可以通过测定反应的诱导期,利用均相成核理论计算出晶体成核时的固-液界面张力及其他一些重要的成核参数[1-3],以此来对晶体生长过程中的微观机理进行研究,从而得到晶相形成时溶液和晶体一些重要信息.
1 均相成核理论
晶体的成核过程可分为两大过程:初级成核和二次成核.初级成核是过饱和溶液在无晶体存在时的自发成核过程,初级成核有相变的产生.二次成核是指体系在已有晶体存在的条件下由于晶体的表面作用而产生晶核,整个过程不涉及相变.初级成核又可以分为均相成核和非均相成核.
在初级成核过程中,溶液过饱和度的形成到新相出现之间的这段时间通常称为诱导期.由于新相的定义多种,第一个晶体出现或溶液的性质开始改变等都可以作为新相形成的依据.诱导期数据与晶体的种类有关,而且依赖于实验方法、体系特性等.虽然诱导期不是晶体最基本的物理化学性质,但是容易测得,并能体现和反映晶相形成的动力学过程.
经典的均相成核理论将成核速率表示如下[4]:

式中ΔG为体系临界成核自由能,结合Gibbs-Thomson方程可得:

其中,S=C/C*是过饱和浓度,C和C*分别为物质的实际浓度和平衡浓度(mol/L),Vm为单个分子的体积,ν为单位摩尔电解质所含的离子数,对于本实验研究体系取1.k是玻尔兹曼常数,T是反应温度.β为几何参数,对于球形粒子β=16π/3.经典均相成核理论认为,诱导期应与成核速率成反比,表示如下:

对上式取对数得到:

上式表明在不同的温度下,lntind-绘图得到一条斜率为A1的直线.

通过斜率可计算出金属银的固 -液界面张力[2].
2 实验
2.1 试剂和仪器
硝酸银、柠檬酸三钠、邻菲啰啉(Phen,5×10-4mol/L)、曙红 Y(TBF,2×10-3mol/L,)、硝基苯、醋酸钠缓冲溶液(pH=4.5)、所有试剂购自国药集团化学试剂有限公司,均为分析纯.UV-Vis紫外吸收光谱在岛津UV2100上测定;实验用水为18.2 MΩ以上的超纯水,由Millipore生产的Milli-A10超纯水仪提供.用X射线粉末衍射仪(XRD)测试产物的物相,测试仪器和条件为:德国的BrukerD8 ADVANCE型X射线衍射仪,Cu靶,Kα射线(λ= 0.15405nm,40kV/40mA,扫描范围5°~100°).
2.2 银纳米颗粒的制备过程
纳米银溶胶的制备参考Lee和Meisel的方法[5],在250mL的三颈烧瓶中加入一定量的超纯水,固定搅拌速度,加热回流至特定温度后迅速加入一定量的0.1mol/L硝酸银溶液和8mL 1%的柠檬酸三钠溶液(过量),溶液总体积为200mL,随着反应进行,体系产生银纳米颗粒,反应液呈现黄色并显现出乳光.
2.3 诱导期的测量
当一束光照在纳米粒子溶液上时,某些光被吸收(特定波长的光被吸收时溶液就会产生颜色),某些光发生散射,其余的光可以穿透溶液.在纳米粒子溶胶中,紫外分光光度计可以检测到光强度的降低量:

该式表明光量子的损失速率是与距离x处的光强度I和单位体积下纳米粒子的数量N成正比的,Cext为消光系数.对上式进行积分得到溶液的吸光度:
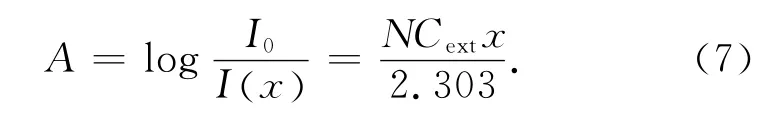
因此,当溶液达到过饱和后,通过检测不同时间下的吸光度的变化可以得到诱导期,吸光度数值开始上升对应的时间即为诱导期[6-7].为进一步验证紫外光谱测定诱导期的可靠性,实验中跟踪测量了反应过程银离子浓度的变化.银离子的测定方法包括分光光度法,荧光光谱法,银离子选择电极法以及原子吸收法等.由于纳米银表面会吸附部分银离子,本文采用的萃取法结合紫外分光光度法,纳米银留在水相,银离子被萃取到有机相,很好的实现了纳米银和银离子的分离.测定方法如下:
在50mL容量瓶内加入6.4mL(5×10-4mol/L)Phen、0.4mL(2 × 10-3mol/L)TBF、5mL HAC-NaAC缓冲液,再加入AgNO3标准溶液,定容至刻度后全部转移入分液漏斗,加入20mL硝基苯进行萃取,取下层有机相.以试剂空白为对照,在有机三元络合物Ag-Phen-TBF最大吸收波长548 nm处测定其吸光度[8],结果表明:当有机相中Ag+的浓度在2.5×10-6~1.5×10-5mol/L范围内,有机三元络合物的最大吸光度值与银离子的浓度成线性关系.线性方程为A=89920C-0.0488,R=0.99345.在银溶胶制备的过程中,每隔一段时间取样,依上法测定银络合物的吸光度,根据标准曲线计算体系中银离子浓度.本实验分别在3个温度(360.15K、363.15K、366.15K)和7个硝酸银初始浓度(2×10-4mol/L、4×10-4mol/L、8×10-4mol/L、1.2×10-3mol/L、1.6×10-3mol/L、2×10-3mol/L、2.2×10-3mol/L)下测定反应的诱导期.
3 结果与讨论
3.1 反应过程中银离子浓度的变化

图1 在360.15K、S=109下不同时间的吸光度和银浓度与时间的关系Fig.1 Abs and silver concentrarion at different times for 360.15Kand S=109
图1所示为360.15K下过饱和浓度S=109下(C=2×10-3mol/L,C*=2×10-12mol/L[7])条件下的测量结果,溶液吸光度在420nm(银溶胶的最大吸收波长)处测得.在反应的成核阶段,体系的吸光度基本不变,银离子浓度下降也极其缓慢,当初级成核结束后,吸光度快速上升,而此时银离子浓度急剧下降,两者发生突变的时间相等.由此可见通过紫外光谱来研究体系的诱导期方便可行.
3.2 温度和饱和度对诱导期的影响
表1结果表明在同一温度下,随着过饱和度S的升高,诱导期逐渐缩短,说明S越大,晶核的形成速率也越快,所以在晶体生长过程中,若S值能保持高且稳定,将有利于晶核的数目增加,从而有利于颗粒的微细化,反之,可生成较少晶核,规则粗大的晶体容易形成.在相同的过饱和浓度下,诱导期随着温度的上升而下降.反应温度越高诱导期越短,其原因是反应温度高导致粒子团簇的高扩散速率.此结果与经典的均相成核理论(公式(4))预示的结果完全一致[9].

表1 不同温度和过饱和浓度下的诱导期Tab.1 Experimental induction time data(in minute)measured at different temperatures and supersaturations
3.3 均相成核与非均相成核

图2 不同温度下lnt对1/T3(lnS)2线性拟合Fig.2 The logarithm of lnt vs 1/T3(lnS)2 at different temperatures
在均相成核条件下如公式(4)所示,lnt对1/T3(lnS)2存在线性关系,见图2.过饱和度大于4×108时,不同的温度下,lnt和1/T3(lnS)2有着很好的线性关系,其相关系数分别为0.997(360.15K)、0.993(363.15K)、0.994(366.15K);当饱和度较小为108和2×108时,数据点明显偏离直线关系.均相成核一般只能发生在过饱和浓度很高的情况下,此时成核速度快,容易克服成核势垒.但是当过饱和浓度偏低时,晶体的成核速度降低,此时成核将会借助体系中不溶杂质和诸如玻璃壁、搅拌器等物理因素来进行成核,从而发生非均相的成核过程.在lnt-1/T3(lnS)2图上将偏离均相成核的直线关系.实验结果和理论分析结果吻合较好.
3.4 界面张力的计算
固体的表面自由能是描述和决定固体表面性质的重要物理量之一,但至今却没有直接测量固体表面自由能或界面张力的可靠实验方法,为研究固体表面热力学[10],常根据成核速率和诱导期来间接测定界面张力.
不同温度下的界面张力可以通过图2中直线的斜率A1来进行推算.实验结果表明,温度为360.15K、363.15K、366.15K 时,直线斜率分别是1.504×1011、1.437×1011、1.308×1011,由公式(5)求得纳米银的界面张力分别为432.8mJ/m2、426.2mJ/m2、413.1mJ/m2.该体系k=1.3805×10-23J/K,Vm=1.70728×10-29m3.Vm是由Vm=M/(ρNA)求得的,其中 M =0.1078682kg/mol,ρ=10490kg/m3,NA=6.023×1023no./mol.
根据Bennema-Sohnel经验公式[11]γ =0.248 (0.7-lnx*)估算以上3个温度银的界面张力分别为593.3mJ/m2、598.3mJ/m2、603.3mJ/m2.其中x*是平衡浓度,用摩尔分数表示.对比可知,实验测定值低于经验公式的理论计算值.Hatami等研究了常温下硝酸银和水合肼的反应体系,测定出银在318.15K时的界面张力为361.27mJ/m2[7],Sattar Ghader测得银在318.15K的界面张力为272.1mJ/m2[6],而利用Bennema-Sohnel经验公式计算出318.15K时银的界面张力为524.25mJ/m2,模型预测的结果普遍高于实验数值,本文实验得到的结果更接近理论预测值.
实际上固体表面通常是各向异性的,固体的实际外形与周围的环境以及所经历的历史有关.Hatami制备出的银纳米粒子为面心立方结构,其(220)晶面生长占优势[7],本文制备的晶体也为面心立方结构,谱图 3 中在 2θ = 39.08°、45.33°、66.41°和78.20°处出现的峰,分别对应着晶面指数(111)、(200)、(220)和(311),(111)晶面占优势.另外理论模型并没有考虑到固体及所处的环境,尤其在溶液中,固体颗粒必然吸附溶液的溶质或溶剂分子降低自己的界面张力,导致模型计算结果较实验测定结果偏大.

图3 Ag的XRD衍射谱图Fig.3 XRD Pattern of synthesized silver nanopaticles
4 结论
利用紫外光谱测定了柠檬酸钠还原硝酸银制备银溶胶的成核诱导期,研究了溶液温度和过饱和度对反应诱导期的影响.结果表明:诱导期随着温度和过饱和浓度的上升而下降,当溶液的过饱和浓度大于4×108mol/L时体系为均相成核过程,这些结果与经典的均相成核理论相符合.同时计算了360.15K、363.15K、366.15K3个不同反应温度下银溶胶的固 -液界面张力,分别为432.8 mJ/m2、426.2mJ/m2、413.1mJ/m2,与经验理论模型计算结果进行比较,结果合理可信.本文还通过测定银溶胶制备过程中银离子浓度的变化验证了紫外光谱测定反应诱导期的可行性.
[1]Ahmi F,Gadri A.Kinetics and morphology of formed gypsum [J].Desalination,2004,166:427-434.
[2]张立川,陈启元,尹周澜.电导法研究过饱和铝酸钠溶液均相成核过程 [J].物理化学学报,2008,24(6):1111-1114.
[3]Rossiter D S,Fawell,P D,llievski D.Investigation of the unseeded nucleation of gibbsite,Al(OH)3from synthetic bayer liquors[J].J Cryst Growth,1998,191(3):525-536.
[4]Mullin J W.Crystallization(3rd ed)[M].Sydney:Butterworth-Heinemann,1993:172.
[5]Lee P C,Meisel D.Adsorption and surface-enhanced Raman of dyes on silver and gold sols[J].J Phys Chem,1982,86(17):3391-3395.
[6]Ghader S,Manteghian M,Kokabi M,et al.Induction time of reaction crystallization of silver nanoparticles[J].Chem Eng Technol,2007,30(8):1129-1133.
[7]Hatami N,Ghader S.Induction time of silver nanoparticles precipitation:experiment and modeling[J].Cryst Res Technol,2009,44(9):953-960.
[8]El-Ghamry M T,Frei R W.Spectrophotometric determination of trace amounts of silver(I)[J].Anal Chem,1968,40(13):1986-1990.
[9]汪 盛,李根培,胡文瑞,等.天花粉蛋白晶体生长的斜锥形成核机制[J].华中师范大学学报:自然科学版,2007,41(3):425-430.
[10]Jiang Q,Lu H M.Size dependent interface energy and its applications[J].Surf Sci Rep,2008,63(10):427-464.
[11]Bennema P,Söhnel O.Interfacial surface tension for crystallization and precipitation from aqueous solutions[J].J Cryst Growth,1990,102(3):547-556.
Study on homogeneous nucleation of silver colloids
HU Fang,MENG Wei
(Department of Physical Chemistry,China Pharmaceutical University,Nanjing 211198)
Induction time of silver colloids primary nucleation was determined by UV-Vis spectra,silver colloids were synthesized by a reaction of silver nitrate and sodium citrate.The effects of temperature and supersaturation(S)on induction time were considered.The results show that induction time decreases with increasing supersaturation and temperature.According to the classical theory of homogeneous nucleation,the primary nucleation of reaction was a homogeneous nucleation when S≥4×108.Interfacial tensions between solid and liquid were estimated at different temperatures and compared with an empirical correlation for calculation of interfacial tension.The estimated values of the interfacial tension are lower than the values predicted by the empirical correlation.In this paper,the concentration of silver ion in the process of nucleation was also determined by UV-Vis spectra and it validates the method for measuring induction time by monitoring the adsorption of the colloids.
silver colloids;homogeneous nucleation;induction time;interfacial tensions;UV-Vis
O648
A
1000-1190(2012)01-0071-04
2011-08-21.
中国药科大学校基金资助项目(211078).
*通讯联系人.E-mail:mengwei@cpu.edu.cn.

