电解金属锰加工工艺中乙醇循环除镁工艺初探
杨绍泽,任 博,王春侠
(重庆武陵锰业有限公司,重庆 409900)
现有电解金属锰加工工艺中,锰矿中所含的钙、镁在浸出工程中也被硫酸溶解生成硫酸钙和硫酸镁。硫酸钙溶解度很小,在过滤时大部分被除去,而溶解度很大的硫酸镁却在电解液中逐渐积累,使得电解液的粘度、密度增加,导电率下降,造成电解液中的离子扩散受到妨碍,槽电压上升,二氧化锰的电积过程不能均匀进行。另一方面,硫酸镁盐析在电极、设备和管道中析出也给操作带来很大的困难。因此在生产过程中应该经常去除在溶液中积累的硫酸镁,使其浓度不致妨碍电解过程的进行。本文试图通过硫酸镁和硫酸锰等盐在乙醇溶液中溶解度不同对其进行分离、除杂[1]。
1 试验原料及方法
1.1 主要试剂及仪器
试验用的阳极液来自重庆武陵锰业有限公司生产线。下文均简称标准阳极液。其溶液主要溶质含量见表1。

表1 重庆武陵锰业有限公司阳极液主要溶质含量
乙醇,分析纯,广西西隆化工厂。Sartofius BS110S型电子天平,北京赛多利斯天平有限公司。恒温水浴器,上海实峰仪器有限公司;震荡器,北京化工仪器设备厂;500 W干燥器,上海医用设备公司。
1.2 试验方法
溶液中镁离子的测定:采用 EDTA络合滴定法:采用(NH4)2S2O8将锰电解液中的M n2+氧化成M nO2沉淀,去除大量的 M n2+,少量的 M n2+用盐酸羟胺来掩蔽,用三乙醇胺掩蔽其它杂质,以 K-B为指示剂,用EDT A滴定,从而测出阳极液中镁含量。
取标准阳极液100 mL(主要溶质成分含量见表1),分别加入不同量的无水乙醇,然后搅拌使其快速盐析并过滤,再用蒸馏水定容100 mL后,分别测定滤液中的M g2+、M n2+、(NH4)+的浓度。利用不同浓度的乙醇溶液对硫酸镁、硫酸锰、硫酸铵的饱和溶解度不同实现硫酸镁的有效分离。
2 结果与讨论
2.1 乙醇加入量与阳极液中各组分盐析量的关系
盐析表示在其他物质的影响下从溶液中析出某一物质的现象。在本研究涉及的三元系中,乙醇的加入能够使镁盐在体系中的溶解度下降,表明乙醇对镁盐具有盐析作用。为了定量地描述乙醇对镁盐的盐析能力的强弱,我们引入了一个盐析率的概念。在这里,盐析率指的是在某一温度下盐在纯水中的溶解度减去盐在某一乙醇含量的混合溶剂中的溶解度,所得差值再除以盐在纯水中的溶解度,即为所求[2-3]。该定义用公式表达为:
盐析率=(镁盐在水中的溶解度-混合溶剂中溶解度)/(镁盐在水中的溶解度)
常温下乙醇加入量对处理后阳极液滤液中离子降幅见表2。
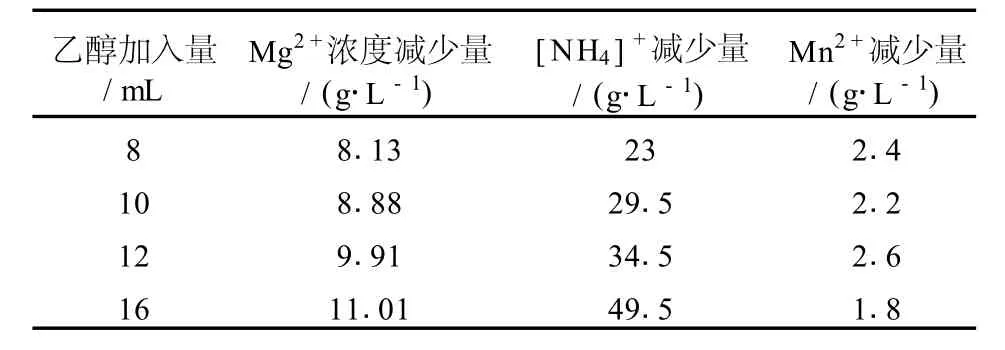
表2 常温下乙醇加入量对处理后阳极液滤液中离子降幅
表2为在常温下,在100 mL阳极液中分别加入不同量的无水乙醇,过滤后分别测定滤液中各主要组分的浓度变化量,由表可见,滤液中Mg2+浓度的减少量存在于8.13~11.01间;[NH4]+减少量存在于23~49.5间;Mn2+减少量存在于1.8~2.6间。
如图1所示,加入不同量的无水乙醇后,处理后滤液各主要组分浓度减少量随着乙醇的加入量的提高而提高。其中[NH4]+减少量最为明显;镁和锰的变化曲线较为平缓,因此,为了不使阳极液中硫酸铵损失过大,必须控制乙醇加入量在比较合适范围。
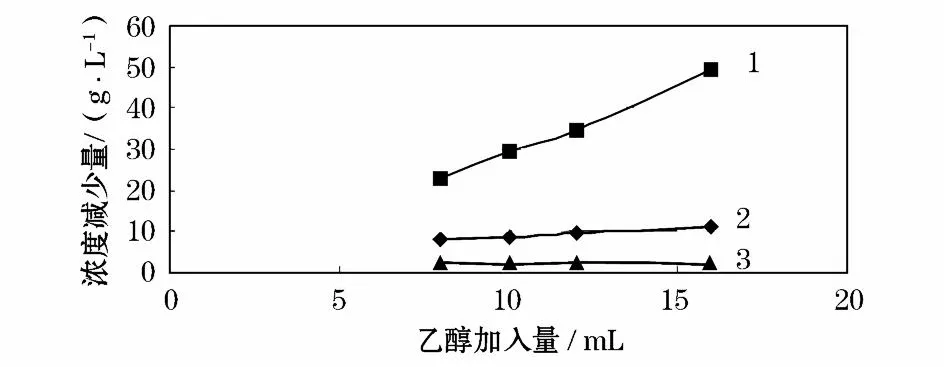
图1 35℃下乙醇加入量对处理后阳极液滤液中离子降幅的关系
从图1可见,乙醇的加入量在8 mL较为合适。
2.2 温度对硫酸镁盐析的影响
在8%的乙醇浓度下,处理后滤液中离子降幅随温度变化关系见表3。
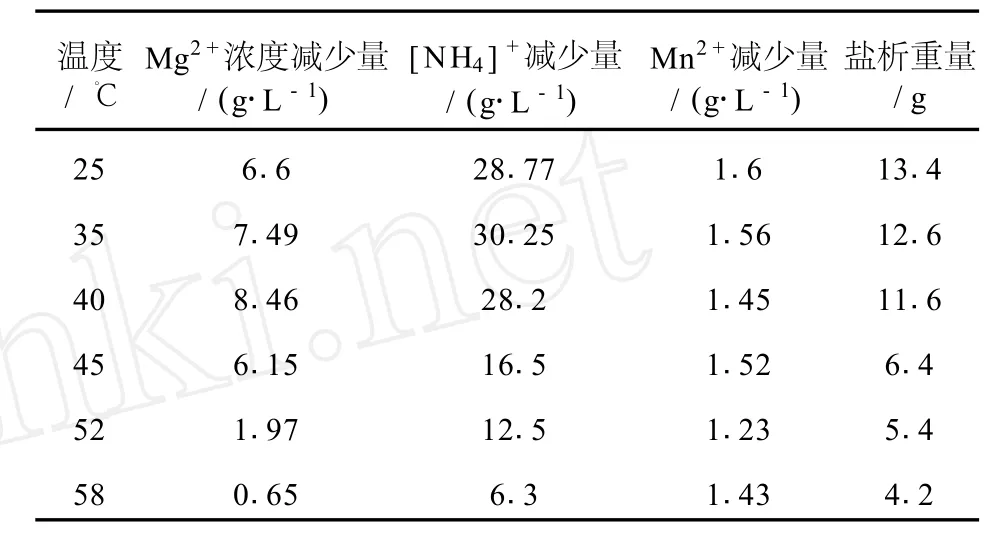
表3 在8%的乙醇浓度下,处理后滤液中离子降幅随温度变化关系
如表3所示,在100 mL阳极液中分别加入无水乙醇溶液,使得阳极液中乙醇百分含量为8%时,分别在不同温度下搅拌盐析沉淀,再对过滤后的滤液中的各组分浓度变化量进行测定,由表可见,盐析量随着温度从25~58℃的升高而降低,Mg2+浓度减少量在0.65~6.6之间变化;[NH4]+减少量在6.3~30.25之间变化;M n2+减少量在1.23~1.6之间变化。
在8%的乙醇浓度下,处理后滤液中离子降幅随温度变化曲线见图2。
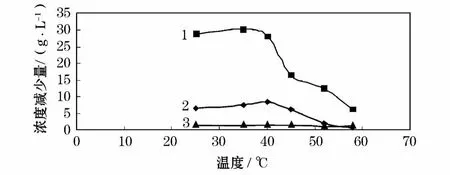
图2 在8%的乙醇浓度下,处理后滤液中离子降幅随温度变化曲线
由图2可见,在滤液中硫酸镁浓度减少量则呈现先上升后下降到接近0值的过程;硫酸铵减少量曲线随着温度呈现下降的趋势;硫酸锰的减少量曲线呈现平缓直线状,可见硫酸锰的盐析受温度影响并不明显。可以看出,在温度分别为35,40,45℃时硫酸镁的浓度下降幅度较大,考虑到在35,40℃时硫酸铵的浓度下降明显,因此,温度在45℃时,盐析效果较为理想。
2.3 乙醇蒸馏循环处理阳极液试验
乙醇循环蒸馏装置见图3。

图3 乙醇循环蒸馏装置
如图3所示,取8 m L无水乙醇加入100 m L阳极液样品中,搅拌盐析沉淀后,过滤沉淀并将滤液放在铁架台上蒸馏,当液体沸腾时,控制铁架台水浴温度致液滴每分钟1~2滴为宜。控制被处理阳极液水浴温度在45℃。蒸馏15 min后,将被处理阳极液样品搅拌盐析沉淀后,过滤沉淀并将滤液导入铁架台烧瓶中蒸馏处理第2个被处理样品。
乙醇循环蒸馏法处理阳极液样品各主要成分浓度变化见表4。
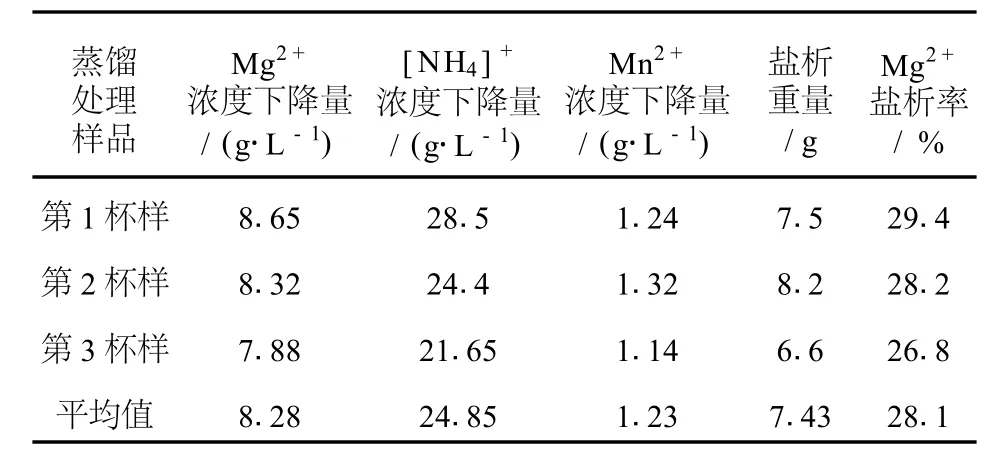
表4 乙醇循环蒸馏法处理阳极液样品各主要成分浓度变化
如表4所示,乙醇循环蒸馏法处理阳极液样品的M g2+浓度下降量平均值为8.28 g/L,[NH4]+浓度下降平均值为24.85 g/L,M n2+浓度下降平均值为1.23 g/L,平均盐析重量为7.43 g。处理后滤液均密封置于20℃水浴中24 h,滤液均未有再盐析现象。
2.4 电解对比试验
将使用乙醇循环蒸馏法处理过的阳极液制成新电解液,用新电解液和未进行除镁电解液进行对比电解试验。新电解液和原电解液成分含量见表5所示。

表5 原电解液与乙醇循环蒸馏法处理后阳极液制得新电解液成份对照 g/L
电解试验主要指标对照见表6。
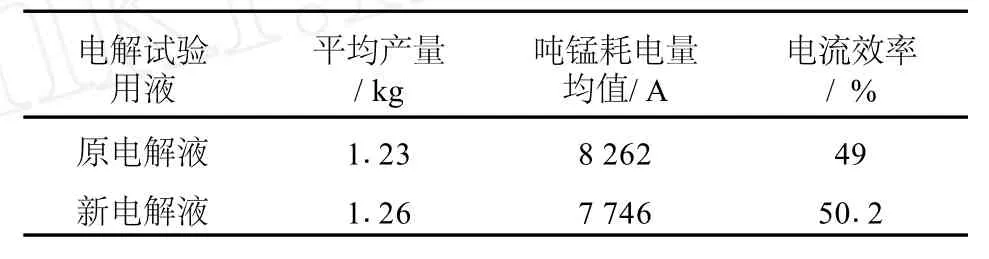
表6 电解试验主要指标对照
如表6所示,使用新电解液电解的平均产量、电流效率均有所提高,吨锰耗电量降低。
电解试验用液质量对比见表7。
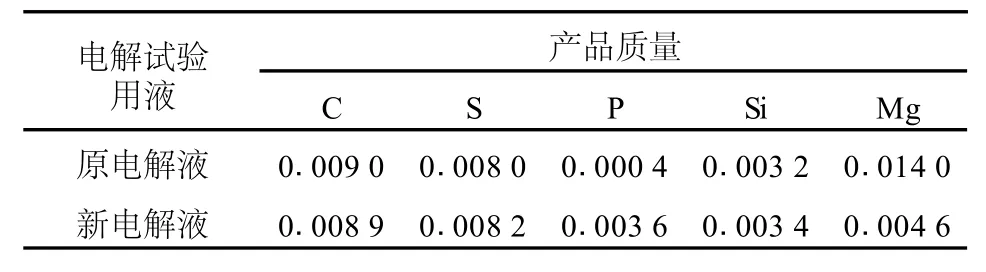
表7 产品质量对比 %
如表7所示,使用新电解液电解的产品,产品含镁量从0.014下降到0.004 6,其他元素含量变化不大,产品质量有所提高。
3 结论
1)阳极液溶液中硫酸镁、硫酸铵随着溶液中的乙醇浓度的提高而饱和溶解度降低,从而影响硫酸镁和硫酸铵盐析度。
2)在一定浓度的乙醇浓度下,阳极液溶液中硫酸镁、硫酸铵随着溶液温度的变化呈现不同的变化趋势,可以据此来实现硫酸铵浓度降幅相对较小的情况下,硫酸镁最大程度上盐析,硫酸镁平均盐析去除率可以达到28.1%。
3)电解溶液中硫酸镁的减少对改善电解槽内电解环境,提高电解效率和电解金属锰产品质量都有着比较理想的效果。
[1]谭柱中,梅光贵,李维健,等.锰冶金学[M].长沙:中南大学出版社,2004.
[2]丁楷如,余逊贤.锰矿加工与技术[M].长沙:湖南科学技术出版社,1991.
[3]孙大贵,刘兵,刘作化.冶金分析[J].冶金分析,2008,28(11):282-231.

