耐力训练诱导AMPKα2对鼠骨骼肌pp38和P-MEF2的影响
贺 强,张 缨
耐力训练诱导AMPKα2对鼠骨骼肌pp38和P-MEF2的影响
贺 强,张 缨
目的:研究耐力性跑台运动对AMPKα2 3种不同基因型鼠骨骼肌p38、pp38和PMEF2A蛋白表达的影响,以探讨运动激活MEF2的具体机制。方法:AMPKα2 3种不同基因型鼠各20只,分别分成安静对照组和耐力训练组,每组10只。安静组小鼠不施加任何运动负荷,耐力训练组小鼠进行速度为12m/min,每天1h,每周6天,持续4周的跑台运动。Western blot法测定骨骼肌p38、pp38和核内P-MEF2A蛋白表达。结果:1)4周耐力训练后,AMPKα2 3种基因型鼠pp38蛋白表达均显著提高,并且AMPKα2转基因鼠与野生鼠相比,p38和pp38蛋白表达明显增加,而AMPKα2敲除鼠pp38表达虽然低于野生鼠,但没有显著性差异;2)耐力训练组与安静组相比,AMPKα2 3种基因型鼠骨骼肌核内P-MEF2A蛋白表达均显著增加,并且AMPKα2转基因鼠与野生鼠相比,核内P-MEF2A表达显著增加,而AMPKα2敲除鼠P-MEF2A与野生鼠相比没有显著性差异;3)42只小鼠骨骼肌内pp38与核内P-MEF2A表达量呈显著正相关(R=0.69,P<0.05)。结论:4周耐力训练对AMPKα2 3种不同基因型鼠骨骼肌内p38蛋白表达影响不大,但可以显著促进p38和MEF2A的激活。AMPKα2可能不是惟一激活p38和MEF2A的途径,耐力训练可能通过pp38激活MEF2A。
腺苷酸活化蛋白激酶α2;丝裂原活化蛋白激酶p38;肌细胞增强因子2A;耐力训练;鼠;动物实验
糖代谢是物质代谢的基础,骨骼肌是体内最主要摄取葡萄糖和代谢葡萄糖的组织之一。葡萄糖运载体4(glucose transporter 4,GLUT4)介导的葡萄糖跨膜转运是骨骼肌糖代谢的主要限速步骤。研究显示,GLUT4的表达从根本上决定了其转运葡萄糖的能力,其表达失常是胰岛素抵抗的重要因素[10]。研究表明,肌细胞增强因子2(myocyte enhancer factor 2)是GLUT4转录过程的必需因子,其中,MEF2A是此过程中发挥生理作用的主要亚型。另外,已有研究报道,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)亚家族成员-p38MAPK在其磷酸化pp38形式下,可通过与MEF2结合促进MEF2磷酸化,从而增强MEF2转录活性[20,35]。
本实验室前期的工作已表明,以AMPKα2 3种基因型小鼠为研究对象,4周耐力运动诱导AMPKα2促进骨骼肌MEF2对GLUT4的转录活性以及GLUT4mRNA和蛋白表达[15],然而,AMPK调节MEF2的具体机制尚不明了。因此,本文试图仍以AMPKα2 3种基因型小鼠为研究对象,研究4周耐力性跑台运动对小鼠骨骼肌p38、pp38和核内P-MEF2A表达的影响以及pp38和P-MEF2A的关系,以进一步探讨耐力运动诱导AMPKα2提高MEF2对GLUT4转录活性的机制。
1 材料和方法
1.1 实验对象及分组
健康2月龄的C57BL/6J野生(Wild-type,WT)小鼠、AMPKα2转基因(Over-expressing,OE)小鼠和AMPKα2基因敲除(Knockout,KO)小鼠各20只,体重18±2g。其中,AMPKα2转基因小鼠由中国医学科学院实验动物研究所建立、繁殖提供。AMPKα2基因敲除小鼠由Department of Endocrinology,Metabolism and Cancer Institute,Cochin University,Paris Descartes,France提供2只,由中国医学科学院实验动物研究所代为保种繁殖。北京体育大学动物饲养房温度20℃~25℃,相对湿度50%~70%,每天光照12h,国家标准啮齿类动物饲料饲养,自由摄食和饮水。
AMPKα2 3种不同基因型小鼠经过为期1周的适应性饲养,并进行1~2次适应性跑台练习后,分别按照体重随机分为安静对照组(control,C)和耐力训练组(endurance training,T),共6组,每组10只(表1)。

表1 本研究实验分组一览表Table 1 Experiment Groups
1.2 运动方案设计和取材
安静对照组不施加任何运动负荷,安静状态下笼养。耐力训练组小鼠运动方式采取0坡度跑台运动,跑台速度为12m/min(约75%˙VO2max强度),运动动物模型参照Fernado方案[11],每天训练1h,每周6天,共持续4周。
训练组小鼠最后一次训练后禁食,12h后采取颈椎脱臼法处死小鼠,取双侧股四头肌,冰水中除去可见血液、脂肪、筋膜,用锡纸包裹并标记,迅速置于液氮中,随后转入-80℃超低温冰箱保存备用。
1.3 试剂及仪器
超低温冰箱(Thermo),HANNA酸度计,低温高速离心机,生物电泳图像分析软件(FR-980Smart View复日科技),电动匀浆器,电泳仪(DYY-11型,北京六一仪器厂),摇床(TS-1ORBITAL SHAKER),Sartorius精密电子天平。
蛋白酶抑制剂Cocktail试剂盒(SIGMA),X光片(Kodak),发光液(ECL Western Blotting Substrate,Pierce),PageRulerTMPrestained Protein Ladder(Fermentas),一抗[Phospho-p38MAPK(Thr180/Tyr 182),Mouse mAb,Cell Signaling Technology;p38α/β(H-147),rabbit polyclonal IgG,Santa Cruz Biotechnology;Phospho-MEF2A(Thr312),rabbit polyclonal IgG,Abcam];二抗(Goat Anti-rabbit IgG,HRP-linked Antibody,Cell Signaling Technology;Goat Anti-mouse IgG,HRP-linked Antibody,军事医学科学院)和内参(β-actin,rabbit polyclonal IgG,Santa Cruz Biotechnology)。
1.4 指标测试方法
1.4.1 总蛋白的提取
总蛋白提取方法为:将约40mg股四头肌样品置于400μl蛋白裂解液中(50mM Tris-Cl pH7.4~8.0,150 mM NaCl,5mM EDTA,1%Tritor x-100,4μl 100×蛋白酶抑制剂混合物),在4℃下用电动匀浆机充分匀浆,在低温高速离心机(4℃)内14 000rpm离心50min,取上清液至-80℃超低温冰箱保存备用。
1.4.2 核蛋白提取
P-MEF2A采用Pierce核蛋白提取试剂盒,取约40mg股四头肌置于400μl CER1(CRE:蛋白酶抑制剂=100∶1)溶液中,在4℃下用电动匀浆机充分匀浆,振荡器高速震荡5s,静置约10min,加入22μlCER2溶液,振荡器最高速震荡5s,冰上静置10min,低温高速离心机16 000rpm离心约10min,弃上清液,向沉淀物中加入200μl NER溶液,冰上静置10min,震荡混匀,重复3~4次,最后低温离心机16 000rpm 10min,取上清液即核蛋白,于-80℃冰箱保存备用。
1.4.3 Western Blot
蛋白浓度的测定,采用Pierce公司生产的BCA蛋白定量试剂盒,试剂配制如表2所示。待测样品稀释5倍(2.5μl蛋白样品+22.5μl PBS溶液),BCA工作液为BCA试剂A和BCA试剂B按照50∶1的比例配制而成的蓝色溶液。待测样品孔为200μlBSA工作液+25μl稀释过的待测样品,标准孔为200μlBSA工作液+25μl不同浓度梯度的牛血清蛋白反应试剂。样品OD值由酶标仪 ,并由联机软件绘制成标准曲线[2](图1)。
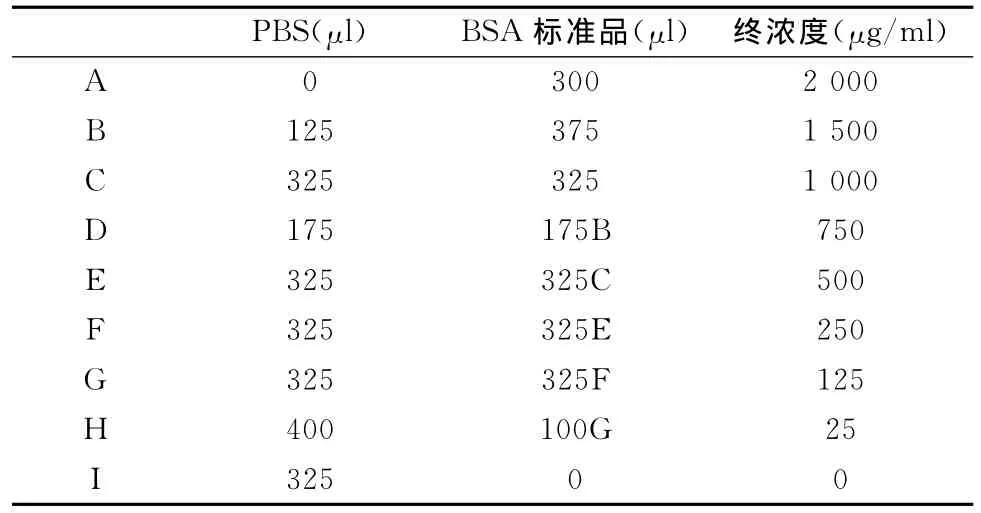
表2 本研究蛋白浓度测定试剂配制一览表Table 2 Preparation of Diluted Albumin(BSA)Standards

图1 蛋白浓度测定标准曲线图Figure 1. Standard Curve forDetermining the Protein Concentration
得出蛋白浓度后,会根据蛋白浓度计算蛋白上样量,并制备上样用的蛋白(变性)。分别采用12%(p38、pp38)和10%(P-MEF2A)聚丙烯酰胺凝胶电泳分离出目的蛋白和内参蛋白(β-actin),再转至0.45μm硝酸纤维素膜上,5%的脱脂奶粉封闭液中室温下置于摇床上封闭1h,一抗4℃过夜(p38:1∶1 000,TBST稀释;β-actin:1∶1 000, TBST稀释;pp38:1∶1 000,TBST稀释;β-actin:1∶1 000,TBST稀释;P-MEF2A:1∶1 500,TBST稀释;β-actin:1∶1 000,TBST稀释)。次日,1×TBST洗剂3次,每次10 min,最后1×TBS洗剂1次,8min。二抗孵育(p38:1∶10 000,TBST稀释;β-actin:1∶4 000,TBST稀释;pp38:1∶2 000,5%脱脂牛奶稀释;β-actin:1∶2 000,TBST稀释;P-MEF2A:1∶2 000,5%脱脂牛奶稀释;β-actin:1∶6 000,TBST稀释),室温下置于摇床轻摇1h;1×TBST洗涤3次,最后1×TBS洗涤1次,每次10min。将NC膜置于发光液中反应约1min,X光片暗室曝光、显影、定影。用生物电泳图像分析软件对曝光所得片子进行拍照,使用Image J软件读取目的蛋白和内参蛋白蛋白条带的积分灰度值,结果用目的蛋白积分灰度值与内参积分灰度值的比值表示。
2 实验结果
2.1 骨骼肌p38蛋白表达
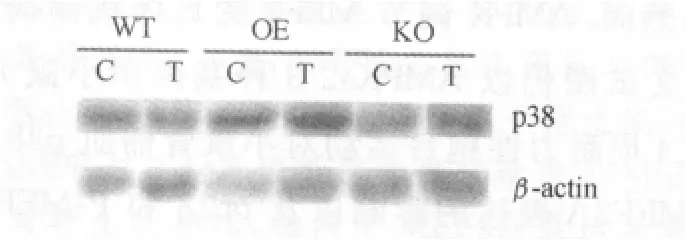
图2 AMPKα2 3种基因型小鼠骨骼肌p38MAPK蛋白表达电泳图谱Figure 2. Representative Immunoblots of p38MAPK in Various Groups
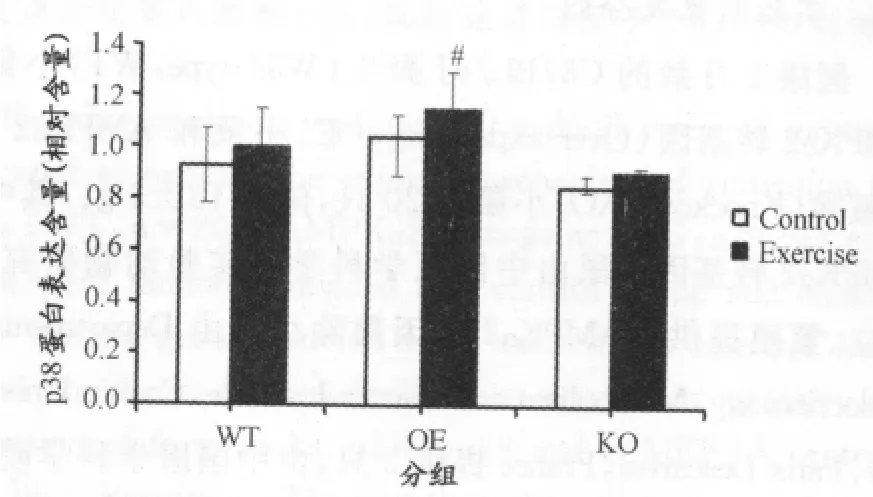
图3 AMPKα2 3种基因型小鼠骨骼肌p38蛋白表达的变化示意图Figure 3. p38MAPK Protein Expression in Various Groups
由图2、图3可以看出,在耐力训练后,小鼠骨骼肌p38表达与对照组相比没有显著性差异。AMPKα2转基因鼠与野生鼠相比,对照组p38表达无显著性差异,而耐力训练后,AMPKα2转基因鼠p38表达显著高于野生鼠。AMPKα2基因敲除鼠骨骼肌内p38表达无论安静时还是运动后始终低于野生鼠,但没有显著性差异,与AMPKα2转基因鼠相比,无论安静状态下还是耐力运动后p38表达均低于AMPKα2转基因鼠,且运动后具有显著性差异。
2.2 骨骼肌pp38蛋白表达
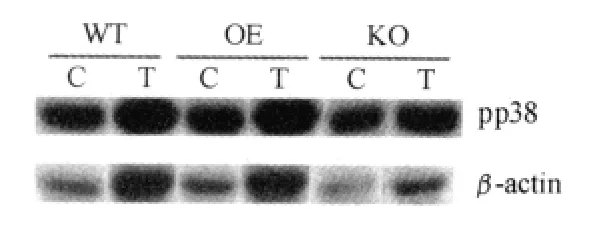
图4 AMPKα2 3种基因型小鼠骨骼肌pp38蛋白表达电泳图谱Figure 4. Representative Immunoblots of pp38MAPK in Various Groups

图5 AMPKα2 3种基因型小鼠骨骼肌pp38蛋白表达的变化示意图Figure 5. pp38Phosphorylation(P)Activity in Various Groups
由图4、图5可知,AMPKα2 3种基因型鼠在耐力训练后,与对照组相比,骨骼肌内pp38均显著上升,具有非常显著性差异。AMPKα2转基因鼠pp38表达,安静状态下与野生鼠相比没有显著性差异,但耐力训练后,AMPKα2转基因鼠pp38显著高于野生鼠。AMPKα2基因敲除鼠pp38表达始终低于野生鼠,但没有显著性差异。
2.3 骨骼肌核内P-MEF2A蛋白表达
从图6、图7可以得知,AMPKα2 3种基因型鼠4周耐力训练后,骨骼肌核内P-MEF2A与对照组相比均具有非常显著性差异(P<0.01)。AMPKα2转基因鼠与野生鼠相比,安静状态下P-MEF2A无显著性差异,但是耐力运动后,AMPKα2转基因鼠P-MEF2A增加显著高于野生鼠。AMPKα2基因敲除鼠P-MEF2A无论安静时还是运动后始终低于野生鼠,没有显著性差异。
2.4 耐力训练前、后AMPKα2 3种基因型鼠pp38与PMEF2A蛋白表达的相关性分析
由图8可知,无论是安静状态下还是4周耐力训练后,pp38和P-MEF2A在小鼠骨骼肌内表达含量变化均呈一致,呈非常显著性正相关。
3 讨论
3.1 耐力训练对AMPKα2 3种基因型小鼠骨骼肌内p38和pp38蛋白表达的影响
p38MAPK主要表达4个亚型:p38α、p38β、p38γ和p38δ,这些亚型可以通过苏氨酸-甘氨酸-酪氨酸(TGY)双位点磷酸化模块来分类。其中,p38α和p38β广泛表达于各种组织中,p38δmRNA主要发现于肺、肾脏中[18],p38γ则几乎只在骨骼肌中表达[22]。

图6 AMPKα2 3种基因型小鼠骨骼肌核内P-MEF2A蛋白表达电泳图谱Figure 6. Representative Immunoblots of P-MEF2Ain Various Groups
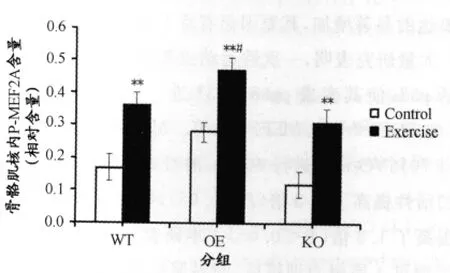
图7 AMPKα2 3种基因型小鼠骨骼肌核内P-MEF2A含量的变化示意图Figure 7. MEF2APhosphorylation(P)Activity in Various Groups
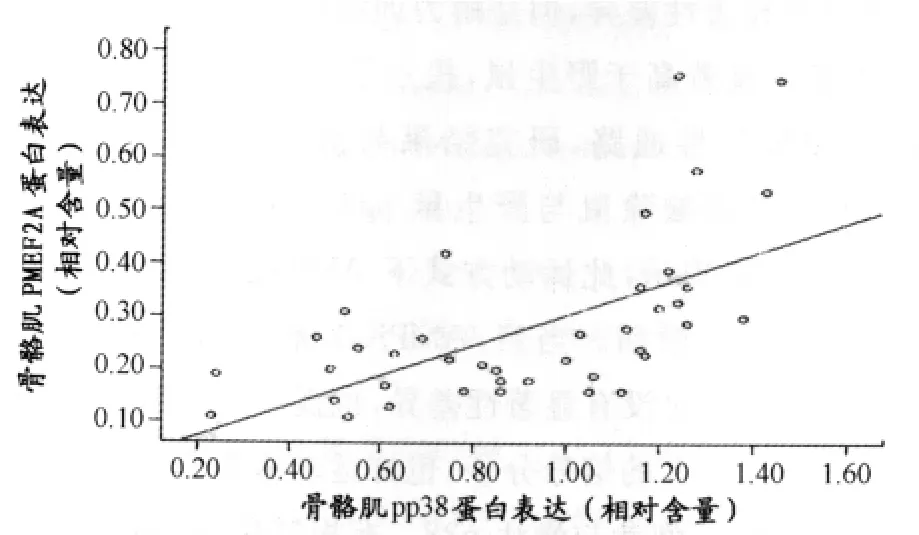
图8 耐力训练前、后AMPKα2 3种基因型小鼠骨骼肌pp38与核内P-MEF2A蛋白表达的相关性散点图(R=0.69,n=42;P<0.01)Figure 8. Correlations between pp38and P-MEF2AProtein Expression in Various Groups before and after Endurance Training
运动可以产生多种信号来刺激机体,使机体的各种信号通路产生适应性的变化,p38MAPK也不例外。1996年Goodyear等[14]首次报道,p38在跑台运动的大鼠骨骼肌中被激活,从此运动和肌肉收缩对p38蛋白表达的研究引起了广大研究者的兴趣。研究显示,受试者马拉松跑后,股外侧肌活检发现pp38显著增加了,但是p38蛋白的表达却没有改变[34]。据报道,急性运动一般不会影响p38蛋白的表达含量[32],但是,长时间耐力性运动对p38表达的影响的研究报道则是有差异的。Ginneken[31]等报道称,4周游泳训练后p38蛋白表达含量没有显著变化。曹师承等[1]报道,两组大鼠分别以1h/次/d和1.5h/次/d进行7周的游泳训练后,发现1h组大鼠骨骼肌内p38含量不变,而1.5h组大鼠骨骼肌内p38反而下调,推测可能是训练量过大造成了p38蛋白的分解。
本实验发现,AMPKα2 3种基因型鼠在4周耐力训练后,骨骼肌p38蛋白表达与对照组相比没有显著性差异;AMPKα2转基因鼠与野生鼠相比,对照组无显著性差异,但耐力训练后,AMPKα2转基因鼠骨p38表达显著高于野生鼠;AMPKα2基因敲除鼠p38蛋白表达无论安静时还是运动后始终低于野生鼠,但没有显著性差异。由此可见,仅4周运动训练+AMPKα2基因的高表达可促进p38蛋白表达的显著增加,其原因仍有待于进一步探讨。
大量研究表明,一次性运动或者耐力性运动都会显著激活p38,使其变成pp38,pp38进一步的活化其下游分子,如PGC1[28,20,4]、MEF2[35,8]等。McGee[24]等发现,受试者以70%˙VO2max进行60min的蹬自行车运动后,p38蛋白的活性提高了4.8倍(P<0.05),核内p38蛋白的活性也提高了1.8倍(P<0.05)。本研究显示,AMPKα2 3种基因型鼠4周耐力训练后,与对照组相比,pp38含量平均显著上升,具有非常显著性差异(P<0.01),分别是对照组的1.7倍、1.7倍和1.8倍,研究结果与前人结果相吻合。AMPKα2转基因鼠pp38表达,在安静状态下与野生鼠相比较没有显著性差异,但是耐力训练后AMPKα2转基因鼠pp38表达显著高于野生鼠,提示了AMPKα2参与了激活p38MAPK信号通路,研究结果与前人基本一致。虽然AMPKα2基因敲除鼠与野生鼠pp38表达没有显著性差异,但这足以提示,此运动方式下AMPKα2基因的高表达影响了p38的激活。当然,AMPKα2基因敲除鼠pp38表达与野生鼠相比没有显著性差异,也提示AMPKα2可能不是惟一激活p38的信号分子,也许运动募集其他信号通路或者AMPK亚型参与激活p38。有报道称,低到中等强度的有氧运动(<70%˙VO2max,peak)可以引起适度训练的实验对象AMPKα2特异性和强度依赖性的增多,而AMPKα1活动没有变化。这可能与AMPK复合体含有的AMPKα2对AMP有更大的依赖性,而不是AMPKα1有关[13]。Jorgensen[19]2007年的研究表明,大鼠骨骼肌在运动或者收缩后AMPKα1和α2都会激活,而在人体骨骼肌中α2亚单位对运动更敏感,但在啮齿动物体内是否α2亚单位对运动更敏感有待研究。
3.2 耐力训练对AMPKα2 3种基因型小鼠骨骼肌细胞核内P-MEF2A蛋白表达的影响
MEF2广泛存在于肌肉细胞中,是最早被称为具有肌肉特性的DNA结合活性的因子,可与大部分肌肉特定基因的启动子或增强子直接结合[27]。脊椎动物拥有4种MEF2亚型,分别是MEF2A/B/C/D[6],其中,骨骼肌主要表达MEF2A/C/D[12]。目前发现,MEF2最突出的功能是控制肌肉的生成与分化,介导骨骼肌、心肌和平滑肌发育过程中肌细胞的分化[6,21,7],MEF2在神经系统的发育和分化中也发挥重要生理作用[23,25,26];研究还发现,MEF2是肝星状细胞(hepatic stellate cell,HSC)活化的转录调节因子[3]。此外,还有研究表明,MEF2可能参与了T细胞增殖、分化[5]、骨的发育[33]等。
研究证实,MEF2是GLUT4蛋白转录过程的必需因子,它可以和相关的转录因子结合共同调节GLUT4基因的转录[17]。MEF2A主要以MEF2A/D二聚体的形式存在[21],这对于GLUT4的表达是必需的[30]。很多转录因子的转录活动都是由其磷酸化来调节的[6],MEF2被激活后可以显著地提高其转录活性,从而提高GLUT4的表达。研究已经表明,在体的肌肉收缩能够激活骨骼肌中的MEF2,P-MEF2能够显著提高MEF2介导的转录[35],提高MEF2与靶基因结合的能力,从而可以在转录水平上调节GLUT4基因的表达,使得机体转运葡萄糖的能力增加。有实验发现,电刺激肌肉收缩MEF2A含量增加[9],但增加的具体原因尚不清楚。McGee等让受试者进行蹬自行车运动,采用特定的识别MEF2磷酸化位点的抗体发现运动后MEF2苏氨酸-脯氨酸磷酸化水平提高了2.7倍(P<0.05)[24],同时发现MEF2的DNA结合活性提高了1.6倍。Yu等在2001年对11名经过马拉松测试的健康成年男子采用电泳迁移率变动分析法(electrophoretic mobility shift assay,EMSA)分析发现,MEF2的DNA结合活性明显增加,约为运动前的1.7倍[9]。
本研究显示,AMPKα2 3种不同基因型鼠4周耐力训练后,骨骼肌细胞核P-MEF2A含量与对照组相比均具有非常显著性差异(P<0.01)。AMPKα2转基因鼠与野生鼠相比,耐力训练后P-MEF2A含量显著增加(P<0.05)。AMPKα2基因敲除鼠与野生鼠相比,P-MEF2A含量在安静状态下和耐力训练后均无显著性差异。这一结果提示,在此运动方式下,AMPKα2的高表达促进了MEF2A的激活,增加了P-MEF2A的表达,并可能存在其他并行信号通路或者其他AMPK亚型激活了MEF2A,从而可代偿AMPKα2基因缺失的影响。
3.3 耐力训练前、后AMPKα2 3种基因型小鼠骨骼肌pp38与核内P-MEF2A蛋白表达的相关性分析
关于MEF2激活的机制,目前研究多有分歧。MEF2与钙依赖性信号通路密切相关,运动时细胞内的Ca2+浓度提高,可以通过p38、活化T细胞核因子(nuclear factor of activated T cells,NFAT)或者蛋白激酶C(protein kinase C,PKC)等通路增强MEF2的转录活性[6,29,3]。前人研究报道称,p38在运动后被激活,pp38可以与MEF2结合直接活化MEF2,从而提高P-MEF2的表达,进而提高GLUT4 mRNA表达[24]。其中令人遗憾的是,由于样本量的限制,本研究没有进一步的测定pp38-MEF2的结合,从而确定pp38对MEF2的作用。但本实验将安静状态和4周耐力训练后pp38和P-MEF2A进行相关性分析后发现,pp38和P-MEF2A呈密切正相关R=0.69,P<0.01。这就提示,MEF2A的激活与pp38密不可分。
4 结论
1.4周耐力训练与安静对照相比,AMPKα2 3种基因型鼠骨骼肌pp38蛋白表达均显著提高,并且,AMPKα2转基因小鼠与野生鼠相比,骨骼肌p38和pp38蛋白表达也明显增加。AMPKα2基因敲除小鼠pp38蛋白表达虽然低于野生鼠,但没有显著性差异。提示,可能存在着“运动-AMPKα2-p38激活”通路,但AMPKα2可能不是激活p38的惟一信号分子,运动可募集AMPKα2外其他信号通路激活p38。
2.4周耐力训练与安静对照相比,AMPKα2 3种基因型鼠骨骼肌核内P-MEF2A蛋白表达均显著增加,并且,AMPKα2转基因鼠与野生鼠相比,骨骼肌核内P-MEF2A蛋白表达显著增加,而AMPKα2基因敲除鼠P-MEF2A与野生鼠相比没有显著性差异。提示,可能存在着“运动-AMPKα2-MEF2A激活”通路,但AMPKα2可能不是激活MEF2A的惟一信号分子。
3.4周耐力训练前、后,AMPKα2 3种基因型鼠骨骼肌pp38与P-MEF2A蛋白表达量显著相关,表明4周耐力训练可能通过pp38激活MEF2A。
[1]曹师承,孙黎光,叶丽平.运动对大鼠骨骼肌p38活性的影响[J].中国医科大学学报,2007,36(2):131-132.
[2]龚豪杰,谢谨,张楠,等.不同强度运动对AMPKα2 3种不同基因状态鼠MEF2/GLUT4DNA结合活性的影响[J].体育科学,2011,31(2):55-62.
[3]张文炜,徐列明.转录因子MEF2对多种信号通路的调节及其生物学作用[J].中国生物化学与分子生物学报,2004,20(4):423-427.
[4]AKIMOTO T,POHNERT S C,LI P,et al.Exercise stimulates Pgc-1alpha transcription in skeletal muscle through activation of the p38MAPK pathway[J].J Biol Chem,2005,280(20):19587-19593.
[5]ARNOLD M A,KIM Y,CZUBRYT M P,et al.MEF2Ctranscription factor controls chondrocyte hypertrophy and bone development[J].Dev Cell,2007,12(3):377-389.
[6]BLACK B L,OLSON E N.Transcription control of muscle development by myocyte enhancer factor 2(MEF2)proteins[J].Annu Rev Cell Dev Biol,1998,14:167-196.
[7]BOUR B A,O’BRIEN M A,LOCKWOOD W L,et al.Drosophi-la MEF2,a transcription factor that is essential for myogenesis[J].Genes Dev,1995,9(6):730-741.
[8]CAO W,DANIEL K W,ROBIDOUX J,et al.p38mitogen-activated protein kinase is the central regulator of cyclic AMP-dependent transcription of the brown fat uncoupling protein 1gene[J].Mol Cell Biol,2004,24(7):3057-3067.
[9]CRIPPS R M,BLACK B L,ZHAO B,et al.The myogenic regulatory gene Mef2is a direct target for transcriptional activation by Twist during Drosophila myogenesis[J].Genes Dev,1998,12:422-434.
[10]DOHM G L.Invited review:Regulation of skeletal muscle GLUT-4expression by exercise[J].J Appl Physiol,2002,93(2):782-787.
[11]FERNANDO P,BONEN,HOFFMAN-GOETA L.Predicting sub-maximal oxygen consumption during tread mill running in mice[J].Can J Physiol Pharmacol,1993,71(10-11):854-857.
[12]FICKETT J W.Quantitative discrimination of MEF2sites[J].Mol Cell Biol,1996,16(1):437-441.
[13]FUJII N,HAYASHI T,HIRSHMAN M F,et al.Exercise induces isoform-specific increase in 5’-AMP-activated protein kinase activity in human skeletal muscle[J].Biochem Biophys Res Comm,2000,273:1150-1155.
[14]GOODYEAR L J,CHANG P Y,SHERWOOD D J,et al.Effects of exercise and insulin on mitogen-activated protein kinase signaling pathways in rat skeletal muscle[J].Am J Physiol,1996,271(2Pt 1):E403-408.
[15]GONG H,XIE J,ZHANG N,et al.MEF2Abinding to the Glut4promoter occurs via AMPK-dependent mechanism[J].Med Sci Sports Exe,2011,43(8):1441-1450.
[16]HAN J,JIANG Y,LI Z,et al.Activation of the transcription factor MEF2Cby the MAP kinase p38in inflammation[J].Nature,1997,38(6):296-299.
[17]HOLMES B,DOHM G L.Regulation of GLUT4gene expression during exercise[J].Med Sci Sports Exe,2004,36(7):1202-1206.
[18]JIANG Y,GRAM H,ZHAO M,et al.Characterization of the structure and function of the fourth member of p38group mitogen-activated protein kinase,p38delta[J].J Biol Chem,1997,272(48):30122-30128.
[19]JORGENSEN S B,JENSEN T E,RICHER E A.Role of AMPK in skeletal muscle gene adaptation in relation to exercise[J].Appl Physiol Nutr Metab,2007,32(5):904-911.
[20]KNUTTI D,KRESSLER D,KRALLI A.Regulation of the transcriptional co-activator PGC-1via MAPK-sensitive interaction with a repressor[J].Proc Natl Acad Sci USA,2001,98(17):9713-9718.
[21]LIN M H,NGUYEN H T,DYBALA C,et al.Myocyte-specific enhancer factor2acts cooperatively with a muscle activator region to regulate Drosophila tropomyosin gene muscle expression[J].Proc Natl Acad Sci USA,1996,93(10):4623-4628.
[22]LI Z,JIANG Y,ULEVITCH R J,et al.The primary structure of p38gamma:a new member of p38group of MAP kinase[J].Bichem Biophys Res Commun,1996,228(2):334-340.
[23]LYONS G E,MICALES B K,SCHWARZ J,et al.Expression of mef2genes in the mouse central nervous system suggests a role in neuronal maturation[J].J Neurosci,1995,15(8):5727-5738.
[24]MCGEE S L,HARGREAVES M.Exercise and myocyte enhancer factor 2regulation in human skeletal muscle[J].Diabetes,2004,53(5):1208-1214.
[25]MAO Z,BONNI A,XIA F,et al.Neuronal activity-dependent cell survival mediated by transcription factor MEF2[J].Sci,1999,286(5440):785-790.
[26]MAO Z,NADAL-GINARD B.Functional and physical interactions between mammalian achaete-scute homolog 1and myocyte enhancer factor 2A[J].J Biol Chem,1996,271(24):14371-14375.
[27]OLSON E N,PERRY M,SCHULZR R A.Regulation of muscle differentiation by the MEF2family of MADS box transcription factors[J].Dev Biol,1995,172(1):2-14.
[28]PUIGSERVER P,RHEE J,LIN J,et al.Cytokine stimulation of energy expenditure through p38map kinase activation of PPAR2gamma coactivator21[J].Mol Cell,2001,8(5):971-982.
[29]RAO A,LUO C,HOGAN P G.Transcription factors of the NFAT family:regulation and function[J].Annu Rev Immunol,1997,15:707-747.
[30]SANTALUCIA T,MORENO H,PALACIN M,et al.A novel functional cooperation between MyoD,MEF2and TRalpha1is sufficient for the induction of GLUT4gene transcription[J].J Mol Biol,2001,314:195-204.
[31]VAN GINNEKEN M M,KEIZER H A,et al.Effects of exercise on activation of the p38mitogen-activated protein kinase pathway,c-Jun NH2terminal kinase and heat shock protein 27 in equine skeletal muscle[J].Am J Vet Res,2006,67(5):837-844.
[32]WIDEGREN U,JIANG X J,KROOK A,et al.Divergent effects of exercise on metabolic and mitogenic signaling pathways in human skeletal muscle[J].FASEB J,1998,12(13):1379-1389.
[33]YOUN H D,SUN L,PRYWES R,et al.Apoptosis of T cells mediated by Ca2+-induced release of the transcription factor MEF2[J].Sci,1999,286(5440):790-793.
[34]YU M,BLOMSTRAND E,CHIBALIN A V,et al.Marathon running increases ERK1/2and p38Map kinase signaling to downstream targets in human skeletal muscle[J].J Physiol,2001,536(1):273-282.
[35]ZHAO M,NEW L,KRAVCHENKO V V,et al.Regulation of the MEF2family of transcription factors by p38[J].Mol Cell Biol,1999,19(1):21-30.
Effects of Endurance Training Inducing AMPKα2 on the Protein Expression of pp38 and P-MEF2in Skeletal Muscle of Mice
HE Qiang,ZHANG Ying
Objective:The role of AMPKα2in regulating endurance treadmill exercise induced p38,pp38and P-MEF2Awas investigated to explore the explicit mechanism of activation of MEF2by exercise.Methods:Wild-type(WT,n=20),AMPKα2transgenic(TG,n=20)and AMPKα2knockout(KO,n=20)mice were randomly divided into control group and endurance exercise group by the weight.The control group had not been exerted any exercise load while the exercise group had undertaken one-hour/day treadmill exercise with an intensity of 12m/min for 6days/week with a duration of four weeks.p38,pp38and P-MEF2Aprotein expressions were measured by Western Blot.Results:1)The overall pp38protein expression of the three types AMPKα2mice after four-week endurance training significantly increased.In addition,the p38and pp38protein expression of AMPKα2transgenic mice increased obviously compared to the wild-type mice.Although the pp38protein expression of AMPKα2knockout mice is lower than the wild-type mice,there is no significant difference at all.2)After four week endurance training,P-MEF2Acontent in the nucleus of skeletal muscle cell among the three kinds of AMPKα2mice increase significantly compared to the control group and the nucleus P-MEF2Aexpression of AMPKα2transgenic mice was significantly higher than the wild-type mice while there was no significant difference between the AMPKα2knockout mice and the wild-type mice.3)The phosphorylation activity of p38and MEF2Ain the skeletal muscle of 42mice are highly positive correlated(R=0.69,P<0.05).Conclusion:The influence on the expression of p38protein caused by endurance training for the three types’mice is not significant.However,endurance training can greatly promote the phosphorylation activity of p38and MEF2A.The data also suggests that perhaps AMPKα2is not the only pathway to activate p38as well as MEF2A.The phosphorylation activity of p38is closely related to the phosphorylation of MEF2A.
AMPKα2;p38MAPK;MEF2A;endurancetraining;rat;animalexperiment
G804.7
A
2011-08-20;
2011-09-20
国家自然科学基金资助项目(30971412);北京市自然科学基金资助项目(5102024)。
贺强(1987-),男,山东日照人,在读硕士研究生,主要研究方向为运动生物化学,E-mail:heqiang224@163.com;张缨(1961-),女,北京人,教授,博士,主要研究方向为运动和骨骼肌代谢适应,Tel:(010)62989584,E-mail:zhyi9256@126.com。
北京体育大学,北京100084
Beijing Sport University,Beijing 100084,China.
1000-677X(2011)10-0072-07
book=73,ebook=308

