用于光催化环境修复的氧化钛一维纳米结构
李 松,秦高梧,左 良
(东北大学 材料各向异性与织构教育部重点实验室沈阳 110819)
用于光催化环境修复的氧化钛一维纳米结构
李 松,秦高梧,左 良
(东北大学 材料各向异性与织构教育部重点实验室沈阳 110819)
氧化钛因具有较高的光催化活性和耐腐蚀性而广泛用于环境修复和光电转换,目前的研究表明氧化钛光催化可将环境中的许多重要污染物矿化为无机小分子,包括卤代化合物、偶氮染料、多环芳烃、农药等有机污染物.一维纳米结构,如纳米线、纳米管、纳米棒及其阵列,因具有较高的比表面积和长径比表现出优异的催化性能.本文综述了氧化钛一维纳米结构制备和光催化降解各类有机物的研究进展,介绍了有机污染物的矿化机理和氧化钛光催化活性影响因素的作用机制,指出了今后的研究方向.
氧化钛;一维纳米结构;光催化;环境修复
近年来,环境污染治理和新能源开发成为人类社会面临的两大挑战,引起了政府机构和科学界的广泛关注.在应对这两大挑战过程中发展起来的半导体多相光催化技术,利用半导体能带结构的不连续性,将溶液或空气中的有机污染物催化降解为无机分子或将水分子分解为氢和氧,从而达到环境修复和太阳能利用的目的.TiO2由于具备廉价无毒、化学稳定性好、氧化能力强等一系列优点,已成为目前研究最为广泛和充分的光催化剂.TiO2在半导体光催化的研究发端于1972年日本科学家Fujishima和Honda将TiO2电极用于光解水[1].随后,1976年,J.H.Carey等用紫外照射TiO2使多氯联苯脱氯[2],开启了半导体光催化在环境保护领域中的应用,并引起了越来越多的关注.目前基于纳米氧化钛的光催化已成为国际上最活跃的研究领域之一.
TiO2纳米粒子存在的关键问题是响应波长短,量子效率低.一维纳米结构,如纳米管、纳米线、纳米棒及其阵列,具有比表面积高、光生电荷寿命长和吸附能力强等优点,表现出优异的光电转换效率和光催化活性[3~5],因而围绕其一维结构的制备、改性、光催化活性机理以及在环境修复中的应用,众多领域的学者开展了大量的研究.
1 氧化钛一维纳米结构的制备方法
制备氧化钛一维纳米结构的方法多样,常用的方法包括水热法、原位模板法、阳极氧化等.采用水热法制备的TiO2一维纳米结构大部分是分散的粉末,虽然比表面积很高,但光催化反应后的分离和回收比较困难.原位模板法或Ti及钛合金的阳极氧化制备的 TiO2一维结构阵列在保持TiO2高比表面积的同时避免了分离困难问题,对促进TiO2光催化剂商业化具有重要意义,引起人们越来越多的关注.
1.1 水热法
T.Kasuga等[6]首先在TiO2粉体经c(NaOH) =5~10 mol/L的NaOH溶液水热处理后的产物中观察到TiO2纳米管.目前人们对这种方法生成纳米管的机理及生成的产物究竟是TiO2还是钛酸盐尚没有一致的看法[7].大多数的研究倾向于支持这种纳米管是钛酸或钛酸盐.通过高分辨电镜研究,彭练矛[8]认为纳米管在NaOH溶液中形成.成功大学H.Teng[9]则认为TiO2经NaOH水热处理后先生成具有层状结构的 Na2Ti2O5· H2O,在其后的酸洗过程中,层状钛酸盐的Na+被H+取代,并通过结构重排和层卷曲形成TiO2纳米管.由于纳米管在处于热力学不稳定状态,酸洗后继续长时间水热处理[10]或高温煅烧(>500℃)[4]可使TiO2纳米管层间距变小并收缩成纳米棒.为此,H.An等[11]用HNO3替代盐酸酸洗TiO2纳米粒子水热处理后的产物得到钛酸纳米管,并考察了结构的温度稳定性和煅烧后的降解甲基橙的光催化活性.这种水热处理过程的优势在于形貌改变的同时可以保持TiO2的掺杂状态不变,例如将掺杂Zr的TiO2粉体在360℃、10 mol·L-1的NaOH溶液中水热处理36 h可以转变成为Zr掺杂TiO2纳米管[12].
除了纳米管,水热法还可以用于制备TiO2纳米线或[13,14]纳米棒结构.一个有趣的观察是,当用于水热处理TiO2的反应釜以60 r/min的速度旋转时,生成的 TiO2纳米管变成实心的纳米线[15].研究者认为旋转反应釜中复杂的流动条件下,TiO2纳米管通过取向附着的方式自组装成束,然后在表面自由能的驱动下转变为实心的纳米线.
1.2 原位模板法
利用特定空间结构对材料生长过程的限制效应也可以制备氧化钛纳米管,文献称为原位模板法.阳极氧化铝多孔结构(AAO)是常用的生长模板,将AAO浸渍在60℃的(NH4)2TiF6溶液中,由于 Al2O3作为氟离子捕获剂消耗了 F-,TiO2·nH2O在AAO模板上原位沉积下来,同时Al2O3不断被消耗,从而将AAO的结构复制下来[16~18].通常由这种模板法制备的TiO2纳米管阵列为非晶态薄膜,须经焙烧转变为锐钛矿相.同时在去除模板的过程中,由于固液界面的表面张力较大往往容易发生结构坍塌,不利于大面积的制备.
1.3 电化学阳极氧化法
1.3.1 阳极氧化制备纳米管阵列机理
1999年,Zwilling等人[19]首先研究了Ti合金表面在阳极氧化过程中的形貌变化.2001年,Grimes等人[20]报道了在含F电解液中阳极氧化Ti制备氧化钛纳米管阵列的研究,引发了广泛的关注.尽管已有大量的研究[21,22],关于TiO2纳米管阵列在电化学阳极氧化过程中的生长机理,目前尚无定论.但由于钛阳极氧化过程中的电流随时间变化规律与Al氧化过程类似,人们用多孔氧化铝在阳极氧化过程中的生长机制来理解氧化钛孔洞结构的形成过程.一般认为在含氟酸性介质中,TiO2纳米管阵列的阳极氧化至少包括以下4个基本过程[23]:(1)Ti在电解液中O2-或OH-离子作用下形成表面氧化物阻挡层,阴离子在阻挡层中扩散到金属-氧化层界面并进一步与Ti反应;(2)如图1(a)所示,金属离子(Ti4+)在电场F作用下从金属-氧化物界面迁移到氧化物-电解液界面;(3)电场极化作用削弱了Ti-O键结合力,Ti4+进入电解液同时O2-向金属方向扩散,金属表面氧化物层发生场致溶解;(4)如图1(b)所示,氧化钛与F-发生反应生成[TiF6]2-,由于有表面内应力造成的表面凸凹不平,化学腐蚀在凹陷处进行并推动进一步的电化学氧化.
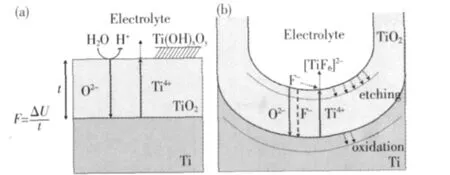
图1 Ti在(a)无F和(b)含F电解液中阳极氧化示意图[24]Fig.1 Schematic representative of the Ti anodization in
1.3.2 影响阳极氧化纳米管形貌的工艺参数
电化学腐蚀形成氧化膜和氧化物的化学溶解过程是纳米管阵列形成的两个重要因素[24].通过调节电解液成分、pH值、电流密度、温度和氧化时间等工艺参数可以改变电化学腐蚀和化学溶解的速率,从而达到控制TiO2纳米管形貌和结晶度的目的,下面分别阐述.
(1)电解液成分
研究最早、应用最为广泛的电解液当属含F电解液(NH4F、KF、NaF或HF)[19,20].在20 V和w(HF)分别为0.5%、1.0%、2.0%和3.0%的HF电解液中阳极氧化Ti形貌研究发现:HF浓度影响多孔结构向纳米管的形貌转变,适当的HF浓度可以提高纳米管的规则程度[25].
C.Grimes教授[26]研究组发现在极性有机溶剂中电化学氧化Ti可以大大提高TiO2纳米管的生长速度,其中在乙二醇(EG)中效果尤为显著,生长速度可以达到15 mm·h-1[27].研究者认为减少有机电解液中的水含量可以降低氧化层的化学溶解速度,有利于纳米管长度的增加.通过调整乙二醇溶液中NH4F和水的质量分数(0.6%的NH4F,3.5%的H2O,EG溶液),TiO2纳米管的长度可以超过2 mm[28].
由于F离子具有一定的环境毒性,人们寻求制备TiO2纳米管束的无氟体系.C.Richter等[29]首先获得了成功,他们采用含Cl体系替代含F电解液在c(NH4Cl)=0.15~0.60 mol/L和c(油酸)=0.5 mol/L电解液中成功制备出最大可达60 μm的氧化钛纳米管束.但是用这种方法制备的TiO2纳米管时,有机酸分解后的碳进入纳米管,以至最大含量(摩尔分数)达到20%.为解决这一问题,C.Grimes[30]提出在c(HCl)=0.15~0.30 mol/L的电解液中阳极氧化,结果表明只有在c(HCl)=3 mol/L的溶液、10~13 V电压下才能获得阳极氧化TiO2纳米管,增加或降低盐酸浓度均不能获得纳米管阵列,向电解液体系中添加0.01~0.1 mol/L的H3PO4能增加阳极化电压,但导致TiO2的形貌由纳米管向纳米棒转变.在此基础上,T.Devine等人[31]开发了利用 NaCl和KBr溶液作为电解液,并考察了不同添加剂如乙二醇、甘油等对Ti阳极氧化的影响,发现TiO2纳米管阵列可以在比较宽的电压范围内形成.
(2)电解液pH值影响
电解液的pH值是影响TiO2纳米管形貌的重要因素之一.增加溶液中H+浓度使TiO2化学溶解速度增加,形成的TiO2纳米管长度减小[32].万斌[33,34]等在在 HF电解液体系中添加(NH4) H2PO4后pH值由1~1.5增加到4.5~5,降低了氟离子反应引起的化学溶解速度,使制备的TiO2纳米管的长度由500 nm增加2.2 μm.
(3)电压的影响
电压是Ti阳极氧化过程中表面形貌由多孔结构向纳米管结构转变的关键因素之一[25,35].C.Grimes[35]的早期研究表明,在0.5%HF电解液中,只有当电压处于10~23 V之间时,才能得到规则排列的纳米管阵列,过高或过低的电压只能生成TiO2多孔结构.另外,由图1(a)可以看出,电压大小影响场致腐蚀的速率.当电压增加时,Ti4+和O2-离子在氧化层中扩散速率加快,生成更厚的阻挡层,并最终导致生成的纳米管长度和直径增加[23,35].
(4)结晶TiO2纳米管阵列的低温制备
通常采用原位模板法和阳极氧化法制备的TiO2纳米管阵列由非晶相和部分锐钛矿相组成.非晶态TiO2不具备光催化活性,需要通过高温晶化处理使其转变为锐钛矿或金红石相.Grimes C A等人[36]提出一个两步方案直接通过阳极氧化制备完全晶化的TiO2纳米管阵列.如图2所示,首先将Ti箔在80℃下的30%H2O2+5 mmol/L的Na2SO4+0.5 mol/L的H3PO4溶液或30%H2O2+5 mmol/L的 TaCl5+0.5 mol/L的H3PO4溶液中浸泡50~72 h将Ti表面氧化,然后在含NH4F电解质中通过恒压阳极氧化制备完全晶化的TiO2纳米管阵列[37].
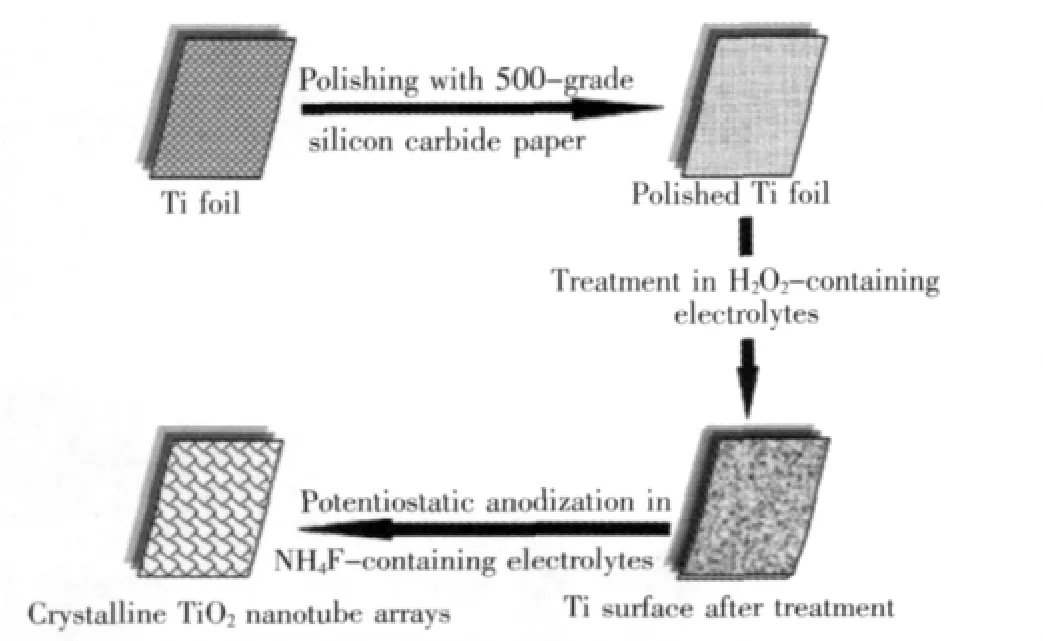
图2 两步法制备完全晶化TiO2纳米管阵列示意图[36]Fig.2 Schematic illustration of the two-step process used to fabricate crystalline TiO2nanotube arrays[36]
综上所述,TiO2纳米管阵列阳极氧化制备的影响因素比较复杂,而且相互影响.例如,降低电解液中F-浓度需要更高的电压才能生成相同形貌的纳米管阵列[20].因而在调控其形貌时需要对工艺参数认真权衡选择.
2 TiO2一维纳米结构改性用于光催化
为了拓宽TiO2一维纳米结构的光响应区间,研究者把上面介绍的几种制备技术与一些被证明有效的光催化剂改性手段相结合,改善光催化效率.报道较多的改性方式包括元素掺杂、贵金属负载、半导体复合等.
2.1 元素掺杂
TiO2是一种宽禁带半导体(Eg=3.2 eV),只能利用约占太阳辐射能量中4%的紫外光,对太阳辐射在地球表面的40%能量的可见光无法利用.尽管关于掺杂原子提高TiO2可见光吸收的机理方面还存在争议,在元素掺杂可以提高TiO2的可见光响应的实验方面已经取得了普遍的共识.通常认为TiO2经过元素掺杂后引入一些中间能级,使能量较低的光子就能将电子从这些掺杂离子能级激发到TiO2导带,使其光响应区间扩展到可见光区.
TiO2元素掺杂目前有两种策略,一种是在制备TiO2一维结构的原料中加入要掺杂离子的试剂.例如薛寒松等人[38,39]在制备TiO2溶胶的过程中加入不同浓度的硝酸镧和硝酸铈溶液,然后将AAO模板在TiO2溶胶中浸渍提拉30 min,经450~600℃热处理后获得La和Ce掺杂的TiO2纳米管.进一步的研究结果表明Ce抑制了锐钛矿向金红石的转变.La3+或Ce4+离子可能进入到TiO2晶格造成O原子逃离晶格,从而降低电子-空穴重新结合的概率,同时由于Ti4+进入La2O3或CeO2晶格导致的电荷不平衡使催化剂表面吸附更多的OH-,有利于光催化活性的提高.全燮研究组分别利用化学气相沉积[40]和电沉积[41]在阳极氧化TiO2纳米管中掺杂B原子,XPS谱上B 1 s峰位置介于TiB2和B2O3的B 1 s之间,说明B元素以Ti-B-O的混合态存在于TiO2纳米管中.另一种思路则将制备完毕后的TiO2在含有掺杂元素的溶液或气氛中后处理,目前主要应用于非金属离子掺杂.Jiang等[42]将钛酸纳米管在含有NH4Cl的溶剂中在120℃下保温一段时间,得到尺寸均匀的掺N氧化钛纳米管.刘应亮等人[43]将在氧化钛溶胶中浸渍了60 min的AAO模板在NH3气氛中退火制备N掺杂TiO2纳米管.
通常在溶液中制备的TiO2结晶度低,为获得良好的晶型常常需要热处理.通过调节热处理气氛可以方便地进行非金属元素掺杂,如N、S、C及 B等.金振声等[44]将钛酸(Na2Ti2O4(OH)2)纳米管在NH3气氛中焙烧得到N掺杂的TiO2纳米管,当焙烧温度高于400℃时,样品由正交晶系向锐钛矿相转变,700℃处理时出现新相TiN.N掺杂TiO2纳米管漫反射测量显示掺杂后TiO2响应扩展至可见光区[42~44].利用类似的方法Bard等人[45]还开发了TiO2纳米管阵列进行C掺杂的方法,即在500~800℃、CO气流中热处理.
2.2 半导体复合
除了元素掺杂,也有研究将能带结构不同的半导体与TiO2复合的手段促进光生载流子的分离,提高电子-空穴对的存活时间.典型的例子是CdS-TiO2复合体系,波长大于387 nm的光不足以激发TiO2,却可以在CdS中激发出光生载流子,产生的空穴留在CdS的价带,电子转移到TiO2的导带上.电荷的有效分离大大减小了电子-空穴的复合概率,提高了体系光催化活性.J.Kim等[46]利用气压差将钛酸四丁酯和乙醇溶液压入AAO模板通道内并在500℃、空气中煅烧,随后在浓度为2 mol/L的NaOH溶液中将Al2O3模板溶解掉得到锐钛矿纳米管阵列,最后通过双功能分子DMSA将平均直径5 nm大小的CdS纳米粒子修饰在TiO2表面.随表面修饰CdS的增加,TiO2纳米管的光催化活性增加,表明CdS上的光生电子通过DMSA分子转移到TiO2纳米管的导带上,并且没有反向电子传输.
Li等人[47]提出了一个简易的溶液方法在TiO2纳米管上修饰CdS或ZnS纳米粒子.以CdS为例,将碱液水热法制备的TiO2纳米管、S粉和等化学配比的CdCl2共同加入四氢呋喃中并超声处理30 min后加入过量KBH4,继续搅拌12 h并将生成的沉淀收集即得到CdS表面修饰的TiO2纳米管.光催化实验结果表明TiO2纳米管表面沉积CdS纳米粒子越多,光催化效率越高.
除了量子点,与其他具有合适带宽的氧化物复合也是研究的重点方向之一.将阳极氧化制备的TiO2纳米管阵列浸泡在糊精分子包覆的氧化铁纳米粒子悬浮液(1~10 g·L-1)中可获得FexOy表面修饰的TiO2纳米管阵列[49].光降解甲基橙实验表明在5 g·L-1氧化铁溶液中表面修饰的TiO2一级反应常数相比修饰前提高了30%.然而更高浓度的氧化铁会堵塞TiO2纳米管,因而不能使光催化效率进一步提高.将碱液水热法制备的TiO2纳米管在1.6 g·L-1(NH4)10W12O41· 5H2O的乙醇+水(1:3)混合溶液中搅拌1 h,生成WO3-TiO2纳米管复合半导体[50].
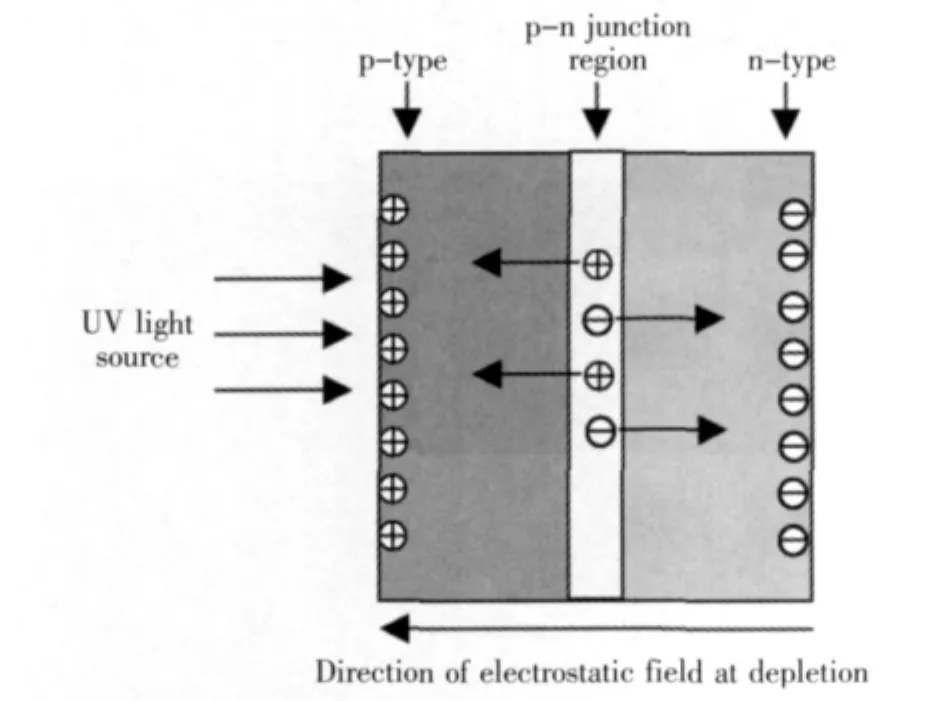
图3 基于纳米管阵列的p-n结光催化模型[48]Fig.3 Principle of the nanotube p-n junction photocatalyst[48]
减少光生载流子的复合是提高光催化剂量子效率的关键之一,J.Crittenden等人[48]通过设计基于氧化钛纳米管阵列的p-n结实现了提高载流子寿命的目的.如图3所示,p-n结形成的空间电场可以对光生电子-空穴对起到分离作用,有效减小电子-空穴的复合概率.p-n结结构可以通过AAO模板原位生成.
2.3 贵金属负载
具有光催化活性的半导体材料受到一定能量光子辐照后激发产生的电子-空穴对很容易发生复合,理论和实验证实,仅有一少部分对光催化活性起到积极的正面作用.因而如果能够提高光生电荷的寿命、降低复合的概率即可大幅提高光催化活性.通常贵金属具有较大的功函数,与TiO2接触时可以作为电子阱捕获光激发产生的导带电子,从而起到分离电荷、提高电荷对寿命的作用.常用的贵金属纳米粒子有 Au,Pt,Ag和 Ru等[51~55].值得注意的是,尽管大量文献报道了负载贵金属对提高氧化钛一维结构光催化活性的正面作用,也有科学家认为这种分离电荷的作用时间不长,常态下稳定的贵金属材料能否在光生空穴作用下保持长时间稳定性仍然值得怀疑[56].
将在PdCl2乙醇溶液中浸泡过的TiO2纳米管阵列在φ(H2)=10%的气流、500℃下热处理2 h可以获得Pd纳米粒子表面修饰的TiO2纳米管阵列[51].TiO2纳米管向Pd纳米粒子的电子转移增强了Pd的还原能力,通过考察光催化活性发现Pd的最佳负载量(质量分数)为1.25%.
全燮等[52]先在AAO模板孔内电沉积一层Pt纳米管,将AAO模板溶解后用气相法在Pt纳米管上沉积一层TiO2,从而在Al基板上得到TiO2- Pt同轴复合纳米管阵列.由于Pt的功函数比TiO2的大,光激发在TiO2纳米管上产生的电子经Pt纳米管从基板上被消耗,从而促进了电荷分离.将碱液水热法制备的 TiO2纳米管在浓度为0.025 mol/L的RuCl3溶液中搅拌10~20 h,然后在250℃热处理10 h可在 TiO2表面负载2~4 nm大小的Ru纳米粒子,从而将纳米管的禁带宽度由3.1 eV降低到2.56 eV,大大提高了对可见光的响应[53].
利用贵金属盐光照易分解的特性也可以制备负载贵金属纳米粒子.将 TiO2纳米管分散在H2PtCl6·6H6O[57]或AgNO3[58]溶液中,紫外光照可将Pt或Ag纳米粒子还原并原位沉积在TiO2表面.赵谦等[55]以纳米TiO2为原料,通过110℃、10 mol·L-1的NaOH溶液中水热合成TiO2纳米管,然后利用光还原沉积在TiO2纳米管上负载Au和Pt纳米粒子.采用相同的方法制备TiO2纳米管后,李海龙等人[59]在碱性条件下使得到的TiO2纳米管与AgNO3的乙二醇溶液反应,得到表面负载Ag纳米粒子的TiO2纳米管,结构表征结果表明,Ag纳米粒子很好地分散在纳米管外表面,且未使纳米管的晶型结构发生明显改变.
3 纳米管阵列光电性质的几何形貌特性
TiO2纳米管在光照下产生电子-空穴对,并利用表面或溶液中的活性物种将有机分子矿化,在本质上与TiO2纳米粒子的光催化过程没有不同.但由于纳米管阵列的特殊形貌结构,它与纳米颗粒或薄膜在有机分子吸附、光子的捕获与散射等方面表现出不同的特性.
首先,纳米管的一维方向性为电荷传输提供了便利的通道[32].为提高TiO2表面上的电荷转移效率,必须设法降低光生电子-空穴对的复合几率.如图4所示,由于TiO2纳米管阵列垂直地排列在导电Ti基板上,相对Sol-Gel方法制备的TiO2颗粒膜电荷传输的距离大大缩短,降低了光生电荷复合的概率,有利于光生载流子向表面吸附有机污染物分子的迁移,从而达到提高光量子效率的作用.
其次,纳米管结构提供了较高的比较面积和催化反应的活性点位数.P.Schmuki等[61]利用HF气体优先在底部聚集的特征将TiO2纳米管阻挡层去除,获得两端通透的纳米管阵列.将通透的TiO2阵列放置在有浓度梯度差的两种亚甲基蓝(MB)溶液之间,发现有较好的渗透能力.光催化实验结果表明:MB分子在流经TiO2纳米管阵列时被催化氧化,降解速率由流通速率而不是光催化反应速率决定.该实验结果证实MB光催化降解反应主要发生在TiO2纳米管壁上.T.Majima等人[62]通过全内反射荧光技术考察了单根TiO2纳米管的光催化活性,发现纳米管的表面缺陷和氧空位可能影响TiO2导带电子向溶液中O2的传递并进而影响活性基团·OH的产生.
最后,如图5所示,纳米管特殊的空心结构使得光线可以在管内部发生多次反射和吸收,也是提高光催化效率的有利因素.
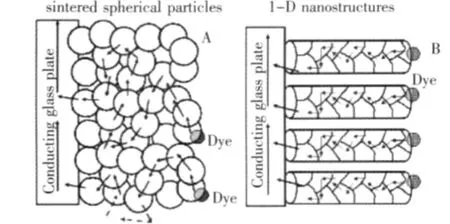
图4 不同形貌薄膜光生电子的扩散路径:(A)烧结球形纳米粒子(B)一维结构.尽管纳米粒子电极和一维结构内的电子流动都遵循随机行走模型,但一维结构内电子的行走路径为直线[60].Fig.4 Schematic of electron diffusion between(A) sintered spherical nanoparticles and(B)onedimensionalone - dimensionalnanostructures.Electron diffusion through spherical nanoparticles and 1-D structuresisaccording to random walk model[60].
4 氧化钛一维纳米结构在环境修复中的应用
氧化钛光生空穴的电势大于3 eV,与OH-结合后产生的·OH具有极强的氧化性,可以将多种有机物光催化分解从而用于环境修复治理.按照有机污染物的种类,目前TiO2一维纳米结构光催化研究中涉及的污染物模型分子主要包括染料、多环芳烃、氯代有机物和其他复杂有机物,部分典型的示例如表1所示.

表1 光催化降解有机物模型分子和对应的TiO2一维纳米结构Table 1 Organic molecules used in photocatalytic reactions and corresponding 1D nanostructures of TiO2

图5 纳米管通过多次反射提高光利用率示意图[37]Fig.5 Illustration showing that pipe geometry could capture more reflected light[37]
5 结语
氧化钛一维纳米结构具有独特的结构和优异的光催化性能,在环境污染物治理方面显示出巨大的应用潜能.随着制备和光催化活性改进技术的日益成熟,氧化钛一维结构在光催化领域中的应用将不断扩展.相信在未来几年内,在利用可见光催化氧化有机污染物用于环境治理和修复领域中会有很大突破,并对染料敏化太阳能电池、太阳能制氢等相关领域产生重大而深刻的影响.
[1]Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238:37-38.
[2]Carey J H,Lawrence J,Tosine HM.Photodechlorination of PCB’s in the presence of titanium dioxide in aqueous suspensions[J].Bull Environ Contam Toxicol,1976,16:697-701.
[3]Adachi M,Murata Y,Harada M,et al.Formation of titania nanotubes with high photo-catalytic activity[J].Chem Lett,2000,29:942-943.
[4]Tachikawa T,Tojo S,Fujitsuka M,et al.Photoinduced charge separation in titania nanotubes[J].J Phys Chem B,2006,110:14055-14059.
[5]Mor G K,ShankarK,PauloseM,etal.Enhanced photocleavage of water using titania nanotube arrays[J].Nano Lett,2005,5:191-195.
[6]Kasuga T,Hiramatsu M,Hoson A,et al.Formation of titanium oxide nanotube[J].Langmuir,1998,14:3160-3163.
[7]王晓冬,金振声,张治军.纳米管钛酸钠及其衍生物[J].化学进展,2006,18:1208-1217.
(Wang X D,Jin Z S,Zhang Z J.Nanotube sodium titanate and its derivatives[J].Prog Chem,2006,18:1208-1217.)
[8]Du G H,Chen Q,Che R C,et al.Preparation and structure analysis of titanium oxide nanotubes[J].Appl Phys Lett,2001,79:3702-3704.
[9]Tsai C -C,Teng H.Structural features of nanotubes synthesized from NaOH treatment on TiO2with different post-treatments[J].Chem Mater,2006,18:367-373.
[10]Nian J-N,Teng H.Hydrothermal synthesis of singlecrystalline anatase TiO2nanorods with nanotubes as the precursor[J].J Phys Chem B,2006,110:4193-4198.
[11]An H,Zhu B,Li J,et al.Synthesis and characterization of thermally stable nanotubular TiO2and its photocatalytic activity[J].J Phys Chem C,2008,112:18772-18775.
[12]刘国光,郭小阳,郑立庆,等.Zr-TiO2纳米管的制备及其光催化活性的初步研究[J].环境科学学报,2008,28: 710-713.
(Liu G G,Guo X Y,Zheng L Q,et al.Preparation of Zrdoped TiO2composite nanotube and investigation of their photocatalytic activity[J].Acta Scientiae Circumstantiae,2008,28:710-713.)
[13]Wang W,Lin H,Li J,et al.Formation of titania nanoarrays by hydrothermal reaction and their application in photovoltaic cells[J].J Am Ceram Soc,2008,91:628-631.
[14]Feng X,Shankar K,Varghese O K,et al.Vertically aligned single crystalTiO2nanowire arraysgrown directly on transparent conducting oxide coated glass:synthesis details and applications[J].Nano Lett,2008,8:3781-3786.
[15]Horvath E,Kukovecz A,Konya Z,et al.Hydrothermal conversion of self-assembled titanate nanotubes into nanowires in a revolving autoclave[J].Chem Mater,2007,19:927-931.
[16]崔云涛,王金淑,李洪义,等.原位合成TiO2纳米管阵列及其光催化性能研究[J].无机材料学报,2008,23:1259-1262.
(Cui Y T,Wang J S,Li H Y,et al.Study on synthesis in situ and photocatalytic activity of TiO2nanotubes array films[J].J Inorganic Mater,2008,23:1259-1262.)
[17]蒋武锋,凌云汉,白新德,等.原位模板法在铝基板上制备TiO2纳米管阵列薄膜[J].稀有金属材料与工程,2007,36:1178-1180.
(Jiang W F,Ling Y H,Bai X D,et al.In-situ template synthesis of TiO2nanotube array films on Al substrates[J].Rare Metal Mater Engin,2007,36:1178-1180.)
[18]Li G,Liu Z,Zhang Z,et al.Preparation of titania nanotube arrays by the hydrothermal method[J].Chinese Journal of Catalysis,2009,30:37-42.
[19]Zwilling V,Darque-Ceretti E,Boutry-Forveille A,et al.Structure and physicochemistry of anodic oxide films on titanium and TA6V alloy[J].Surf Interface Anal,1999,27: 629-637.
[20]Gong D,Grimes C,Varghese O,et al.Titanium oxide nanotube arrays prepared by anodic oxidation[J].J Mater Res,2001,16:3331-3334.
[21]张毓芳,张正国,方晓明.TiO2一维纳米材料及其纳米结构的合成[J].化学进展,2007,19:494-501.
(Zhang Y F,Zhang Z Z,Fang X M.Synthesis of onedimensional TiO2nanomaterials and their nanostructures[J].Prog Chem,2007,19:494-501)
[22]Guan D,Fang H,Lu H,et al.Preparation and doping of anodic TiO2nanotube array[J].Prog Chem,2008,20:1868-1879.
[23]Mor G K,Varghese O K,Paulose M,et al.A review on highly ordered,vertically oriented TiO2nanotube arrays: Fabrication,material properties,and solar energy applications[J].Sol Energy Mater Sol Cells,2006,90:2011-2075.
[24]Macak J M,Tsuchiya H,Ghicov A,et al.TiO2nanotubes: Self-organized electrochemical formation,properties and applications[J].Current Opinion in Solid State and Materials Science,2007,11:3-18.
[25]Oh H-J,Lee J-H,Kim Y-J,et al.Synthesis of effective titania nanotubes for wastewater purification[J].Appl Catal B,2008,84:142-147.
[26]Paulose M,Shankar K,Yoriya S,et al.Anodic growth of highly ordered TiO2nanotube arrays to μm in length[J].J Phys Chem B,2006,110:16179-16184.
[27]Prakasam H E,Shankar K,Paulose M,et al.A new benchmark for TiO2nanotube array growth by anodization[J].J Phys Chem C,2007,111:7235-7241.
[28]Paulose M,Prakasam H E,Varghese O K,et al.TiO2nanotube arrays of 1000 μm length by anodization of titanium foil:phenol red diffusion[J].J Phys Chem C,2007,111: 14992-14997.
[29]Richter C,Wu Z,Panaitescu E,et al.Ultra-high-aspectratio titania nanotubes[J].Adv Mater,2007,19:946-948.
[30]Allam N K,Grimes C A.Formation of vertically oriented TiO2nanotube arrays using a fluoride free HCl aqueous electrolyte[J].J Phys Chem C,2007,111:13028-13032.
[31]Nguyen Q A,Bhargava Y V,Devine T M.Titania nanotube formation in chloride and bromide containing electrolytes[J].Electrochem Commun,2008,10:471-475.
[32]Liu Z,Zhang X,Nishimoto S,et al.Highly ordered TiO2nanotube arrays with controllable length for photoelectrocatalytic degradation of phenol[J].J Phys Chem C,2008,112:253-259.
[33]万斌,沈嘉年,陈鸣波,等.阳极氧化制备TiO2纳米管及其光催化性能[J].化学学报,2007,66:1301-1306.
(Wan B,Shen J N,Chen M B,et al.Preparation of TiO2nanotubes by anodization and its photocatalytic performance[J].Acta Chimica Silica,2007,66:1301-1306.)
[34]万斌,沈嘉年,陈鸣波,等.阳极氧化法制备TiO2纳米管及其光催化性能[J].应用化学,2008,25:665-668.
(Wan B,Shen J N,Chen M B,et al.TiO2nanotube prepared via anodizing and its photocatalytic performance[J].Chinese Journal of Applied Chemistry,2008,25:665-668.)
[35]Mor G,Varghese O,Paulose M,et al.Fabrication of tapered,conical-shaped titania nanotubes[J].J Mater Res,2003,18:2588-2593.
[36]Allam N K,Shankar K,Grimes C A.A general method for the anodic formation of crystalline metal oxide nanotube arrays without the use of thermal annealing[J].Adv Mater,2008,20:3942-3946.
[37]Shankar K,Basham J I,Allam N K,et al.Recent advances in the use of TiO2nanotube and nanowire arrays for oxidative photoelectrochemistry[J].J Phys Chem C,2009,113:6327-6359.
[38]薛寒松,李华基,胡慧芳,等.镧掺杂二氧化钛纳米管光催化性能[J].中国稀土学报,2008,26(1):18-23.
(Xue H S,Li H J,Hu H F,et al.Photocatalytic property of lanthanum-doped titanium dioxide nanotube[J].J Chin Rare Earth Soc,2008,26(1):18-23.)
[39]薛寒松,李华基,易于,等.铈掺杂二氧化钛纳米管光催化性能[J].机械工程材料,2008,32(6):36-39.
(Xue H S,Li H J,Yi Y,et al.Photocatalytic property of cerium-doped titanium dioxide nanotube[J].Mater Mech Eng,2008,32(6):36-39.)
[40]Lu N,Quan X,Li J,et al.Fabrication of boron-doped TiO2nanotube array electrode and investigation ofits photoelectrochemical capability[J].J Phys Chem C,2007,111:11836-11842.
[41]Li J,Lu N,Quan X,et al.Facile method for fabricating boron - doped TiO2nanotube array with enhanced photoelectrocatalytic properties[J].Ind Eng Chem Res,2008,47:3804-3808.
[42]Jiang Z,Yang F,Luo N,et al.Solvothermal synthesis of N-doped TiO2nanotubes forvisible- light- responsive photocatalysis[J].Chem Commun,2008,47:6372-6374.
[43]孙超,黄浪欢,刘应亮.氮掺杂二氧化钛纳米管制备与光催化性能[J].功能材料,2005,36(9):1412-1415.
(Sun C,Huang L H, Liu Y L. Preparation and characterization of N -doped TiO2nanotubes[J].Funct Mater,2005,36(9):1412-1415.)
[44]冯彩霞,王岩,金振声,等.N掺杂纳米TiO2可见光催化氧化丙烯的动力学行为[J].物理化学学报,2008,24(4): 633-638.
(FengC X,Wang Y,Jin Z S,et al.Kinetic behavior of visible light photocatalytic oxidation of propylene for N-doped nano-TiO2[J].Acta Physico-Chimica Sinica,2008,24 (4):633-638.)
[45]Park J H,Kim S,Bard A J.Novel carbon-doped TiO2nanotube arrays with high aspect ratios for efficient solar water splitting[J].Nano Lett,2006,6:24-28.
[46]Kim J,Choi J,Lee Y,et al.Enhanced photocatalytic activity in composites of TiO2nanotubes and CdS nanoparticles[J].Chem Commun,2006,2006:5024-5026.
[47]Li H,Zhu B,Feng Y,et al.Synthesis,characterization of TiO2nanotubes-supported MS(TiO2NTs@MS,M=Cd,Zn)and their photocatalytic activity[J].J Solid State Chem,2007,180:2136-2142.
[48]Chen Y,Crittenden J C,Hackney S,et al.Preparation of a novel TiO2-based junction nanotube photocatalyst[J].Environ Sci Technol,2005,39:1201-1208.
[49]Kontos A I,Likodimos V,Stergiopoulos T,et al.Selforganized anodic TiO2nanotube arrays functionalized by iron oxide nanoparticles[J].Chem Mater,2009,21:662-672.
[50]Grandcolas M,Louvet A,Keller N,et al.Layer-by-layer deposited titanate-based nanotubes for solar photocatalytic removal of chemical warfare agents from textiles[J].Angew Chem Int Ed,2009,48:161-164.
[51]Mohapatra S K, KondamudiN, Banerjee S, etal.Functionalization of self-organized TiO2nanotubes with Pd nanoparticles for photocatalytic decomposition of dyes under solar light illumination[J].Langmuir,2008,24:11276-11281.
[52]Chen H,Chen S,Quan X,et al.Fabrication of TiO@Pt coaxialnanotube array schottky structuresfor enhanced photocatalytic degradation of phenol in aqueous solution[J].J Phys Chem C,2008,112:9285-9290.
[53]Khan M A,Han D H,Yang O-B.Enhanced photoresponse towards visible light in Ru doped titania nanotube[J].Appl Surf Sci,2009,255:3687-3690.
[54]Ma R,Sasaki T,Bando Y.Layer-by-layer assembled multilayer films of titanate nanotubes,Ag- or Au-loaded nanotubes,and nanotubes/nanosheets with polycations[J].J Am Chem Soc,2004,126:10382-10388.
[55]赵谦,荆俊杰,姜廷顺,等.二氧化钛纳米管的合成及光催化性能[J].硅酸盐学报,2008,36(S1):1-5.
(Zhao Q,Jing J J,Jiang T S,et al.Photocatalytic property and synthesis of titania nanotubes[J].J Chin Ceram Soc,2008,36(S1):1-5.)
[56]Subramanian V,Wolf E,Kamat P V.Semiconductor-metal composite nanostructures to what extent do metal nanoparticles improve the photocatalytic[J].J Phys Chem B,2001,105: 11439-11446.
[57]Nishijima K,Fukahori T,Murakami N,et al.Development of a titania nanotube(TNT)loaded site-selectively with Pt nanoparticles and their photocatalytic activities[J].Appl Catal A,2008,337:105-109.
[58]Paramasivam I,Macak J,Schmuki P.Photocatalytic activity of TiO2nanotube layers loaded with Ag and Au nanoparticles[J].Electrochem Commun,2008,10:71-75.
[59]李海龙,罗武林,陈涛,等.载Ag二氧化钛纳米管的制备及其光催化性能[J].物理化学学报,2008,24(8):1383-1386.
(Li H L,Luo W L,Chen T,et al.Preparation and photocatalytic performance of titania nanotubes loaded with Ag nanoparticles[J].Acta Phys-Chim Sin,2008,24(8):1383-1386.)
[60]Jose R,Thavasi V,Ramakrishna S.Metal oxides for dyesensitized solar cells[J].J Am Ceram Soc,2009,92:289-301.
[61]Albu S P,Ghicov A,Macak J M,et al.Self-organized,free-standing TiO2nanotube membrane for flow -through photocatalytic applications[J].Nano Lett,2007,7:1286-1289.
[62]Naito K,Tachikawa T,Fujitsuka M,et al.Single-molecule observation of photocatalytic reaction in TiO2nanotube: importance of molecular transport through porous structures[J].J Am Chem Soc,2009,131:934-936.
[63]Wu J-M,Zhang T-W,Zeng Y-W,et al.Large-scale preparation of ordered titania nanorods with enhanced photocatalytic activity[J].Langmuir,2005,21:6995-7002.
[64]陶海军,秦亮,王玲,等.TiO2纳米管阵列的制备、热处理及其光催化性能[J].中国有色金属学报,2007,17(5): 693-698.
(Tao H J,Qin L,Wang L,et al.Fabrication,anneal and photocatalysis applications of self-organized TiO2nanotubes[J].The Chinese Journal of Nonferrous Metals,2007,17 (5):693-698.)
[65]Awitor K,Rafqah S,Géranton G,et al.Photo-catalysis using titanium dioxide nanotube layers[J].J Photochem Photobiol A,2008,199:250-254.
[66]Melghit K,Al-Rabaniah S S.Photodegradation of congo red under sunlight catalysed by nanorod rutile TiO2[J].J Photochem Photobiol A,2006,184:331-334.
[67]KarA, Smith Y R, Subramanian V R. Improved photocatalytic degradation of textile dye using titanium dioxide nanotubes formed over titanium wires[J].Environ Sci Technol,2009,43:3260-3265.
[68]Hou Y,Li X,Zou X,et al.Photoeletrocatalytic activity of a Cu2O-loaded self-organized highly oriented TiO2nanotube array electrode for 4-chlorophenol degradation[J].Environ Sci Technol,2009,43:858-863.
[69]Inagaki M,Kondo N,Nonaka R,et al.Structure and photoactivity of titania derived from nanotubes and nanofibers[J].J Hazard Mater,2009,161:1514-1521.
[70]王宁,李新勇,侯阳,等.TiO2纳米管的阳极氧化法制备及对对氯苯酚的光电降解研究[J].科学通报,2008,53
(13):1528-1532.(Wang N,Li X Y,Hou Y,et al.Preparation of anodic TiO2nanotubes and photoelectro-degradation of chlorophenol[J].Chin Sci Bull,2008,53(13):1528-1532.)
[71]Gao Z,Yang S,Ta N,et al.Microwave assisted rapid and complete degradation ofatrazine using TiO2nanotube photocatalyst suspensions[J].J Hazard Mater,2007,145:424-430.
[72]Liang H,Li X.Effects of structure of anodic TiO2nanotube arrays on photocatalytic activity for the degradation of 2,3-dichlorophenol in aqueous solution[J].J Hazard Mater,2009,162:1415-1422.
[73]Liu Z,Zhang X,Nishimoto S,et al.Efficient photocatalytic degradation of gaseous acetaldehyde by highly ordered TiO2nanotube arrays[J].Environ Sci Technol,2008,42:8547-8551.
[74]Nishijima K,Fujisawa Y,Murakami N,et al.Development of an S-doped titania nanotube(TNT)site-selectively loaded with iron(III)oxide and its photocatalytic activities[J].Appl Catal B,2008,84:584-590.
[75]Khan M A,Jung H -T,Yang O -B.Synthesis and characterization of ultrahigh crystalline TiO2nanotubes[J].J Phys Chem B,2006,110:6626-6630.
[76]Hsu Y-Y,Hsiung T-L,Wang H P,et al.Photocatalytic degradation of spill oils on TiO2nanotube thin films[J].Mar Poll Bull,2008,57:873-876.
One-dimensional photocatalytic nanostructure of titania for environmental remediation
LI Song,QIN Gao-wu,ZUO Liang
(Key Laboratory for Anisotropy and Texture of Materials(MoE),Northeastern University,Shenyang 110819,China)
Due to the high activity in photocatalysis and excellent stability,TiO2has been widely used in the field of environmental remediation and photovoltaic conversion.Investigations so far reveal that many pollutants can be degraded by illuminated TiO2,including halogenated hydrocarbon,azo dye,polycyclic aromatic hydrocarbon,and pesticide.One-dimensional nanostructures such as nanowire,nanotube,nanorod and their arrays exhibit unique photocatalytic performance because of the high surface-to-volume ratio and high aspect ratio.In this article,research works on preparation and photodegradation of kinds of organic contaminants using one-dimensional structured TiO2are reviewed.The specific roles of the anisotropic structure on improving the photocatalytic activities are also discussed.
titania;one-dimensional nanostructure;photocatalysis;environmental remediation
TB 34;X 703.1
A
1671-6620(2011)04-0309-09
2011-09-19.
辽宁省博士科研启动基金 (20101030).
李松 (1979—),男,山东汶上人,东北大学讲师,E-mail:lis@smm.neu.edu.cn.秦高梧 (1970—),男,江苏盐城人,东北大学教授,博士生导师.左良 (1963—),男,安徽桐城人,东北大学教授,博士生导师.

