水稻转座子Pong特异性RNAi载体TPAS的构建和农杆菌介导的遗传转化条件的优化
高立宏,张春玉,柴 娜,路云侠,刘 宝,刘立侠
(1.长春师范学院生命科学学院,吉林长春 130032;2.东北师范大学生命科学学院,吉林长春 130024;3.长春职业技术学院,吉林长春 130033)
水稻转座子Pong特异性RNAi载体TPAS的构建和农杆菌介导的遗传转化条件的优化
高立宏1,2,张春玉3,柴 娜2,路云侠2,刘 宝2,刘立侠2
(1.长春师范学院生命科学学院,吉林长春 130032;2.东北师范大学生命科学学院,吉林长春 130024;3.长春职业技术学院,吉林长春 130033)
为研究水稻转座子Pong的功能,构建了Pong的特异RNAi表达载体TPAS,并利用农杆菌介导法将这个载体转化到水稻的成熟胚愈伤组织,获得了PCR阳性的再生植株.同时通过对农杆菌侵染途径、侵染浓度和侵染时间等的研究,建立并优化了水稻的遗传转化程序.结果表明:在农杆菌侵染成熟胚愈伤组织的时间为3 min,共培养2~4 d,预培养7 d,G418质量浓度为150~200 mg/L条件下筛选7 d,转化率可达到30%,为最佳的遗传转化参数.研究结果为今后水稻转座子Pong功能的进一步研究提供了一定的基础和参考.
水稻;转座子;RNAi;农杆菌介导;遗传转化
水稻(OryzasativaL.)是禾本科植物中基因组最小的作物,被公认为是禾谷类作物遗传研究的模式植物[1-2].在植物体中,表观遗传的调控影响着遗传转化中很多的基因表达过程,包括转座子活性的改变[3]、同源依赖的转基因沉默[4-5]等.转座子(transposable elements or transposons,Tn)是基因组中一段能够移动的DNA序列,通过切割、重新整合等可从一个位置移动到另一个位置.Tn Pong全长为5 166 bp,是水稻转座子中的一个较为特殊的成员,在籼稻和粳稻的基因组中都存在.在水稻基因组中,Pong大约有70个拷贝,NCBI上Pong基因(序列号BK000586)有两个开放阅读框(open reading frame,ORF),其中已知ORF2编码转座酶,而ORF1的功能尚未知.Tn Pong与转座子Ping(transposon ping,Tn Ping)有相似的末端序列,同时在两个ORF也有较高的同源性.本实验构建了Pong的ORF1上游与Ping非同源区域的RNAi载体,并将其利用农杆菌侵染法转入到水稻中以获得转化的阳性植株,为进一步的研究提供了实验材料,并通过对再生植株的表型观察及分子检测,证明外源基因已经整合到水稻的基因组中.
1 实验材料
1.1 植物材料
水稻品种为松前,由东北师范大学表观遗传学实验室提供.
1.2 载体及菌株材料
大肠杆菌DH5α、农杆菌LBA4404为本实验室保存;中间载体p KANNIBAL,pPSP72,pBI121购自CLOETECH公司;PCR引物由上海生工公司合成.
1.3 水稻组织培养和转化使用的培养基
组织培养和转化使用的基本培养基为NB培养基,具体组成见表1.

表1 水稻组织培养和转化过程中使用的培养基组成
2 实验方法
2.1 TPAS的RNAi载体的构建
2.1.1 目的片段的克隆
根据NCBI上Pong基因(序列号BK000586)序列与Ping的非同源区域,设计以下引物:
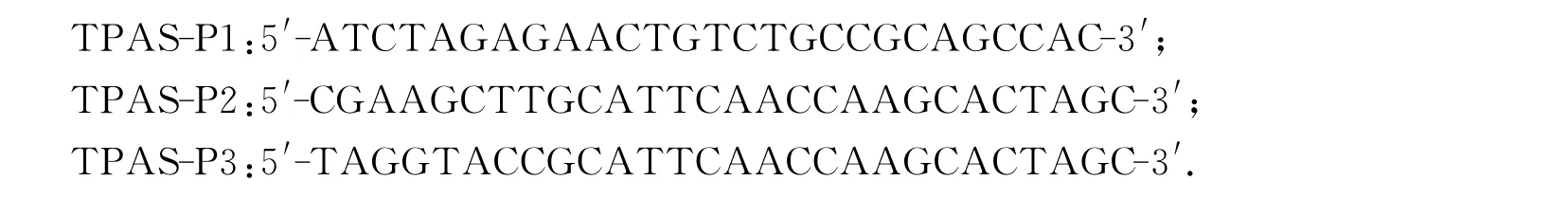
利用PCR方法,以水稻松前的DNA为模板,以TPAS-P1与TPAS-P2为引物,扩增了目的基因片段TPAS-;以TPAS-P1与TPAS-P3为引物,扩增了目的基因片段TPAS+,两片段长度均为222 bp.
2.1.2 TPAS的RNAi载体的构建
将PCR产物TPAS-与质粒p KANNIBAL进行连接,连接产物命名为p KANNIBAL-;将TPAS+用内切酶Xba I,Kpn I双酶切并连接到pSP72相应的酶切位点上,产物命名为pSP72+.然后用Xho I,Kpn I酶切pSP72+,并连接到p KANNIBAL-相应的酶切位置上(p KANNIBAL+/-);提取(p KANNIBAL+/-)质粒并酶切鉴定,鉴定结果表明已经连入长度约1 300 bp的目的DNA片段.
将转化质粒p KANNIBAL+/-目的DNA正向、反向分别进行测序.应用BLAST软件将克隆片段碱基序列与GenBank中的已知序列进行同源性比对,发现该序列与已登录的数据完全相同.将构建好的质粒Xba I单酶切转入植物表达载体PBI121中.HindIII酶切鉴定接入的目的序列的方向,获得构建好的载体TPAS.将获得的转化载体TPAS转化到农杆菌4404中并进行PCR鉴定.菌株保存在-80℃低温冰箱中备用.
2.2 水稻组织培养及遗传转化体系优化
本实验采用农杆菌介导的水稻遗传转化法获得转基因材料[6-7].结果表明组织培养和转化过程中的许多因素都能影响水稻的遗传转化效率,如供体材料的基因型,外植体的类型和生理状态,培养基中的有机物、无机盐和植物生长调节因子,培养条件如湿度、温度以及光的强度等[8-9].其中,基因型是组织培养中最大的限制因子.因为品种之间的脱分化和再分化能力存在差异,所以农杆菌介导的水稻遗传转化效率常常受到水稻品种遗传背景的限制[10-12].与其他水稻品种比较,本实验室对松前的遗传背景了解较透,且已经建立了良好的组织培养体系,所以选择松前作为实验材料[13].
水稻组织培养及遗传转化的基本程序:将去壳的种子放入灭菌的三角瓶中,加75%的酒精消毒30 s,除去余液;加入0.1%升汞消毒10~20 min,消毒后的种子放入到诱导培养基中,每瓶大约10粒;7~10 d后将长出的芽拔掉,只留下末端的愈伤组织,将其转入到新的诱导培养基中.将生长21 d的愈伤组织进行继代培养后再培养7~10 d备用.菌液活化后利用NB液体培养基将其稀释,然后将愈伤组织取出放到菌液中,侵染;用滤纸吸干愈伤组织表面的余液,再将愈伤组织转入至共培养基中,并在培养基表面铺上一层无菌滤纸,28℃暗培养.2~7 d后将愈伤组织转入预培养基中,28℃暗培养一段时间,然后转入到分化筛选培养基中;将筛选长出的小苗移到1/2 MS生根培养基中,待根生长健壮后,移入盆钵中继续培养至结实.
2.2.1 农杆菌菌液分数的设计
调节TPAS菌液的分数使其在600 nm的光吸收值D(600)为0.6,然后分别稀释到其倍数的1×, 1/2×,1/3×,1/4×.将愈伤组织浸入上述已准备好的农杆菌溶液中侵染3~10 min,共培养至可以见到菌体.清洗掉愈伤上的菌体,再预培养7~10 d,然后转入到分化培养基进行分化培养,统计愈伤率.愈伤率(%)=(产生新愈伤组织的块数/接种的愈伤组织块数)×100%.
2.2.2 农杆菌浸染时间的设计
将TPAS菌液分数稀释到D(600)值为0.2,然后将愈伤组织放到农杆菌溶液中分别侵染1,3,6,15,25 min,共培养3 d,预培养7 d,然后进行分化培养,统计愈伤率、成苗率及转化植株数.
2.2.3 共培养时间的选择
将TPAS菌液分数稀释到D(600)值为0.2,然后将愈伤组织放到农杆菌溶液中侵染3 min,用无菌滤纸吸干余液后,转至共培养培养基上,培养时间分别为1,2,3,4 d(在培养基表面铺上一层无菌滤纸),再转入到分化培养基中,统计愈伤率、成苗率及转化植株数.
2.2.4 预培养时间的选择
将TPAS菌液分数稀释到D(600)值为0.2,然后将愈伤组织放到农杆菌溶液中侵染3 min,用无菌滤纸吸干余液后,转至共培养培养基上,培养3 d;将共培养后的愈伤组织用乙酰丁香酮培养液或无菌水冲洗,至洗液为透明后,转至预培养培养基上进行预培养,分别培养1,2,3,5,7 d后,转入至分化培养基中,统计愈伤率、成苗率及转化植株数.
2.2.5 筛选浓度的选择
用TPAS侵染愈伤组织3 min,共培养3 d,预培养7 d,然后进行筛选培养.筛选剂G418的质量浓度分别为:0,20,40,50,100,200 mg/L,统计愈伤率、成苗率及转化植株数.
2.3 转基因材料的种植和检测
2.3.1 种植条件
转基因植株生根培养后,将根长3~5 cm生长健壮的植株进行炼苗,移栽到国际水稻营养液中,在26℃室内弱光环境下成活后移至室外,自然条件下培养至结实.
2.3.2 GFP检测
切取转基因培养后的长度为1~2 mm的幼苗嫩叶片,加一滴清水后用盖玻片覆盖,将盖玻片按压平整后在荧光显微镜下观察.
2.3.3 PCR检测
取叶片2 g,提取水稻基因组总DNA,然后进行PCR反应,检测是否含有NPTII基因.扩增引物序列为:5′-AACAGACAATCGGCTGCTCT-3′,5′-CCACCATGATATTCGGCAAGCA-3′.
3 结果与分析
3.1 表达载体的构建
本实验利用CTAB法提取了水稻的基因组DNA[12],电泳检测表明,获得的基因组DNA片段大小约为6 500 bp(见图1A);以总DNA为模板进行PCR扩增,取PCR产物2μL进行琼脂糖凝胶电泳检测,获得的DNA片段大小约为220 bp,电泳结果见图1B;中间载体经p KANNIBAL-TPAS-酶切检测,获得了220 bp的DNA片段,证明所连接的片段为目的DNA(见图1C).p KANNIBAL-TPAS+/-XbaI单酶切得到大小约1 300 bp的片段(见图1D),这和设计的RNAi的大小一致(两个反向重复的目的基因之间的间隔片段大小为850 bp).构建的表达载体见图2.
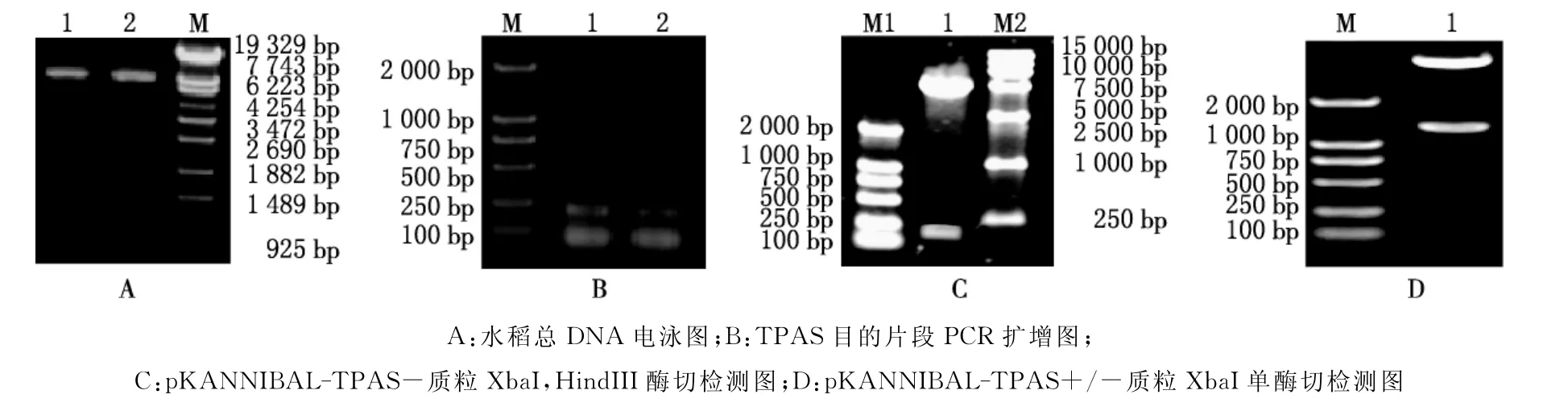
图1 电泳检测结果
3.2 水稻愈伤组织的培养及转化优化
3.2.1 农杆菌菌液分数对水稻愈伤组织侵染效果的影响
随着农杆菌分数的增加,侵染后的愈伤组织活性逐渐下降,出愈率、成苗率也都随之下降,但转化率却略有提升.表现为随着农杆菌分数的增加共培养相同的时间,农杆菌聚集在愈伤组织周围的数量也逐步增加.1/3×稀释菌液处理中,共培养3 d后,在愈伤组织和培养基接触处略微可见农杆菌的痕迹;而在1×液处理中的愈伤组织上很快长满大量的农杆菌,愈伤组织迅速呈现暗黄色,继续放置2 d则变成暗褐色,愈伤组织逐渐死亡;在1/4×稀释菌液处理中,需4~5 d方可看见愈伤组织与培养基接触处略微有农杆菌的痕迹,共培养后用无菌水洗去农杆菌,转入至分化培养基后,旧的愈伤组织上会生长出新的愈伤组织,出愈率随着农杆菌分数的增加而降低,甚至全部褐化死亡,即使生长出部分愈伤,质量也很差,分化能力很低(见表2).
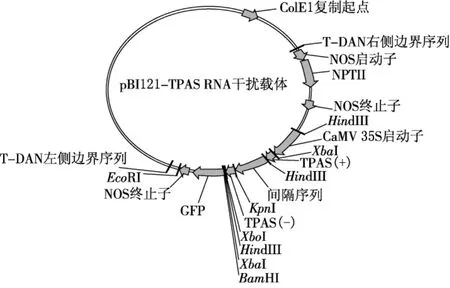
图2 TPAS RNAi表达载体
3.2.2 农杆菌浸染时间对侵染效果的影响
农杆菌侵染时间在3~6 min时,差异不是很大,愈伤组织状态较好.侵染1 min,愈伤组织状态虽然很好,但共培养后在愈伤组织及培养基中未发现生长的农杆菌,转化率很低;而侵染时间超过15 min后,随着侵染时间的延长,愈伤组织的生长受到抑制,大量愈伤变成褐色,失去活性,同时出愈率和成苗率也随着侵染时间的增加而下降.由表3可以得出结论:农杆菌侵染3 min的效果较好.
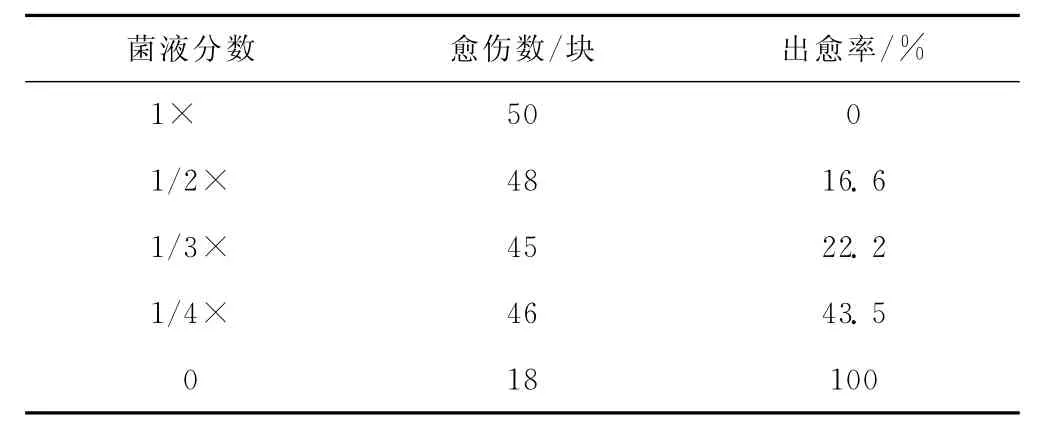
表2 农杆菌菌液分数对水稻愈伤组织浸染效果的影响

表3 农杆菌侵染时间对浸染效果的影响
3.2.3 共培养时间对农杆菌侵染效果的影响
在菌液D(600)=0.2,农杆菌侵染愈伤组织3 min的条件下,共培养3 d后,获得转化苗4株,是获得转化苗数量最多的,因此3 d是最适合的共培养时间(见表4).另外共培养时间、侵染时间和农杆菌的分数有关,菌液浓度越高,农杆菌繁殖速度越快,越抑制愈伤组织的生长,使愈伤组织迅速褐化而失去活性;共培养的时间短虽然出苗率很高,但出现假阳性植株的比率就会增加,所以一般不能少于16 h.
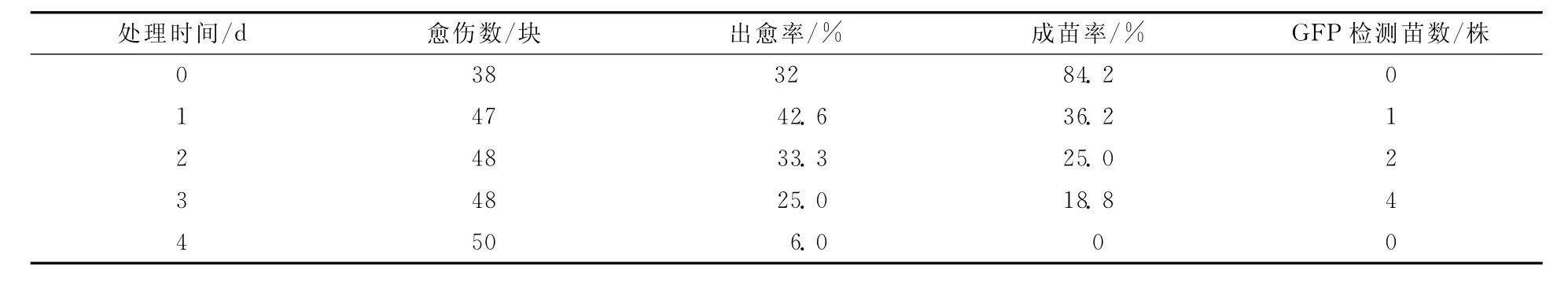
表4 共培养时间对农杆菌浸染效果的影响
3.2.4 预培养时间对农杆菌侵染效果的影响
共培养后将愈伤组织转至预培养培养基中,利用头孢霉素对外植体进行脱菌培养,同时也使愈伤组织恢复良好的生长状态.预培养的时间短,愈伤组织无法恢复生长而导致分化能力丧失;但预培养的时间也不能够过长,培养10 d比7 d获得的转化苗数量少,可能的原因是转基因细胞的生长能力弱于非转基因细胞,导致转基因细胞增殖缓慢,进而使转基因植株获得量迅速降低.从表5的结果来看,预培养的时间以5~7 d为最适宜.

表5 预培养时间对农杆菌浸染效果的影响
3.2.5 筛选剂G418使用浓度和使用时间对转基因筛选效果的影响
预培养后将愈伤组织转到含G418的筛选培养基中进行筛选培养,随着不同质量浓度的G418筛选时间的延长,水稻均表现出分化能力显著下降,所以本实验后期采用了高质量浓度(200 mg/L)短时间筛选的办法,以期既能达到筛选效果又可尽量降低对水稻分化率的影响,最后确定的筛选时间为7~10 d.
3.3 水稻转基因植株的GFP和PCR检测
本实验共获得40株转化阳性植株(见图3、图4),GFP检测结果见图5,在荧光显微镜下观察到叶片呈现强的绿色荧光为转基因植株,紫红色荧光则为非转基因植株.提取水稻幼嫩叶片基因组总DNA,并以此为模板,根据NPTⅡ基因序列设计引物,进行PCR扩增反应;将PCR反应产物进行电泳检测发现未转化植株没有外源目的条带出现,转化植株则能扩增出550 bp的NPTⅡ基因片段,如图6中条带8与13,这与GFD的检测结果一致.

图3 侵染后分化的愈伤组织及获得的植株

图4 转基因植株与未转化植株

图5 转基因植株GFP检测图

图6 转基因植株的PCR检测图
4 结论
本研究利用已经构建的RNAi干扰载体TPAS对水稻进行了遗传转化实验,获得了水稻阳性植株的最初材料,结果表明,水稻的遗传转化程序为:在农杆菌浸染浓度D(600)=0.2,侵染时间3 min,共培养2~4 d,预培养5~7 d,G418质量浓度150~200 mg/L条件下筛选7 d,转化率可达到30%.
转化后的水稻在农艺性状上表现出植株较高、生长期延长、分蘖减少、叶片细长等特征(见图4),可能与转化的基因有一定的关系.但TPAS转化后对水稻生长的影响还需进一步观察,TPAS功能的研究还需进行转座子活性和基因组DNA的甲基化检测才能进一步确定.
[1]朱正歌,孙宗修.转座子标签法克隆水稻基因前景[J].中国水稻科学,2001,15(1):46-50.
[2]EDWARDS J D.Sources and predictors of resolvable indel polymorphism assessed using rice as a model[J].Mol Genet Genomics,2004,23:298-307.
[3]MARTIENSS EN R A,RICHARDS E J.DNA methylation in eukaryotes.[J].Curr Opin Genet Dev,1995,5(2):234-342.
[4]MATZKE M A,MATZKE A J M,EGGLESTON W B.Paramutation and transgene silencing:a common response to invasive DNA[J].Trends Plant Sci,1996(1):382-388.
[5]KOOTER J M,MATZKE M A,MEYER P.Listening to the silent genes:transgene silencing,gene regulation and pathogen control[J].Trends Plant Sci,1999,4(9):340-347.
[6]王关林,方宏筠.植物基因工程原理与技术[M].北京:科学出版社,1998:237-251.
[7]胡凤仙,何龙飞,易小平,等.根癌农杆菌介导水稻基因转化研究进展[J].广西农业生物科学,2001,20(2):137-140.
[8]LANGDON T,JENKINS G,HASTEROK R,et al.A high-copy-number CACTA family transposon in temperate grasses and cereals.[J].Genetics,2003,163(3):1097~1108.
[9]单晓辉.菰DNA渐渗诱发水稻内源转座子mPing,Pong的转座激活[D].长春:东北师范大学,2007.
[10]FENG Q,ZHANG Y,HAO P,et al.Sequence and analysis of rice chromosome[J].Nature,2002,420:316-320.
[11]FESCHOTTE C,ZHANG X,WESSLER S R.Miniature inverted-repeat transposable elements(MITEs)and their relationship with established DNA transposons in Mobile DNAⅡ[G]//CRAIG N L,CRAIGIE R,GELLERT M,et al.Washington DC:Americian Society for Microbiology Press,2001:1147-1158.
[12]卢扬江,郑康乐.提取水稻DNA的一种简易方法[J].中国水稻科学,1992,6(1):47-48.
[13]高立宏,路云侠,柴娜,等.水稻转座子Pong RNAi载体的构建和农杆菌介导的遗传转化[J].东北师大学报:自然科学版,2011,43(2):117-123.
Specific RNAi vector construction of transposon Pong in rice andAgrobacteriumtumefaciens-mediated genetic transformation optimization
GAO Li-hong1,2,ZHANG Chun-yu1,3,CHAI Na1,LU Yun-xia1,LIU Bao1,LIU Li-xia1
(1.School of Life Sciences,Changchun Teachers College,Changchun 130032,China;2.School of Life Sciences,Northeast Normal University,Changchun 130024,China;3.Changchun Vocational Institute of Technology,Changchun 130033,China)
To study the function of rice transposon Pong,the research constructed the specific RNAi expressed vector TPAS of transposon Pong in rice,and transferred the vectors into the mature embryo callus of the rice cultivar Matsumae,and then obtained the regeneration of the positive PCR results byAgrobacteriumtumefaciens-mediated method.To establish and optimize genetic transformation process,the different infected ways,concentrations and time ofAgrobacteriumwere chosen.The result showed that:the infection time ofAgrobacteriumto mature embryo callus is 3 min,the time of coculture is 2~4 d,the pre-culture period is 7 d,all the dates were the best genetic transformation parameters,making the basis for the function of rice Tn Pong.
rice;transposon;RNAi;tumefaciens-mediated;genetic transformation
Q 943.2
180·7110
A
1000-1832(2011)04-0122-06
2011-06-12
国家重点基础研究发展计划(973)项目(2005CB120805).
高立宏(1975—),女,博士研究生,讲师;通讯作者:刘立侠(1959—),女,博士,教授,博士研究生导师,主要从事植物分子遗传研究
方 林)

