微卫星分析9个哲罗鱼野生群体的遗传多样性
刘 博, 匡友谊, 佟广香, 尹家胜,*
(1.中国水产科学研究院黑龙江水产研究所, 黑龙江 哈尔滨 150070;2. 上海海洋大学 水产与生命学院, 上海 201306)
微卫星分析9个哲罗鱼野生群体的遗传多样性
刘 博1,2, 匡友谊1, 佟广香1, 尹家胜1,*
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨150070;2.上海海洋大学 水产与生命学院,上海201306)
哲罗鱼(Hucho taimen)是我国珍稀的土著冷水性鱼类, 目前已处于濒危状态。为了解哲罗鱼的种群遗传多样性和遗传结构, 该研究利用20对微卫星标记对9个野生哲罗鱼群体进行了分析。结果表明:9个哲罗鱼群体的观测杂合度在0.0994~0.8882, 期望杂合度在0.2005~0.8759, PIC指数在0.3432~0.5261, 其中呼玛河群体的遗传多样性较低。群体间的Fst在0.0246~0.2333 (P<0.0001),Nm在0.8216~9.9292, 群体间遗传分化较明显, 基因交流少;群体的同胞系比例在27.78%~90.91%, 说明近交压力较大, 可能经历过遗传瓶颈或存在这样的风险。AMOVA分析表明,群体间各基因座遗传分化系数的均值为0.1081;聚类分析结果显示北极江段群体独立为一支,呼玛河群体与乌苏里江各群体聚为一支, 黑龙江中上游各群体聚为一支。这些结果表明,哲罗鱼资源量的减少已经影响了群体间的基因交流。应杜绝对哲罗鱼资源破坏性捕捞,同时加强群体间基因交流, 以期达到全面保护哲罗鱼种质资源的目的。
哲罗鱼; 微卫星; 遗传多样性; 遗传结构
哲罗鱼(Hucho taimen)属鲑形目(Samoniformes)鲑科(Salmonidea)哲罗鱼属(Hucho), 历史上曾广泛分布于东北欧的伏尔加河、皮乔拉河,西伯利亚的贝加尔湖流域及中国的黑龙江流域、额尔齐斯河流域(Holcik et al, 1988; Li et al, 1966)等地区。20世纪50—60年代, 在黑龙江、乌苏里江、松花江各水系中均存在有哲罗鱼群体, 但是, 由于近几十年来栖息地环境的恶化、产卵场的破坏及过度捕捞导致其野生资源量急剧下降。目前仅在黑龙江上游、乌苏里江流域和新疆的哈纳斯湖存在一定数量的哲罗鱼群体, 其他原栖息地种群已经消失或仅存零星个体 (Ren et al, 2002; Dong et al, 1998a), 1998年被列为我国濒危物种(Le & Chen, 1998)。有学者研究了哲罗鱼的种群结构、资源量、分布区域等现状 (Jiang et al, 2004; Yin et al, 2003; Ren et al, 2002; Dong et al, 1998b; Li et al, 1966), 发现近20年来哲罗鱼的资源量下降较快, 尤其是从1998—2003年, 乌苏里江流域的哲罗鱼资源量下降了50%。由此可见, 保护哲罗鱼的种质资源及资源量势在必行。为更好地扩大有效繁殖哲罗鱼群体和恢复其资源量, 有必要从拥有更丰富信息量的基因组角度出发, 利用分子生物学方法, 掌握哲罗鱼的遗传多样性现状和种群遗传结构。
目前利用分子生物学方法对哲罗鱼种质资源的研究报道较少, 且过去几年, 由于已知的哲罗鱼DNA序列较少, 其可用的微卫星分子标记较少, 研究多采用了AFLP标记 (Kuang et al, 2007; Tong et al, 2009), 该方法对实验技术和DNA质量要求较高,存在一定的局限性。在利用微卫星标记方面, 由于可用标记缺少, 仅仅是对个别江段的哲罗鱼群体分析(Liang et al, 2004)和在亲子鉴定方面的应用(Zhang et al, 2010)。随着目前哲罗鱼可用的微卫星标记逐渐增多 (Froufe et al, 2004; Hatakeyama et al, 2005; Tong et al, 2006a, 2006b), 有必要对黑龙江流域和乌苏里江流域的哲罗鱼野生群体的遗传多样性进行更全面的分析。本研究利用20对微卫星标记对黑龙江流域和乌苏里江流域哲罗鱼9个群体的遗传多样性、遗传结构及基因流进行了分析, 以期为哲罗鱼的种质资源保护提供参考依据。
1 材料与方法
1.1 实验材料
九个野生哲罗鱼群体共161尾, 剪取鳍条, 用75%乙醇固定保存, 采样地点及样本数量见表1及图1。
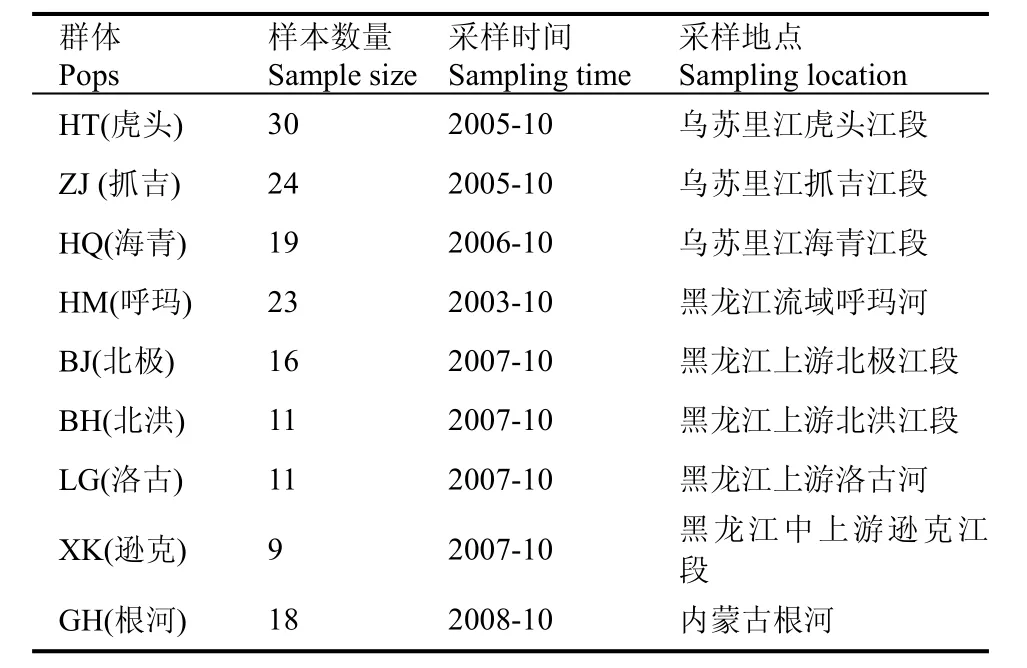
表1 采样地点与样本数量Tab. 1 The sampling sites and the number of sample
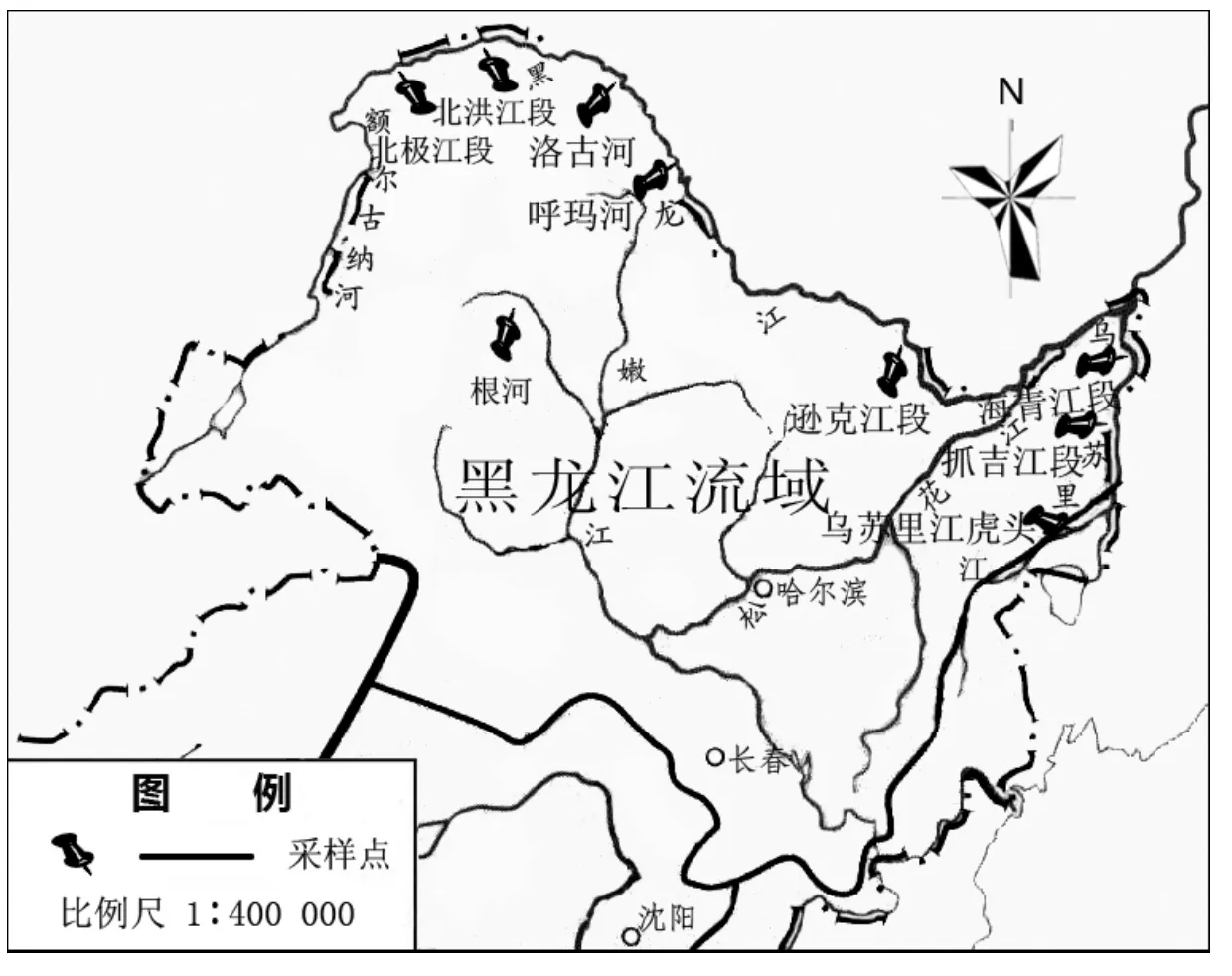
图1 采样点图示Fig. 1 Sampling sites were showed in the map
1.2 基因组DNA的提取
将鳍条样品取出, 在超纯水中反复清洗除去酒精后采用酚、氯仿提取样品DNA, 用1.0%琼脂糖凝胶电泳检测, 用紫外分光光度计测定其浓度和纯度后备用。
1.3 微卫星引物筛选
本研究筛选出20对能稳定扩增且条带清晰的微卫星引物, 用于9个群体的遗传多样性分析。其中,HtaCA25、HtaCA69、HtaCA63、HtaCA101由本实验室自行开发 (Tong et al, 2006b), 其余标记来自GenBank (Froufe et al, 2004; Hatakyama et al, 2005), 引物序列信息见表2。
1.4 PCR扩增及电泳
PCR扩增反应采用15 µL体系, 其中包括20 ng/µLDNA模板1 µL,TaqDNA聚合酶0.6 U, 10×PCR Buffer 1.5 µL, dNTP (2.5 mmol/L) 1.2 µL, MgCl2(25mmol/L) 0.9 µL, 10 µmol/µL上下游引物各0.5 µL, 无菌水补足15 µL。PCR反应程序为:94 ℃预变性5 min; 94 ℃变性30 s, 退火30 s, 72 ℃30 s, 30个循环;最后72 ℃延伸10 min。
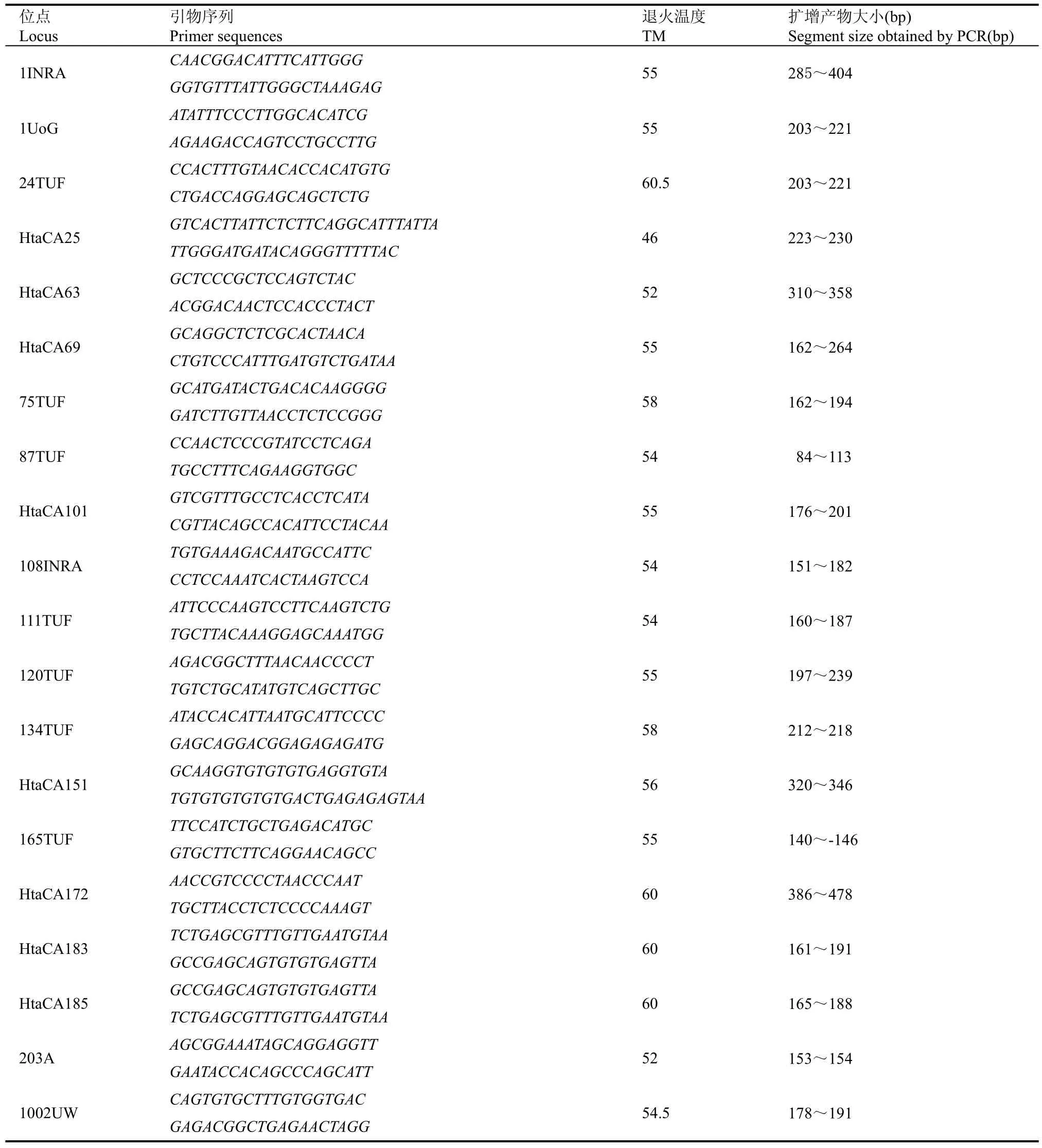
表2 20对微卫星引物信息Tab. 2 Twenty SSR primers available to Hucho taimen
PCR扩增产物用8%非变性聚丙烯酰胺凝胶电泳 (8 V/cm, 4 ℃, 8~10 h)进行检测, 经银染后, 用扫描仪扫描成像。
1.5 数据分析
利用gel-pro软件(version4.5)分析所获得的微卫星指纹图, 由Genepop (version4.1)进行各基因座间连锁不平衡分析, 卡方检验估计Hardy-Weiberg平衡偏离;用Popgene (version1.32)分析以下参数:基因频率P、观测等位基因Na、有效等位基因Ne、Shannon多样性指数I、观测杂合度Ho、期望杂合度He、Nei’s遗传距离D和遗传相似系数S、遗传偏离指数d, 多态信息含量PIC使用Bostein公式计算(Bostein et al, 1980)。
用AMOVA方法分析群体间全局(Globle) F统计量及群体间配对的遗传分化Fst (pariwiseFst),并进行置换检验 (Permutaion tests,10 000次)。使用软件NeEstimator (version 1.3), 采用Linkage Disequilibrium (Robin, 2006;Waples et al, 2008) 和Heterozygote Excess两种方法估算有效群体的大小,用Kingroup (version20080229b)进行全同胞和半同胞系的检测(Konovalov et al, 2004)。
按照Wright的方法计算反映基因流强度的群体每代迁移数Nm, 其关系式为:Nm=(1−Fst)/4Fst。使用Bottleneck遗传瓶颈分析软件检测各群体遗传瓶颈, 采用Stepwise Mutation Model (SMM)、Infinite Allele Model (IAM)以及Two Permutation Model (TPM) (70% IAM, 70% SMM)这3种模型进行评估(Comuet et al, 1996)。
采用phylip (version3.69)软件, 以UPGMA (Unweighted Pair Group Method with Arithmetic mean)法进行聚类分析并构建系统发生树, 遗传距离利用Nei’s公式计算。
2 结 果
2.1 遗传多样性分析
各群体的观测等位基因Na、有效等位基因Ne、Shannon多样性指数I、观测杂合度Ho、期望杂合度He、遗传偏离指数d、多态信息含量PIC等遗传多样性参数见表3。从表中可以看出,Na、Ne、I、PIC这4个参数的值都是北洪 (BH)群体最高, 呼玛河 (HM)群体最低。9个群体的多态信息含量PIC为0.3432~0.5261, 其中北洪 (BH)群体最大, 呼玛(HM)群体最小。
全局Hardy-Weiberg检验表明, 20个位点除203A外均有不同程度的偏离Hardy-Weiberg平衡,而对各个群体的HW检验发现,除虎头 (HT)群体外, 其余各群体均有30%左右的位点偏离HW平衡(P<0.05), 其中BH群体最多达到了12个(表4)。分析各个群体的遗传偏离指数d发现, 除BH群体遗传偏离指数d为正数外, 其他群体均为负数, 说明大多数群体遗传偏离平衡表现为杂合子缺失, 其中BH、GH 这2个群体遗传偏离程度较高。
2.2 群体遗传分化分析
群体间配对遗传分化度 (Fst)和基因流 (Nm)分析见表5。全局Fst和群体间配对Fst分析结果发现, 总的群体间遗传多样性为0.1081, 群体间方差组分占总方差的10.81%, 并达到极显著水平(P<0.0001), 种群的遗传多样性主要分布在种群内,占变异成分的89.19%, 配对群体间的Fst在0.0246~0.2333, 且均达到极显著水平 (P<0.0001),Nm在0.8216~9.9292, ZJ与HQ之间遗传分化度最小, 基因流最大, BH与HM之间遗传分化度最大,基因流最小。
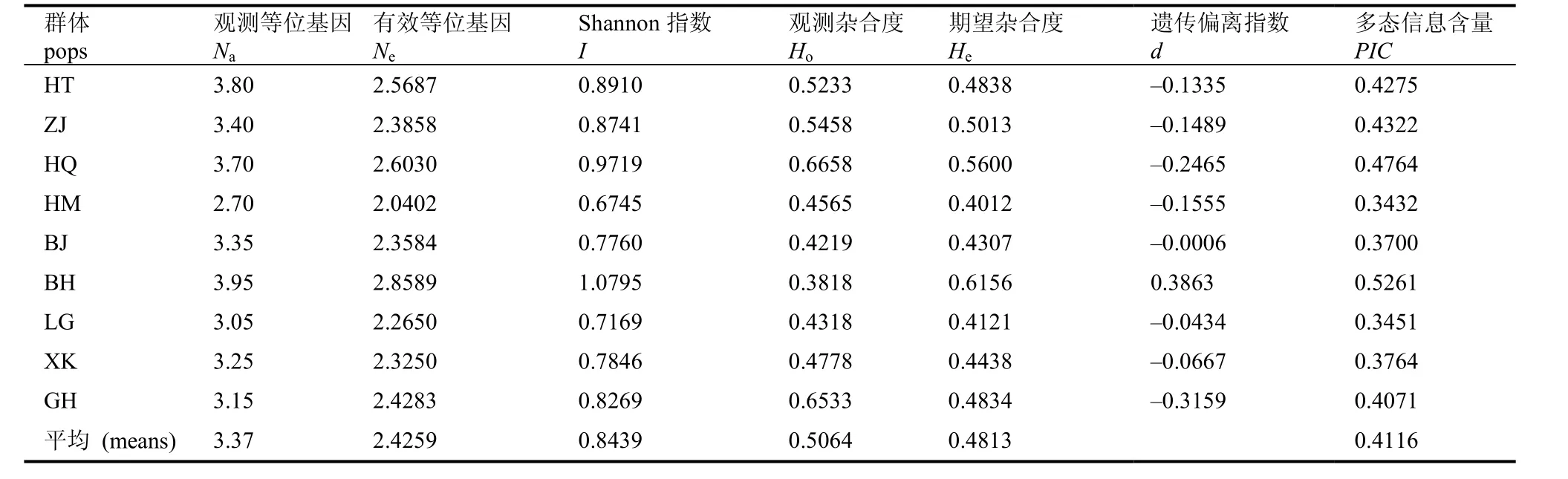
表3 9个群体的遗传多样性检测Tab. 3 Genetic diversity analyses for Hucho taimen in nine populations
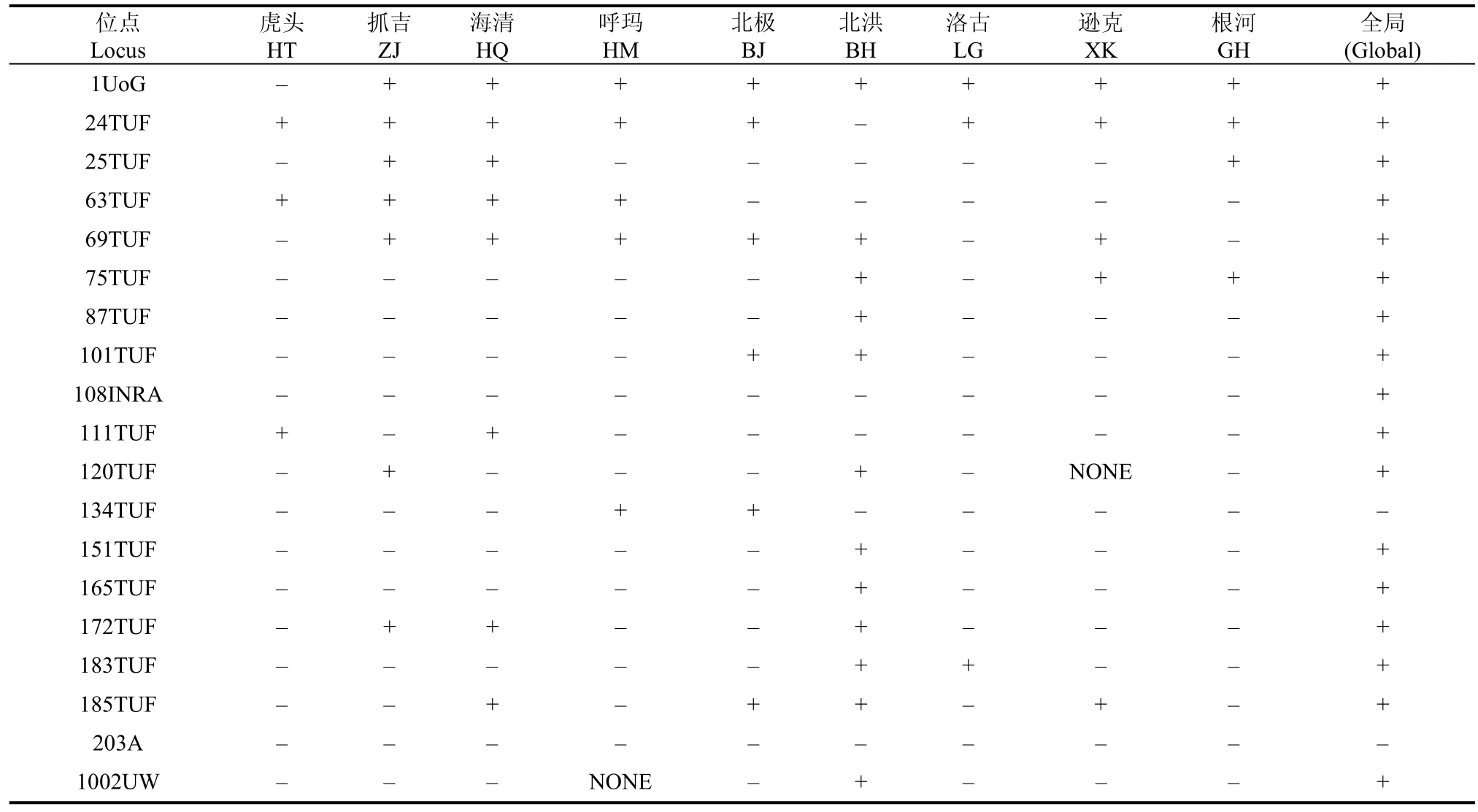
表4 各位点哈代温伯格平衡检验Tab. 4 HW-equivalence results of each population at each locus
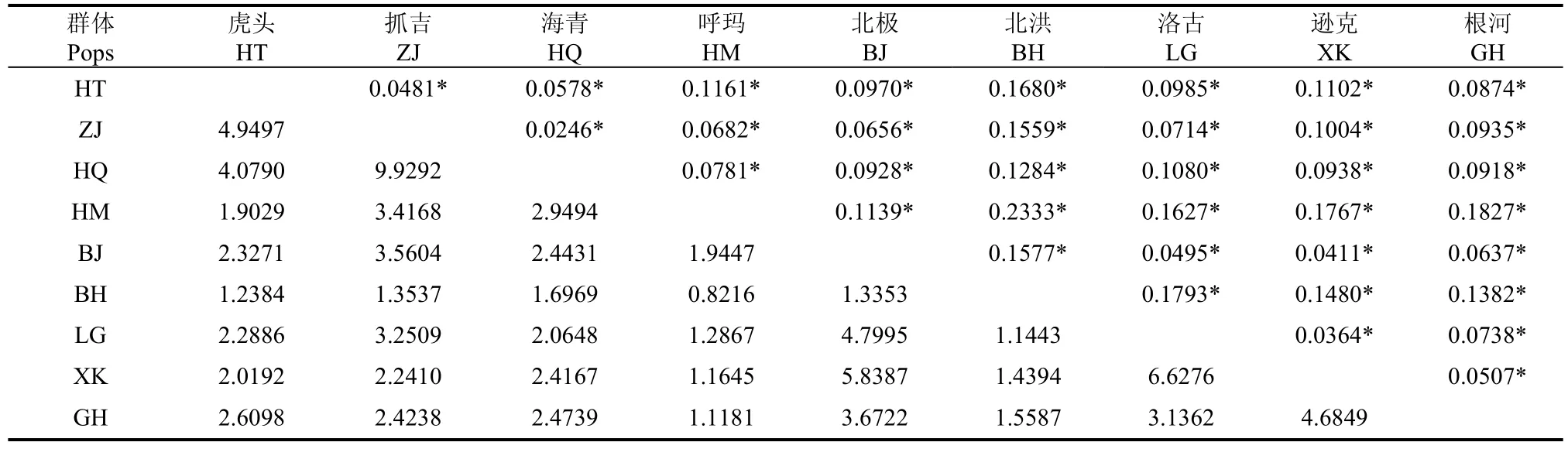
表5 群体间遗传分化度Fst(对角线上)和基因流Nm(对角线下)Tab. 5 Pairwise Fst values (above diagonal) and Gene flowNm (under diagonal) between all pairs of geographic populations
2.3 遗传瓶颈检测
通过Bottleneck对各群体的遗传瓶颈检测发现, ZJ和HM群体在IAM和TPM模型下都表现出杂合子过剩 (P<0.001)现象, 且表现出偏离L-shaped分布;HQ和BH群体则在这两种模型下都表现出杂合子过剩现象 (P<0.001), 但未偏离L-shaped的分布; HT群体则在IAM模型下表现出极显著的杂合子过剩现象 (P<0.0001), 且表现出偏离L-shaped分布; 而GH、XK这两个群体只检测到偏离L-shaped分布, 而在3种模型下都未检测到杂合子过剩。从总体来看, 以上这几个群体在历史上都很有可能经历过遗传瓶颈(Comuet et al,1996)。
2.4 有效群体估计和同胞家系的检测
使用软件NeEstimator (version 1.3)检测有效群体, 其中采用连锁不平衡计算方法 (Linkage Disequilibrium)检测时, HT群体的有效群体数量最大, 为74.6;BH群体最小, 仅为6.2。然而,BJ、HM、HQ、LG在内的几个群体通过该计算方法无法检测到有效群体(Robin, 2006;Waples et al, 2008),而通过杂合子过剩计算方法 (heterozygote excess)检测时XK群体的有效群体数量最大为41.4, 而HQ群体最小仅为4.6。从总体的趋势来看, 9个群体的有效群体数量都较小, 通过同胞家系的检测证明了这一点。在采用Kingroup进行的同胞对检测中9个群体中共检测出66个同胞/半同胞对, 包含113个个体, 占所有个体数的70.18%, 除LG、XK、GH这4个群体同胞对比例低于50%, 其余各群体属于同胞对的个体,占总样本比例都高于70%, 其中BH最高, 达到了90.91%。总体来说, 各群体检测到的同胞对比例都较大。
2.5 群体间遗传距离及聚类分析
利用Popgene软件计算了群体间Nei氏遗传距离D和遗传相似系数S, 见表6。各群体间以HM与BH之间遗传距离最大 (D为0.3031), 而遗传相似系数最低 (S为0.7386);HQ与ZJ之间遗传距离最小 (D为0.0436), 而遗传相似系数最高 (S为0.9573)。
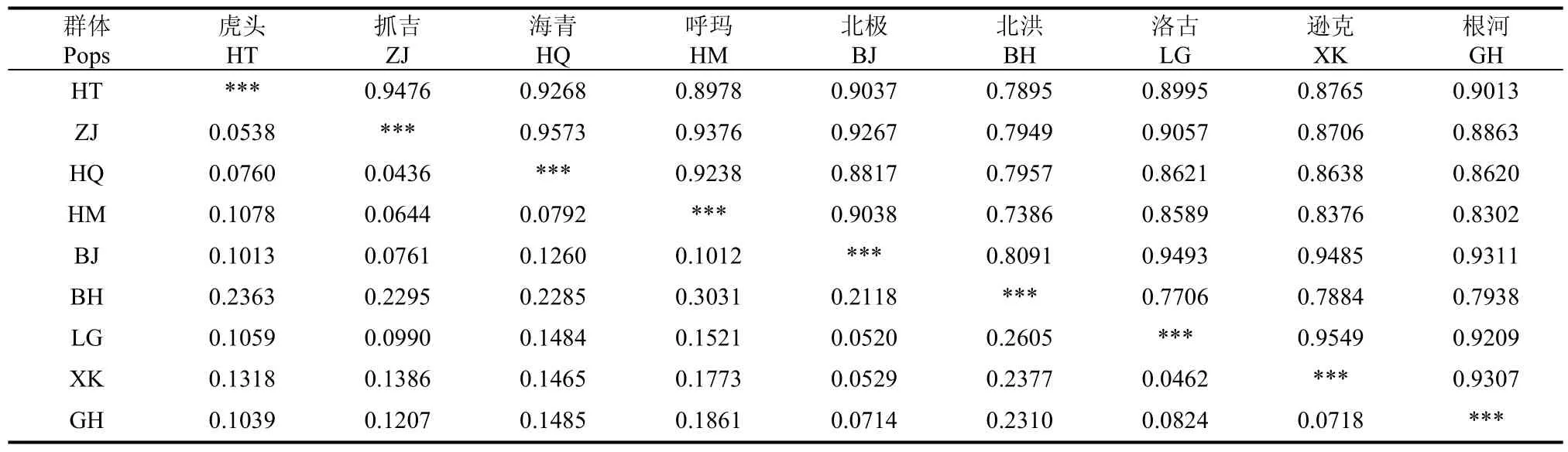
表6 群体间Nei氏遗传距离D(对角线下)和遗传相似系数S(对角线上)Tab. 6 Nei's genetic distance (under diagonal) and Genetic similarity coefficient(above diagonal) between all pairs of geographic populations
根据Nei氏遗传距离运用UPGMA法对9个哲罗鱼群体进行聚类分析, 见图2。从聚类图可以看出, 9个群体中, BJ群体独立为一支, HT、ZJ、HQ、HM为一大类, BH、GH、LG、XK聚为一类。
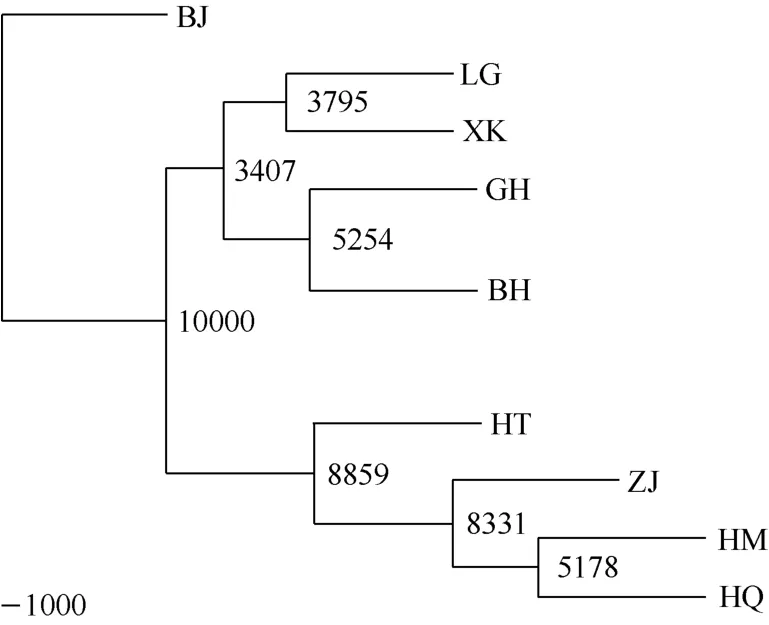
图2 9个哲罗鱼群体的UPGMA聚类图Fig. 2 Nine populations’ UPGMA dendrogram of Hucho taimen
3 讨 论
3.1 群体遗传多样性
种群遗传多样性是衡量某个物种资源量的一个重要依据, 也是生命进化和适应环境的基础。有效等位基因Ne、观测杂合度Ho、期望杂合度He、多态信息含量PIC等都是反映群体遗传多样性的度量, 其数值越大, 表示遗传多样性越高, 基因丰富度越高 (Robin, 2006)。期望杂合度He也称为基因多样度, 一般情况下都采用它作为度量群体遗传变异的一个最适参数。期望杂合度大小近似的反映出遗传结构变异程度的高低 (Jurg, 2001), 而且很重要的一点是在样本量较小的情况下, 实验中观测到的每位点等位基因数、平均等位基因数及基因丰富度指数均会受到一定程度的影响, 但一般情况下却和期望杂合度无明显相关性 (Yan & Zhang, 2004)。哲罗鱼由于野生种群数量少, 处于濒危状态,样本采集困难, 因而必须在小样本量的情况下获得足够多的遗传数据, 因而在本实验中期望杂合度在反映群体遗传结构变异上具有非常重要的参考价值。本实验中观测杂合度Ho在0.3818~0.6658,期望杂合度He在0.3467~0.6411, 处于中等偏低的水平。9个群体中, HM群体的期望杂合度较低, 这可能是由于HM群体位于黑龙江上游支流呼玛河中,与其他黑龙江流域群体的基因交流相对较少。Hardy-Weinberg 检验的结果显示每个群体都有部分位点偏离平衡。近年来哲罗鱼的资源量下降, 野生群体数量较少, 群体内近交严重, 这很可能是造成位点偏离HW平衡的主要原因 (Antoro et al, 2006), 而对各群体同胞系检测的结果也印证了这一点。而对多态性PIC指数的检测也显示9个群体中HM群体遗传多样性偏低, 进一步说明了由于环境恶化及过度捕捞导致呼玛河哲罗鱼资源量严重下降, 特别是繁殖群体数量减少(Hong, 2003; Wright, 1978)造成了严重的近交行为, 从而导致其遗传多样性较低。而呼玛河作为完全在我国境内的河流, 其野生哲罗鱼群体无法像其他黑龙江干流群体一样存在和俄罗斯境内群体的基因交流 (Yin et al, 2003), 因此有必要加强对其繁殖群体的保护以及和其它群体间的基因交流以防止过度的近交行为, 从而使群体的遗传多样性得到保护。
3.2 群体遗传分化与基因流
本研究显示群体间遗传变异占总变异的10.81%, 群体间遗传变异显著;PairwiseFst在0.0246~0.2333, 大部分在0.05~0.25,表明9个哲罗鱼群体间遗传分化程度属于较高的水平(Palstra et al, 2007), 这可能与哲罗鱼的产卵习性有关。哲罗鱼通常在一次繁殖时是一雄一雌繁殖 (Holcik et al, 1988), 容易造成不同江段的个体产生较为明显的遗传分化。而对基因流Nm的分析结果显示, 9个群体之间除HM群体与GH、BH这2个群体之间的Nm<1外, 其余Nm>l, 平均值为2.4405, 该值大于佟广香等 (Tong et al, 2009)研究黑龙江流域5个哲罗鱼群体所得的Nm值。理论上Nm <1时, 遗传漂变是群体间遗传分化的主要因素, 遗传漂变能够导致某些等位基因消失, 改变群体的遗传结构(Slatkin, 1987);Nm>l时, 基因流足以抵制遗传漂变的作用,同时防止群体分化(Plosky et al,1993)。 本实验研究的9个群体之间的基因交流大部分能够阻止遗传漂变引起的遗传分化, 但HM群体与GH、BH这三个群体之间基因交流较少, 遗传漂变已经成为遗传结构的主导因素, 需要引起足够重视, 加强该群体与其他野生群体间的基因交流。
3.3 遗传瓶颈和种质资源保护
有研究表明, 在短期内, 遗传瓶颈的发生可能只会导致基因丰富程度的下降, 但在今后较长的一段时期内却会导致杂合度的持续性降低。在经历过遗传瓶颈之后, 种群的增长程度决定了杂合度下降的程度( Nei et al, 1975)。从长期来看, 单次的遗传瓶颈(或建立者效应)对遗传多样性和遗传变异的影响不会太大, 但连续性的瓶颈效应却会造成遗传变异的增加和遗传多样性的降低(Clegg et al, 2002; Pruett & Winker, 2005)。如果此时种群的数量得不到恢复, 由于遗传漂变, 有可能是种群基因库中有益基因的迅速丢失而最终导致物种的灭绝。本研究显示哲罗鱼野生群体面临遗传瓶颈的风险, 而且群体之间的基因交流较低, 这与哲罗鱼的资源调查显示其资源量呈逐年下降的趋势是分不开的(Dong et al, 1998a)。Bottleneck的检测结果很可能是近期的有效群体(Ne)减少所带来的经历遗传瓶颈的风险(Cornuet & Luikart, 1996), 特别是近年来的资源调查显示, 在我国境内的内河中, 哲罗鱼的繁殖群体几乎消失, 黑龙江和乌苏里江干流中的个体多来自俄罗斯境内的支流 (Yin et al, 2003),而且本研究显示呼玛河作为我国境内为数不多的尚有哲罗鱼野生群体的内河, 其种群多样性较干流群体低, 如果不及时加以保护, 其哲罗鱼种群很可能也会面临消失的威胁。
Chesser (1991)的社会模型揭示出通过保护现有的繁殖群体来保持遗传血统的稳定性能够有效地维持遗传多样性。所以,在保护哲罗鱼的工作中,设立自然保护区, 保护好现有的产卵群体, 对维持其遗传基因库的丰富程度意义重大。但针对现在各野生群体间基因交流较少这一问题, 特别是对于呼玛河群体这样遗传丰富度较低的群体, 可以引入与其亲缘关系较远的群体进行交配以丰富其后代的遗传信息量(Clegg et al, 2002; Pruett & Winker, 2005), 从而弥补由于基因漂变导致的遗传信息的丢失。
本研究利用微卫星标记研究了9个野生哲罗鱼群体的遗传多样性和遗传结构, 显示了当前黑龙江流域和乌苏里江流域哲罗鱼群体遗传现状。这表明哲罗鱼较低的野生资源量致使哲罗鱼群体内近交现象严重, 导致其遗传多样性水平有降低的风险,各群体经历遗传瓶颈的风险增大。由于各群体间基因交流较少, 在对哲罗鱼种质资源进行保护时,不仅仅要通过设立保护区和人工放流等方式增加自然群体数量, 同时更需要人为地增加群体间的基因交流, 避免种群遗传多样性的下降和消减群体内部的近交压力, 以期能全面的保护和恢复哲罗鱼野生资源。
Antoro S, Na-Nakorn U, Koedprang W. 2006. Study of genetic diversity of orange-spotted grouper, Epinephelus coioides, from Thailand and Indonesia using microsatellite markers [J]. Mar Biotechnol,8(1): 1-10.
Bostein D, White R L, Sckolnick M, Davis RW.1980. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. Am J Hum Genet,32:317-331.
Cornuet JM, Luikart G. 1996. Description and power analysis of two tests for detecting recent population bottlenecks from allele frequency data [J]. Genetics,144(4): 2001-2014.
Chesser RK. 1991. Gene diversity and female philopatry [J]. Genetics,127:437-447.
Clegg SM, Degnan SM, Kikkawa J, Moritz C, Estoup A, Owens IP. 2002. Genetic consequences of sequential founder events by an island-colonizing bird [J]. Proc Natl Acad Sci USA,99:8127-8132.
Dong CZ, Li HM, Zhao CG. 1998a. Study on protective biology of precious Hucho taimen(pallas)Ⅰ: Distribution and Change [J]. Chn J Fish,11(1): 65-70. [董崇智,李怀明,赵春刚. 1998.哲罗鱼分布区域及其变化.水产学杂志,11(1):65-70.]
Dong CZ, Li HM, Zhao CG. 1998b. Study on the Protective Biology of Precious Hucho taimen Being in CriticallyⅡ: Properties of Hucho taimen and its Ecology Date [J]. Chn J Fish,11(2): 34-39. [董崇智,李怀明,赵春刚. 1998.哲罗鱼性状及生态学资料.水产学杂志,11(2): 34-39.]
Froufe E, Sefc K M, Alexandrino P, Weiss S. 2004. Isolation and characterization of brachymystax lenok microsatellite loci and cross-species amplification in hucho spp. and parahucho perryi [J]. Mol Ecol Notes,4(2): 150-152.
Holcik J, Hensel K, Nieslanik J, Skacel L. 1988. The Eurasian Huchen Hucho hucho : Largest Salmon of the World [M]. Hingham: Kluwer Academic Publishers.
Hong X. 2003. The distribution and change of taimen natural resources in Huma Nature Reserve [J]. Heilongjiang Fish, (2):97. [洪兴.2003.哲罗鱼在呼玛河自然保护区的分布及变化.黑龙江水产, (2):97.]
Jiang ZF, Tang FJ, Yin JS. 2004. The Population Structure and Growth Characteristics of Hucho taimen(Pallas)in the upper Reaches of Wusuli River [J]. J Northeast Univ,33(4), 53-55.[姜作发,唐富江,尹家胜. 2004.乌苏里江上游虎头江段哲罗鱼种群结构及生长特性.东北林业大学学报,33(4):53-55.]
Jurg O. 2001. Analysis of Human Genetic Linkage(revised edition) [M]. Baltimore: Johns Hopkins University Press.
Kuang YY, Tong GX, Yin JS, Liang LQ, Sun XW, Ma B. 2007. AFLP analysis of genetic diversity of Hucho taimen in Huma River [J]. J Fish Sci Chn,14(4): 615-621. [匡友谊,佟广香,尹家胜,梁利群,孙效文,马波. 2007.呼玛河哲罗鱼遗传多样性的AFLP分析.中国水产科学,14(4): 615-621.]
Konovalov DA, Manning C, Henshaw MT. 2004. Kingroup: A program for pedigree relationship reconstruction and kin group assignments using genetic markers [J]. Mol Ecol Notes,4(4): 779-782.
Li SZ, Dai DY, Zhang SY, Ma GZ, He ZW, Gao SD. 1966. Notes on a collection of fishes from north sinkiang, China [J]. Acta Zool Sin,18(1):41-56. [李思忠,戴定远,张世义,马桂珍,何振威,高顺典. 1966.新疆北部鱼类的调查.动物学报,18(1): 41-56.]
Le PQ, Chen YY .1998. The Endangered Species of Fishes in China [M]. Beijing: Science Press. [乐佩琦,陈宜瑜. 1988.中国濒危动物红皮书(鱼类).北京:科学出版社.]
Liang LQ, Chang YM, Dong CZ, Sun XW. 2004. Genetic analysis for Hucho taimen in Wusuli River with microsatellites [J]. J Fish Chn,28(3): 241-244( in Chinese with English abstract) [梁利群,常玉梅,董崇智,孙效文. 2004.微卫星DNA标记对乌苏里江哲罗鱼遗传多样性的分析.水产学报,28(3): 241-244.]
M Hatakeyama, T Watanabe, M Ikeda, M nakajima, H Kawamula, N Taniguchi. 2005. Isolation and characterization of microsatellite DNA loci for endangered fish, Japanese huchen (Hucho perryi) [J]. Mol Ecol Notes,5(4): 893-895.
Nei M, Maruyama T, Chakraborty R. 1975. The bottleneck effect and genetic variability in populations [J]. Evolution, 29:1-10.
Palstra FP, O'Connell MF, Ruzzante DE. 2007. Population structure and gene flow reversals in atlantic salmon (Salmo salar) over contemporary and long-term temporal scales: Effects of population size and life history [J]. Mol Ecol,16(21):4504-4522.
Plosky Y, Cahner A, Haberfeld A. 1993. DNA Fingerprint bands applied to linkage analysis with quantitative trait loci in chickens [J]. Ann Genet,24:105-110.
Pruett CL, Winker K. 2005. Northwestern song sparrow populations show genetic effects of sequential colonization [J]. Mol Ecol,14:1421-1434.
Ren ML, Guo Y, Zhang XS. 2002. Irtysh River fish and fisheries in China [M]. Urumqi: Xinjiang Science and Technology Health Press. [任慕莲,郭焱,张秀善. 2002.中国额尔齐斯河鱼类资源及渔业.乌鲁木齐:新疆科技卫生出版社.]
Robin SW. 2006. A bias correction for estimates of effective population size based on linkage disequilibrium at unlinked gene loci [J]. Conserv Genet,7(2): 167-184.
Slatkin M. 1987. Gene flow and the geographic structure of natural populations [J]. Science, 236:787-792.
Tong GX, Kuang YY, Yin JS. 2009. AFLP analysis of genetic diversity of taimen (Hucho taimen) in wild populations [J]. J Fish Sci Chn,16(6): 833-841. [佟广香,匡友谊,尹家胜.2009.野生哲罗鱼种质资源遗传多样性的AFLP分析.中国水产科学,16(6):833-841.]
Tong GX, Lu CY, Kuang YY. 2006a. Construction and identification on enriched microsatellite library from Hucho taimen Pallas genome [J]. J Fish Sci Chn,13(2), 181-186. [佟广香,鲁翠云,匡友谊. 2006.哲罗鱼基因组微卫星富集文库的构建与分析.中国水产科学,13(2): 181-186.]
Tong GX, Kuang YY, Yin JS. 2006b. Isolation of microsatellite DNA and analysis on genetic diversity of endangered fish, Hucho taimen (Pallas) [J]. Mol Ecol Notes,6(4): 1099-1101.
Waples, Robin SW, Chi Do. 2008. Ldne: a program for estimating effective population size from data on linkage disequilibrium [J]. Mol Ecol Res,8(4): 753-756.
Wright S. 1978. Evolution and the Genetics of Populations [M]. Chicago: The University of Chicago Press.
Yin JS, Xu W, Cao DC. 2003. Age structure, sex ratio and growth of the Taimen (Hucho taimen) in Wusuli River [J]. Acta Zool Sin,49(5): 687-692. [尹家胜,徐伟,曹顶臣. 2003.乌苏里江哲罗鲑的年龄结构性比和生长.动物学报,49(5), 687-692.]
Yan LN, Zhang DX. 2004. Effects of sample size on various genetic diversity measures in population genetic study with microsatellite DNA markers [J]. Acta Zool Sin,50(2): 279- 290. [闫路娜,张德兴. 2004.种群微卫星DNA分析中样本量对各种遗传多样性度量指标的影响.动物学报,50(2):279- 290.]
Zhang CL, Tong GX, Kuang YY, Zhang C, Yin JS. 2010. Applicability of Microsatellite DNA Markers to the Parental Identification of Hucho taimen (Pallas) [J]. Zool Res,31(4):395-400. [张春雷,佟广香,匡友谊,张超,尹家胜. 2010.哲罗鱼微卫星亲子鉴定的应用.动物学研究,31(4):395-400. ]
Analysis of genetic diversity on 9 wild stocks of Taimen (Hucho taimen) by microsatellite markers
LIU Bo1,2, KUANG You-Yi1, TONG Guang-Xiang1, YIN Jia-Sheng1,*
(1. Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, China
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China)
Taimen (Hucho taimen) is a native fish species in China and it is in the state of endangerment. To explain clearly the genetic diversity and genetic structure, 9 wild populations of taimen were investigated using 20 microsatellite markers. The results showed that their observed heterozygosity ranged from 0.0994 to 0.8882, the expected heterozygosity varied from 0.2005 to 0.8759, and the range of PIC index was from 0.3432 to 0.5261 while population from Huma River had low genetic diversity.Fst of matching group ranged from 0.0246 to 0.2333 (P<0.0001)andNm varied among 0.8216 to 9.9292, which indicated that the genetic differentiation was remarkable among populations.The half/full-sib family tests detected a proportion of half/full-sib family groups varying among 27.78% to 90.91%, showing a high inbred pressure and a risk of bottlenecks experienced by most groups. The AMOVA results showed that the globalFst was 0.1081; the clustering result showed that individuals from Beiji tributary of Heilongjiang River clustered as one clade, all individuals from Huma River and Wusuli River clustered as one clade and all individuals from the upper reaches of the Heilongjiang River clustered as another clade. All these results indicated that the decrease of taimen resource has affected the gene exchange among their populations. In order to achieve full protection of taimen germplasm resources, we should put an end to the destructive fishing for taimen and promotegene exchange among their populations.
Hucho taimen; Microsatellite; Genetic diversity; Genetic structure
Q959.499; Q347; Q31; Q16
A
0254-5853-(2011)06-0597-08
2011-06-17;接受日期:2011-10-17
公益性行业科研专项(201003055);中央级公益性科研院所基本科研业务费专项(2008HSYZX-SJ-08)
∗通讯作者(Corresponding author), E-mail: xwsc20@tom.com
10.3724/SP.J.1141.2011.06597
book=32,ebook=71
- Zoological Research的其它文章
- New details indicated by different stainings during conjugation of ciliated protozoa Paramecium
- Histological and immunocytochemical study of deferens ducts in the Chinese rat snake (Zaocys dhumnades)
- PTEN在小鼠卵细胞和早期胚胎发育中的功能研究
- A phylogeny of the Tylototriton asperrimus group (Caudata: Salamandridae) based on a mitochondrial study: suggestions for a taxonomic revision
- 云南新平哀牢山西黑冠长臂猿分布与群体数量
- 杭州湾及钱塘江河口水鸟群落组成、季节动态及种间相关性分析

