PTEN在小鼠卵细胞和早期胚胎发育中的功能研究
王喜宏, 和协超, 韩树标, 季维智, 郑 萍
(1. 中国科学院昆明动物研究所, 云南 昆明 650223; 2. 中国科学院研究生院, 北京 100049)
PTEN在小鼠卵细胞和早期胚胎发育中的功能研究
王喜宏1,2,*, 和协超1, 韩树标1, 季维智1, 郑 萍1
(1.中国科学院昆明动物研究所,云南 昆明650223; 2.中国科学院研究生院,北京100049)
PI3K/AKT信号通路在哺乳动物早期胚胎发育中起重要作用。抑癌基因PTEN是该通路中的负调节因子, 但PTEN在卵和早期胚胎中的表达、分布以及作用都还未见报道。本研究通过免疫荧光方法发现卵细胞及着床前胚胎都表达PTEN, 且具活性的PTEN主要分布在生发泡期(germinal vesical, GV)卵细胞的皮层部位以及致密桑椹胚的卵裂球表面。在培养基中添加低浓度的PTEN特异性抑制剂bpV(pic), GV期卵母细胞的成熟不受影响, 但着床前胚胎发育受到阻滞。该结果提示PTEN在小鼠着床前胚胎发育中可能起重要作用。
卵细胞; 着床前胚胎发育; PTEN; bpV
磷脂酰肌醇3-激酶(PI3K)家族参与多种信号通路, 调节细胞的多种功能。正常情况下, 由其活化而产生的类脂产物3,4,5-三磷酸磷脂酰肌醇PtdIns(3,4,5)P3(PIP3)作为第二信使结合并激活多种细胞内的靶蛋白, 形成一个信号级联复合物, 最终调节细胞的增殖、分化、存活和迁移等(Manning & Cantley, 2007)。PI3K/AKT信号通路保持正常的平衡状态是细胞维持正常生理活动的关键。PTEN是一种PtdIns(3,4,5)P3-磷酸酶, 它可以通过去磷酸化将PtdIns(3,4,5)P3转变为PtdIns(4,5)P2(PIP2), 从而负调节PI3K/AKT信号通路的稳态。PIP2也是一种重要的信号分子,可以与胞内或细胞膜上的许多蛋白质发生相互作用(McLaughlin & Murray,2005)。 PTEN的异常与多种肿瘤的发生、侵袭及转移密切相关(Keniry & Parsons, 2008)。因此,PTEN是重要的抑癌因子之一, 在调节细胞正常生长也有着举足轻重的作用。
对PI3K信号通路在生殖和发育中的功能研究则相对较少, 但已有证据表明PI3K对着床前胚胎发育具重要意义。敲除PI3K的p110b催化亚基会引发早期胚胎致死(Bi et al, 2002)。应用时差显微技术(time lapse microscopy)也发现早期胚胎中有持续的PtdIns(3,4,5)P3生成, 抑制 PtdIns(3,4,5)P3的产生可导致胚胎发育受阻, 说明PI3K/Akt通路对早期胚胎发育起调控作用(Halet et al, 2008)。在卵细胞中特异性敲除PTEN, 可使滤泡提前发育和过度激活, 从而产生卵巢早衰(Reddy et al, 2008);而在颗粒细胞中特异敲除PTEN则可以增加排卵率和产仔数并延长黄体寿命(Fan et al, 2008)。在小鼠初级卵泡中特异敲除PTEN不能影响卵母细胞成熟、排卵和产仔数(Jagarlamudi et al, 2009)。但是到目前为止, PTEN是否也在早期胚胎中表达并起一定的调控作用, 尚未见有关报道。我们利用免疫组化技术研究PTEN在小鼠卵和着床前胚胎中的分布, 并利用PTEN特异性抑制剂研究其在卵成熟及早期胚胎发育中的可能功能,其结果表明, PTEN在卵细胞和早期胚胎中持续表达, 对早期胚胎发育可能起调控作用, 但抑制PTEN对卵细胞的成熟没有显著作用。
1 材料和方法
1.1 小鼠卵和胚胎的获取和培养
健康、性成熟的ICR品系SPF (无特定病源)级小鼠购自昆明金殿动物中心。
超排方法:选择处于间情期和发情前期的雌性小鼠, 腹腔注射PMSG(5 IU), 间隔46~48 h后腹腔注射hCG(5 IU), 随即与雄鼠合笼, 翌日8:00 检查阴栓, 有阴道栓者认为已完成交配行为。
胚胎的获取和体外培养:取出输卵管和子宫, 用消化或者冲洗的方法获得胚胎, 在实体显微镜下检查受精胚胎的发育阶段。一细胞(两原核期)胚胎培养在KSOM培养基中, 培养条件为37 ℃, 5% CO2。
GV(生发泡)卵的获取:PMSG注射48 h后取出小鼠卵巢, 刺破卵泡获得质量好的COCs, 用机械吹吸的方法去除颗粒细胞。GV卵在KSOM培养中进行成熟培养, 培养条件同上。
培养中使用的PTEN抑制剂bpV(pic)购自Calbiochem(Cat:203705).
1.2 免疫组化
体内获取的不同发育阶段的胚胎用PBS洗两遍, 在3.7%中性多聚甲醛中固定15~20 min, 0.25% Triton-X100中透膜30 min, 1% BSA封闭至少1 h, 一抗4 ℃过夜, 二抗室温1 h, Hoechst染核。在激光共聚焦显微镜下进行观察。
使用的一抗购自恩晶公司, PTEN(Ab-380/382/ 383)Antibody(cat:E021056), PTEN(Phospho-Ser380/ Thr382/Thr383)Antibody(cat:E11056)。100×稀释。
1.3 统计分析
使用Excel软件卡方检验进行统计分析,P<0.05 定义为差异显著。
2 结 果
2.1 PTEN蛋白在卵细胞和早期胚胎中的表达和分布
我们首先利用PTEN(Ab-380/382/383)抗体检测了PTEN总蛋白在卵细胞和早期胚胎中的表达和定位, 继而利用PTEN(Phospho-Ser380/Thr382/Thr383)抗体检测了卵和胚胎中磷酸化的PTEN蛋白的表达和定位。这些位点上磷酸化的PTEN被认为是非活化形式(Salmena et al, 2008; Vazquez et al, 2001; Vazquez et al, 2000)。
对卵细胞及体内发育各阶段的胚胎进行总PTEN和磷酸化PTEN免疫荧光染色, 结果如图1(大写A-F为磷酸化PTEN, 小写a-f为PTEN总蛋白)。PTEN总蛋白在着床前各阶段胚胎(图1a-e)及卵细胞(图1f)中都有表达, 主要分布在细胞核及近细胞膜上。磷酸化PTEN在一细胞、二细胞、四细胞及囊胚阶段与PTEN总蛋白的分布基本一致, 但在致密化桑葚胚阶段, 两者呈现不同的分布:PTEN总蛋白同时分布在细胞核及卵裂球表面, 而磷酸化PTEN只分布在细胞核中。GV期卵细胞PTEN总蛋白和磷酸化PTEN也存在分布上的差异, 总蛋白分布在细胞核和近细胞膜上(图1f), 而磷酸化PTEN则分布在细胞核中(图1F)
2.2 PTEN在卵细胞成熟及早期胚胎发育中的作用
GV期卵细胞在成熟培养中, 加入不同浓度(0 µmol/L、 1 µmol/L、10 µmol/L)PTEN特异性抑制剂bpV, 观察对生发泡破裂(Germinal vesicle breakdown, GVBD)的影响, 结果显示,不加bpV(0 µmol/L)和加1 µmol/L、10 µmol/L bpV的GVBD率分别为86.4%和86.2%、84.6%, 无显著差异(P>0.05)。
取一细胞(两原核期)胚胎在KSOM中培养, 培养基中添加0 µmol/L(对照)、2.5 µmol/L、5 µmol/L以及10 µmol/L浓度梯度的bpV, 每天观察并记录各组胚胎发育的情况。我们发现bpV的添加显著抑制胚胎发育, 而且抑制的程度与浓度正相关。在浓度较低(2.5 µmol/L和5 µmol/L)时, 二细胞以后发育到每个阶段的胚胎数都有所下降, 经过卡方检验, 2.5 µmol/L 和5 µmol/L两组的四细胞、桑椹胚、 囊胚的发育率与对照组相比具都有显著差异(P<0.05)。在较高浓度(10 µmol/L)时没有胚胎可以发育到囊胚, 几乎所有胚胎的发育全部被抑制在二细胞时期(图2)。
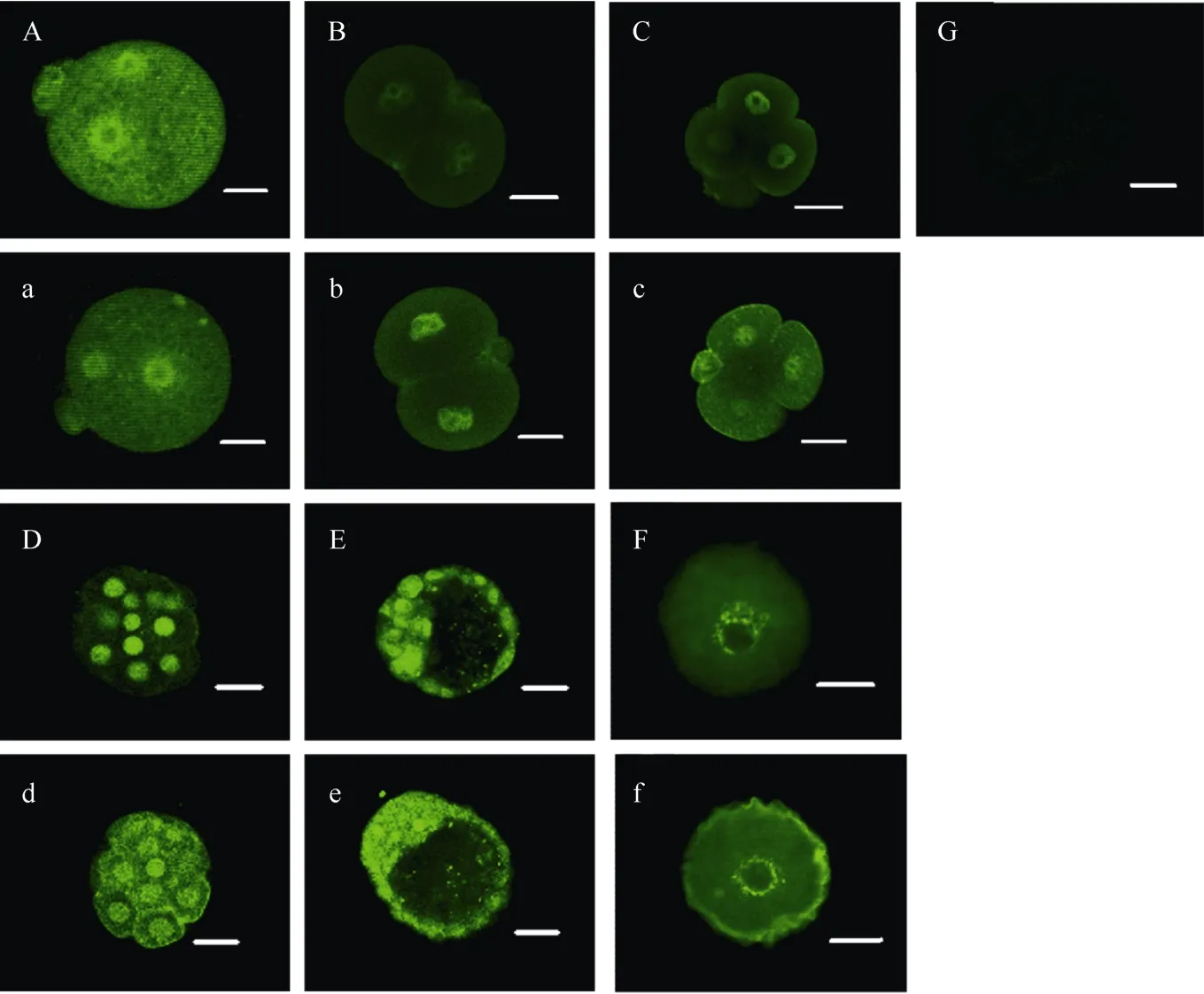
图1 胚胎发育各阶段以及GV卵的磷酸化PTEN和总PTEN的分布Fig. 1 Distribution of PTEN and phosphorylated-PTEN in pre-implantation embryos and GV oocytes
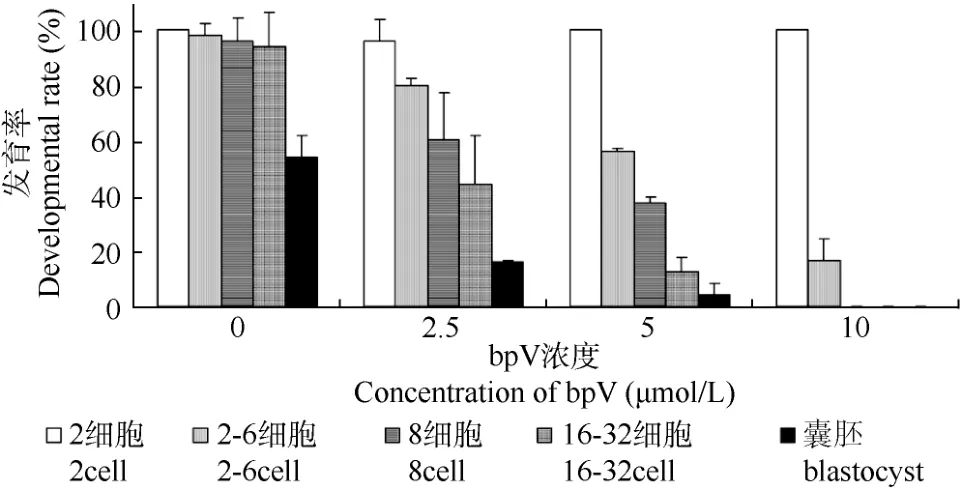
图2 PTEN抑制剂bpV(pic)处理对早期胚胎发育的影响Fig. 2 Effect of pbV(pic) treatment on the developmental competence of early embryos
3 讨 论
PI3K通路在小鼠胚胎发育中起重要作用, 在小鼠胚胎中, PI3K从一细胞胚胎到囊胚都持续表达并激活, PI3K和其磷酸化反应的产物PtdIns(3,4,5)P3都分布在细胞表面(Halet et al, 2008; Riley & Carayannopoulos, 2005)。敲除PI3K催化亚基或者抑制PI3K活性可引起早期胚胎致死(Bi et al, 2002; Halet et al, 2008)。PTEN是PtdIns(3,4,5)P3发生的负调控因子,所以在胚胎发育中很可能也有重要的作用。
我们的结果表明,PTEN在卵母细胞和早期胚胎发育中持续表达。利用PTEN特异性抑制剂bpV阻断PTEN的活性, 可显著影响早期胚胎发育潜能,其效果具剂量依赖性, 说明PTEN对早期胚胎发育具调控作用。PTEN总蛋白和磷酸化蛋白在桑葚胚阶段卵分布不一致,活化的PTEN主要分布在裂球表面。该结果暗示PTEN可能在桑葚胚阶段的致密化过程中起某种作用。低浓度的bpV并不能阻断卵泡的成熟, 这与前人基因敲除的研究结果一致:在小鼠在初级卵泡中敲除PTEN不能影响卵母细胞成熟(Jagarlamudi et al, 2009)。
本实验中使用的bpV最大浓度为10 µmol/L,本实验证明该浓度对于体细胞和卵细胞都没有毒性(Lai, 2007; Schmid et al, 2004; Li et al, 2010)。因此,在该浓度的bpV作用下观察到的表型应该是PTEN活性抑制后产生的真实作用, 而不是细胞毒性的副产物。当然, PTEN对胚胎发育的作用还需通过mRNA表达的定量研究, 以及PTEN基因表达的干扰, 如RNA干扰或者基因敲除手段进行更为确凿的验证。抑制PTEN的功能, 一方面可破坏PI3K/AKT通路的平衡, 使AKT过度激活;另一方面也可降低信使分子PIP2的生成。PTEN对胚胎发育调控的详细分子机制还需进一步的深入研究。
B i L, Okabe I, Bernard DJ, Nussbaum RL. 2002. Early embryonic lethality in mice deficient in the p110 catalytic subunit of PI 3-kinase[J]. Mamm Genome,13(3): 169-172.
Fan HY, Liu Z, Cahill N, Richards JAS. 2008. Targeted disruption of Pten in ovarian granulosa cells enhances ovulation and extends the life span of luteal cells[J]. Mol Endocrinol,:22(9): 2128-2140.
Halet G, Viard P, Carroll J. 2008. Constitutive PtdIns (3, 4, 5) P3 synthesis promotes the development and survival of early mammalian embryos[J]. Development,135(3): 425.
Jagarlamudi K, Liu L, Adhikari D, Reddy P, Idahl A, Ottander U, Lundin E, Liu K. 2009. Oocyte-specific deletion of Pten in mice reveals a stage-specific function of PTEN/PI3K signaling in oocytes in controlling follicular activation[J]. PLoS One,4(7): e6186.
Keniry M, Parsons R. 2008. The role of PTEN signaling perturbations in cancer and in targeted therapy[J]. Oncogene,27(41): 5477-5485.
Lai J. 2007. Phosphatase and tensin homologue deleted on chromosome ten (PTEN) as a molecular target in lung epithelial wound repair[J]. Br J Pharmacol,152(8): 1172-1184.
Li J, Kawamura K, Cheng Y, Liu S, Klein C, Duan EK, Hsueh AJW. 2010. Activation of dormant ovarian follicles to generate mature eggs[J]. Proc Natl Acad Sci USA,107(22): 10280.
Manning BD, Cantley LC. 2007. AKT/PKB signaling: navigatingdownstream[J]. Cell,129(7): 1261-1274.
McLaughlin S, Murray D. 2005. Plasma membrane phosphoinositide organization by protein electrostatics[J]. Nature,438(7068): 605-611.
Reddy P, Liu L, Adhikari D, Jagarlamudi K, Rajareddy S, Shen Y, Du C, Tang W, H m l inen T, Peng SL. 2008. Oocyte-specific deletion of Pten causes premature activation of the primordial follicle pool[J]. Science,319(5863): 611.
Riley JK, Carayannopoulos MO. 2005. The PI3K/Akt pathway is present and functional in the preimplantation mouse embryo[J]. Dev Biol,284(2): 377-386.
Salmena L, Carracedo A, Pandolfi PP. 2008. Tenets of PTEN tumor suppression[J]. Cell,133(3): 403-414.
Schmid AC, Byrne RD, Vilar R, Woscholski R. 2004. Bisperoxovanadium compounds are potent PTEN inhibitors[J]. FEBS lett,,566(1-3): 35-38.
Vazquez F, Grossman SR, Takahashi Y, Rokas MV, Nakamura N, Sellers WR. 2001. Phosphorylation of the PTEN tail acts as an inhibitory switch by preventing its recruitment into a protein complex[J]. J Biol Chem,276(52): 48627.
Vazquez F, Ramaswamy S, Nakamura N, Sellers WR. 2000. Phosphorylation of the PTEN tail regulates protein stability and function[J]. Mol Cell Biol,20(14): 5010.
Role of PTEN in mouse pre-implantation development
WANG Xi-Hong1,2,*, HE Xie-Chao1, HAN Shu-Biao1, JI Wei-Zhi1, ZHENG Ping1
(1. Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming 650223, China; 2. Graduate School of the Chinese Academy of Science, Beijing 100049, China)
The PI3K/Akt signal transduction pathway plays an important role in pre-implantation embryonic development. The tumor suppressor genePTENnegatively regulates the PI3K/Akt pathway. Although PI3K is constitutively activated during pre-implantation embryonic development, currently no evidence shows the presence and possible involvement of PTEN in early embryo development. We investigated the expression of PTEN protein in germinal vesicle (GV) stage oocytes as well as in pre-implantation embryos. The activated form of PTEN was distributed in the peripheral of GV oocytes and compact morula. Treatment of GV oocytes with PTEN inhibitor bpV(pic) did not affect the maturation of the oocyte, but significantly impaired embryonic development. Thus, our study suggests the necessary role of PTEN in pre-implantation embryonic development.
Oocyte; Pre-implantation embryonic development;PTEN; bpV
Q954.4; Q593.4; Q132.4
A
0254-5853-(2011)06-0647-04
10.3724/SP.J.1141.2011.06647
2011-06-16;接受日期:2011-08-15
∗通讯作者(Corresponding author),Tel/fax:+86-871-5198996, E-mail: wangxh06@post.kiz.ac.cn
- Zoological Research的其它文章
- New details indicated by different stainings during conjugation of ciliated protozoa Paramecium
- Histological and immunocytochemical study of deferens ducts in the Chinese rat snake (Zaocys dhumnades)
- A phylogeny of the Tylototriton asperrimus group (Caudata: Salamandridae) based on a mitochondrial study: suggestions for a taxonomic revision
- 云南新平哀牢山西黑冠长臂猿分布与群体数量
- 杭州湾及钱塘江河口水鸟群落组成、季节动态及种间相关性分析
- 上海市南汇东滩围垦后海岸带湿地冬春季水鸟生境选择

