海洋生物毒素研究新进展
邴 晖,高炳淼,于海鹏,胡远艳,朱晓鹏,长孙东亭,罗素兰
(海南大学材料与化工学院,海南大学热带生物资源教育部重点实验室,海南海口 570228)
海洋生物毒素研究新进展
邴 晖,高炳淼,于海鹏,胡远艳,朱晓鹏,长孙东亭,罗素兰
(海南大学材料与化工学院,海南大学热带生物资源教育部重点实验室,海南海口 570228)
海洋生物毒素以其毒性强,结构新颖,药理作用特殊,易合成等特点成为药理学和神经科学的有力工具和新药开发的新来源.本文根据海洋生物毒素的化学结构特征将其大致分为3类:即多肽类毒素,聚醚类毒素,生物碱类毒素等,并对其进行了综述,同时对海洋生物毒素的应用前景进行了展望.
海洋生物毒素;芋螺毒素;西加毒素;河豚毒素
海洋生物毒素是有毒海洋生物分泌的一类具有奇特结构和高活性的特殊代谢成分,其资源丰富,种类多,分布广,据估计有1 000多种,其中已确定结构的有几十种.目前,海洋生物毒素已成为国内外研究海洋药物的热点,但国际上开展海洋生物技术研究的历史并不长.随着社会的发展和人类对生物资源的影响不断增加以及陆生资源的日益匮乏等原因,各国都将目光投向了尚远未获得有效开发的海洋生物资源.向海洋要食物和要药物已成为21世纪人类社会赖以持续发展的重要因素和发达国家在高技术领域竞争的又一热点.我国在这一新兴领域的研究起步虽较晚,但相对来说,差距并不很大.因此,应当抓住当前大好的发展机遇,采取切实有效的具体措施,大规模、有组织、有计划地开发利用我国的海洋生物资源,以使我国在海洋生物高技术领域的激烈竞争中能够占有一席之地.多数海洋生物毒素均有较强的神经毒性,且可作用于各种离子通道,对神经系统起着重要作用,因而可成为药理学和神经科学研究的有力工具和新药开发的新来源.同时,由于人类的很多神经性疾病均与离子通道有关,因此海洋生物毒素还将有可能广泛适用于镇痛、抗癫痫及其他神经性疾病的治疗,因而它有望成为新型的海洋药物.
以下按化学结构将海洋生物毒素大致分为多肽类毒素、聚醚类毒素、生物碱类毒素等三大类,并分别作一概述,旨在为充分利用海洋生物毒素资源和开发新型的海洋生物药物提供一定线索.
1 多肽类毒素
海洋多肽类毒素是海洋生物毒素中毒性最强的毒素,它特异地作用于离子通道或分子受体的亚型,从而具有特定的生理活性,如镇痛、强心、降压、抗病毒、麻醉等.因此,海洋多肽类毒素已成为临床用药物的重要来源;同时,海洋多肽类毒素作为分子探针,也是神经科学上用于研究离子通道或分子受体亚型结构与功能的强大工具.比较有代表性的海洋多肽类毒素包括:芋螺毒素、海葵毒素、水母毒素等(见表1).
1.1 芋螺毒素芋螺毒素(conotoxin,CTX)主要是一类生活在热带海洋中的肉食性软体动物芋螺分泌的活性小肽,是其主要用来捕食和防御的武器,也用于与其他对手竞争或有其他生物学上的用途[7].芋螺毒素一般含有7~46个氨基酸,富含2对、3对或3对以上的二硫键,是迄今发现的最小核酸编码的动物神经毒素肽,也是二硫键密度最高的生物肽.目前,芋螺毒素的分类主要是根据高度保守的信号肽序列,将芋螺毒素分为A,M,O,P,S,T,I 7个超家族[9],再根据每个成员保守的半胱氨酸骨架,结合其药理学活性,将其进一步分为若干个家族.也可按照其作用靶位的不同,将其分为 α,μ,ω,κ,δ,ψ,σ,ρ,γ及加压素、惊厥剂和睡眠肽等.最近的研究数据显示,芋螺的种类可能被很大程度地低估了[10-11],所以,芋螺毒素肽的种类比预期的要多得多.由此,芋螺毒液被称为“海洋药物宝库”,是一种近乎无限的药物资源,因而备受世界药学界的关注[12].
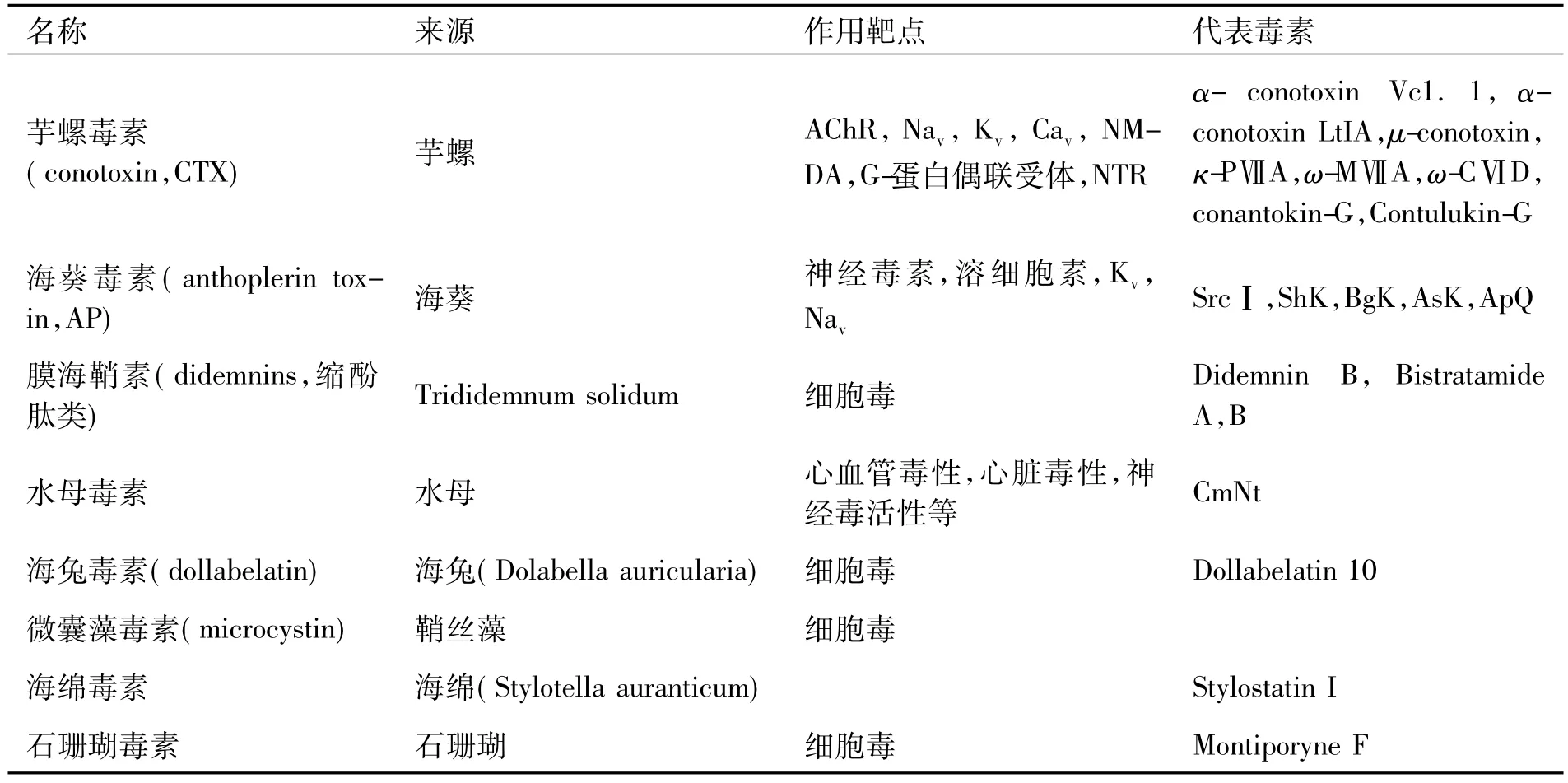
表1 多肽类海洋生物毒素[1-8]
目前,国内外已明确功能的芋螺毒素只占了整个毒素库的很小一部分,但是对它们的生理功能已经有了较为清晰的认识.芋螺毒素主要作用于细胞膜上的各种离子通道和神经递质及激肽的受体,具有高度的选择性和亲和力,可以作为神经科学中离子通道和膜受体研究的配体工具,同时还可以被直接开发成诊断和治疗的药物或作为新药先导化合物[13].芋螺毒素二硫键骨架和结构的不同,决定了它们功能靶位的差异,已经清楚的靶位主要包括配体门控的离子通道、电压门控的离子通道及G蛋白偶联的受体[14].
1)作用于配体门控离子通道的芋螺毒素主要有3个不同家族的毒素:即α-芋螺毒素、αA-芋螺毒素和ψ-芋螺毒素,可以选择性作用于乙酰胆碱受体(AChRs),前2种属于A超家族[15],ψ-芋螺毒素则属于M超家族[16].其中国内外研究最多的是α-芋螺毒素,其通常含有2对二硫键,可以选择性地抑制神经型或肌肉型nAChR,因此成为研究nAChR的理想工具.nAChRs属于配体门控离子通道,对诸如学习和记忆等神经生理过程起着至关重要的作用,而对于阿耳茨海默病、帕金森症以及精神分裂、癫痫、肌无力等病症的病理生理学研究和治疗,AChRs的意义则显得更为重要.另外,α-芋螺毒素能结合并阻断小细胞肺癌细胞表面的nAChR,这在小细胞肺癌的诊断和治疗中也有潜在的应用价值.
2)电压门控离子通道是多种生物毒素的作用靶标.越来越多的可与Na+,K+和Ca2+通道的成孔α-亚基相互作用的芋螺毒素家族被研究鉴定.已知有3个不同的芋螺毒素家族作用于电压门控离子通道,μ-CTX是Na+通道阻断剂、μO-CTX抑制Na+通道的电导率、δ-CTX延迟或抑制Na+通道的快速失活[17].其中μ-芋螺毒素的半胱氨酸模式与μO-芋螺毒素和δ-芋螺毒素的不同,前者属于M超家族[18],后两者属于O超家族[19].目前能够作用于钾离子通道的芋螺毒素不多,仅有κ(O-超家族)、κA(A-超家族)、κM(M-超家族)及I-超家族等4种超家族的芋螺毒素作用于钾离子通道[20].I-超家族芋螺毒素的成员复杂,序列趋异,为研究钾离子通道提供了丰富的材料,可作为探针用于分离和鉴别钾离子通道的各种亚型以及测定通道的生理、药理、生化、生物物理及结构特征,从而阐明各种钾离子通道亚型在生理过程中的重要作用,此外,它对于治疗高血压,心律不齐,哮喘有一定潜力[21].ω-CTX作用于Ca2+通道,它可阻断痛觉传递,因而具有镇痛效应.因其直接作用于钙通道,无需第二信使或者G蛋白,故不会引起药物依赖或成瘾,所以ω-芋螺毒素将极有潜力成为慢性重症疼痛的新一代药物.目前,毒素肽MⅦA(即Ziconotide)已经被化学合成并命名为Prialt,其具有很高的镇痛活性且不成瘾,主要用于艾滋病和癌症晚期的镇痛,具有神经保护的功能,已经作为一种治疗顽固性疼痛药物上市.
3)迄今被研究的以G-蛋白为靶标的芋螺毒素主要有2类:芋螺加压素和芋螺惰性素.如作为G蛋白偶联的血管加压素受体的激动剂conopressin,在芋螺捕食时分泌与血压调节相关的毒素来促进其他毒素的扩散并迅速发挥作用,在小鼠脑室注射后可引起与神经垂体激素相似的抓搔和梳理毛发等征状.G蛋白偶联的神经紧张素受体的激动剂contulakin,又称“sluggish”肽.其分子中有糖基化修饰,C端序列与神经紧张素有很高同源性,在小鼠脑室注射后可使脑区中与运动控制相关的功能受到障碍,引起懒散症状.
1.2 海葵毒素海葵毒素(Anthoplerin toxin,AP)是来自黄海海葵的一种神经毒素,它专一作用于可兴奋细胞膜电压依赖性钠离子通道,延长神经和肌肉的动作电位,抑制钠离子通道失活[22].这类毒素通常由27~59个氨基酸所组成,分子质量范围在3~7 kDa之内,大多数毒素的氨基酸序列中含有多个Cys残基,形成分子内二硫键.由于海葵毒素对不同的离子通道有高度的特异性和亲和性,因此,不仅可以作为一种研究离子通道结构和功能的工具,而且有望开发成为诊断和治疗与离子通道相关疾病的药理学试剂[23].按照海葵毒素结合离子通道类型的不同,目前可以将该类毒素大致分为Na+通道毒素和K+通道毒素两大类,以及结合其他类型离子通道的毒素.
1)作用于Na+通道的海葵毒素 海葵毒素专一作用于可兴奋细胞膜电压依赖性Na+通道,它可延长神经和肌肉的动作电位,抑制Na+通道失活,从而引起一系列相关的细胞调控活动.典型代表是来自黄海海葵的Ap-A和Ap-B(49个氨基酸残基组成,3对二硫键),具有强心肌收缩作用,其药效大大强于G-毒毛旋花苷,被认为是治疗心衰的极有潜力的药物[24-25],目前Ap类强心多肽正被开发用于充血性心力衰竭和肌无力的治疗.
2)作用于K+通道的海葵毒素 海葵毒素对K+通道具有高度选择性作用.来自海葵(Stichodactyla helianthus)毒液的多肽ShK对电压门控型K+通道Kv1.1和Kv1.3有高度亲和性,并能阻断K+通道作用,而其合成的衍生物ShK-Dap22对Kv1.3的亲和力是ShK的10倍[26].从海葵(Anemonia sulcata)中提取的海葵毒素BDS与AP-A和ATXⅡ具有25%的序列同源性,但它对心脏和骨骼肌细胞上的Na+通道却没有任何影响[27],却能特异地抑制 Kv3K+通道家族中的亚单位 Kv3.1、Kv3.2 和 Kv3.4[28].Kv3K+通道具有快速门控能力和高通量的性质,它广泛存在于很多中枢神经系统的组织中.研究表明Kv3K+通道与一些主要的中枢神经系统失调疾病,如帕金森氏症和阿耳茨海默氏症有关.
3)作用于其他离子通道类型的海葵毒素 海葵毒素APETx2是从海葵(Anthopleura elegantissima)中分离获得,分别与BDS和APETx1具有36%和64%的序列同源性[29].但APETx2并不阻碍K+通道,它主要作用于感觉神经元上与调节痛觉有关的酸敏感型离子通道(ASICs).APETx2通过与ASICs上部分亚基特异地结合,从而影响ASICs的功能.因此APETx2有望成为一种研究与ASICs通道相关的神经兴奋性和痛觉的重要工具[22].
1.3 水母毒素水母毒素是一类结构新颖独特的蛋白质,相对分子质量为10~600,主要分布于触手上的刺丝囊中,是目前所知的最毒的海洋生物毒素之一.该毒素成分复杂、不耐热、易氧化,因此,在很大程度上限制了对其分离、纯化及生物学活性等方面的研究.水母刺丝囊中所含的主要成分,除有毒的类蛋白毒素和多肽、酶类外,还有四氨铬物、强麻醉剂、组织胺、5-羟色胺等生物活性介质[30].这类毒素的生物活性主要包括心血管毒性、溶血性,神经毒活性、抗虫活性、心脏毒性、抗氧化性等.其中水母毒素的心血管毒性是目前研究最多和最为致命的,主要包括对心脏、血管的毒性和溶血活性.推测水母毒素对心血管的毒性是通过激活细胞膜上的L型钙通道,使其开放,从而导致细胞内钙增加,最终形成钙超载而导致心肌细胞溶解坏死[31].
我国是世界上较早研究开发和利用水母资源的国家,对水母类的研究主要是形态、分类和区系方面的基础研究工作,其他方面涉及较少.水母在食用及药用上是值得研究和开发的一类刺胞动物.目前,对水母毒素中的活性物质,如蛋白质多肽类毒素的研究和开发还较少.因此,在今后的研究中应重点研究水母毒素的分离纯化、多种活性物质和其作用机理等方面,进一步了解和掌握水母毒素的药用价值,以便更合理地应用于临床,为治疗人类的疑难杂症作出贡献.
2 聚醚类
海洋生物毒素的化学结构类型十分特殊,且各类毒素的化学结构差异极大,其中聚醚类毒素是近年来的研究中最突出的一种海洋毒素.聚醚类毒素是一类化学结构独特、毒性强烈并具有广泛药理作用的天然毒素,它对神经系统、消化系统、心血管系统等具有较高的选择作用.其中代表性的毒素有西加毒素、岩沙海葵毒素、刺尾鱼毒素等(见表2).

表2 聚醚类海洋生物毒素[32-39]
2.1 西加毒素西加毒素(Ciguatoxin,GTX)的名字来源于西加鱼类,是20世纪60年代由夏威夷大学教授Scgeuer首次从毒鱼中发现的.该毒素曾从400多种鱼中分离得到过,但其真正来源是由一种双鞭藻岗比毒甲藻(Gambierdiscus toxicus)产生的.GTX是一种脂溶性高醚类物质,毒性非常强,比河豚毒素强100倍[40].目前已发现3类GTX,即太平洋GTX(Pacific ciguatoxin)、加勒比海GTX(Caribbean ciguatoxin)和印度GTX(Indian ciguatoxin).
GTX是电压依赖性Na+通道的新型激动剂,与钠通道受体靶部位VI结合,能增加可兴奋细胞膜对Na+的通透性,产生强去极化,致使神经肌肉兴奋性传导发生改变,从而引起一系列药理学和毒理学作用[41].药理学研究表明,GTX对神经系统、消化系统及心血管系统均有重要作用,低剂量的GTX可引起神经及肠道症状,大剂量GTX能引起心肌收缩力增加.近几年有研究者提出,由于GTX是一种神经性毒素,它可以与躯体神经、自主神经的钠通道受体结合而产生作用,症状的慢性化和某些高敏感的患者在恢复期偶然的再发暗示着钠通道被永久的灭活[42].另外,GTX还可以作为研究可兴奋细胞膜结构与功能及局部麻醉药物作用收缩机制等分子机理的探讨途径.
2.2 岩沙海葵毒素岩沙海葵毒素(Palytoxin,PTX)分子式为C129H223N3O54,相对分子质量为2680.13,它是从岩沙海葵属的不同种海葵中分离得到的,对神经系统、心血管系统或细胞系统有极强的活性.皮摩尔级浓度的PTX分子即可损伤细胞,而且PTX的作用速度极快,动物从中毒到死亡的时间仅有3~5 min.PTX至今仍是已知结构的非蛋白类海洋生物毒素中毒性最强和结构最复杂的化学物质之一,并已从多种岩沙海葵中得到.
岩沙海葵毒素为最早开展研究的聚醚毒素,此类毒素既有神经毒性,又有细胞毒性.PTX能作用于心肌细胞的Na+-K+-ATP酶,能增加细胞对Na+、Ca2+的摄入量及K+的外流量,可将钠泵变成离子通道小孔,进而引发一系列的药理学和毒理学作用,如导致平滑肌、心肌及骨骼肌收缩,其作用强度比血管紧张素强100倍.研究证明,PTX具有显著的抗肿瘤活性,当注射0.84 ng·kg-1的剂量时,它能抑制艾氏腹水瘤细胞的生长,若增加剂量,则瘤体消失,从而使动物存活下来.聚醚类毒素在研制新型心血管药物和抗肿瘤药物中有着重要的作用.国外有报道,4-羟苯基乙酰胺-PTX被提议作为前体药,而PTX被作为癌症治疗的药物[43].除此之外,PTX还是一种新型的溶细胞素,它可在红细胞膜上形成小通道,从而导致细胞渗透性溶解.
3 生物碱类毒素
生物碱是一类含氮的有机化合物,海洋生物碱类毒素主要来源于天然海洋生物次级代谢成分,是一类含有胺型氮功能基和复杂的碳骨架环系结构的具有重要生物活性的碱性有机物.其结构新颖独特,生物活性广泛,如抗肿瘤、抗菌、抗病毒、抗心脑血管疾病、抗老年性痴呆和抗骨质疏松症等,因此,它们很有可能成为抗肿瘤、抗病毒和抗菌药物的先导化合物,有良好的药用前景.下面就河豚毒素和石房蛤毒素等几类海洋生物碱毒素的研究进行综述(见表3).
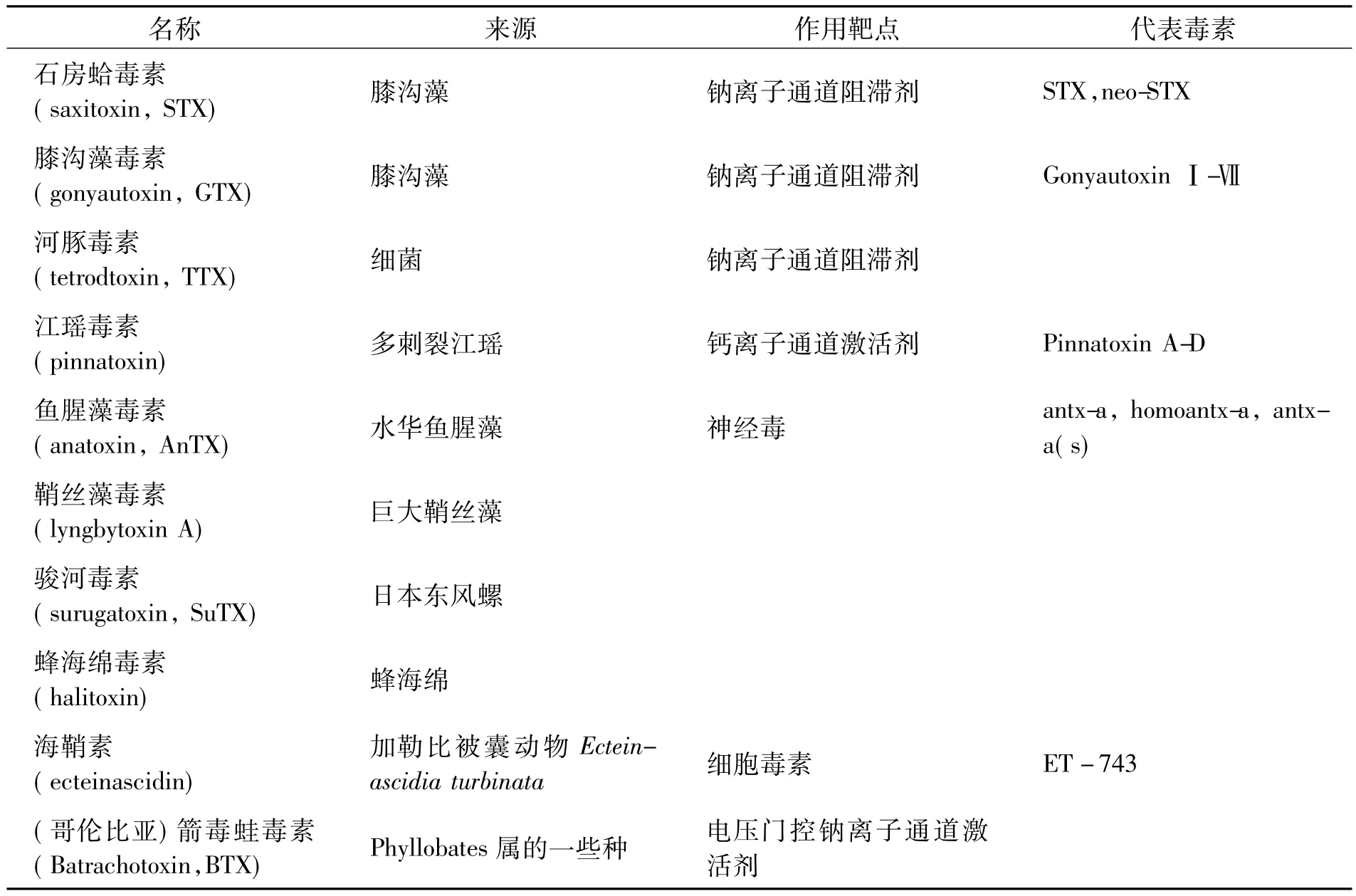
表3 生物碱类海洋生物毒素[44-47]
3.1 河豚毒素河豚毒素(Tetrodotoxin,TTX)是一种毒性很强、相对分子质量小的海洋生物碱类毒素,最初从豚科鱼中发现,故被命名为河豚毒素.近年来的研究表明,TTX是由细菌产生,经食物链作用传递到动物体内.其分子式为C11H17N3O8,相对分子质量为319.27,主要由3个氮原子组成,它们与氢氧原子形成特殊的结构.河豚毒素溶于水,但不溶于无水乙醇和普通有机溶剂,毒性为氰化物的1 000倍.
TTX是一种典型的钠离子通道阻滞剂,它主要通过与钠离子通道受体结合,阻断钠离子通道,从而使动作电位受阻,导致与其相关的生理活动的阻碍,主要是对神经和肌肉的麻痹.TTX对钠离子通道的阻滞具有选择性,它对神经细胞的钠离子通道的敏感性比对心肌和骨骼肌的钠离子通道的敏感性要高得多,且只阻滞可兴奋细胞膜的电压依赖性通道,而对静息电位、静息膜电位和延迟整复等作用不明显[48].
TTX对钠离子通道的阻滞作用,决定其具有一些特殊的药理学功能.TTX的麻醉作用比常用的麻醉药(可卡因)强16万倍,而且河豚毒素还具有对神经的选择性作用,因此,河豚毒素作为工具药用于生理学和药理学研究,其潜在的临床价值一直受到人们的关注,如TTX能抑制去甲肾上腺素的释放,可抗心律失常、预防肾功能衰竭及降低血压等.此外,由于TTX是通过攻击向大脑传导疼痛信号的神经细胞来起到镇痛作用的,所以它可取代化学药物和中草药来戒毒,且患者不会成瘾[49].加拿大科学家已将其应用于临床,效果比较显著.河豚毒素针剂可作为镇痛剂、镇静剂及镇痉剂等用于神经性患者的治疗;但是在临床上使用河豚毒素的剂量过大,会导致远端神经损害,甚至累及神经根、植物神经和中枢神经[50].由于河豚毒素的中毒剂量和治疗剂量很接近,很容易使人发生中毒,因此,为了避免河豚毒素在临床应用中产生全身毒性反应,目前已研制出河豚毒素微胶囊[51],把它分散地移植到坐骨神经的细胞膜下,既能起到局部麻醉的作用,又能降低它对神经系统的毒性.研发成功的河豚毒素微胶囊,可以使河豚毒素在临床上得到广泛的应用.
3.2 石房蛤毒素石房蛤毒素(Saxitoxin,STX)是一种强烈的非蛋白质毒素,因其最初是从巨石房蛤(Saxidomus giganteus)中分离得到的,故得此名.实际上,STX并非来源于蛤,而是存在于涡鞭毛纲腰鞭毛虫目(dinoflagllates)的链膝沟藻(Conyaulax catcnella)中[52].STX是四氢嘌呤的一个衍生物,其分子式为C10H17N7O4,相对分子质量为299,具有2个碱基.在酸性条件下其毒素稳定,而在较高的pH值中其毒性迅速消失.它是被首先确定的麻痹性贝毒(Paralytic Shellfish Poisoning,PSP)毒素成分,是在美国阿拉斯加的巨石房蛤中发现的浓度最高的一类PSP.石房蛤毒素可引起麻痹性贝类中毒,对人可造成致命性突发性中毒,致死量为 300 μg.
石房蛤毒素是钠离子通道的阻滞剂,可特异地阻断可兴奋膜上的电压依赖性钠离子通道,使钠离子内流受阻,动作电位被抑制.由此可以把STX作为分析动作电位分子基础的重要工具药.STX有较强的局麻作用,比普鲁卡因强10万倍[53],可开发成为一类新型的海洋药物局麻药.长期以来,STX为军事实验室所应用.据称,虽然它不能与大量分布的神经毒剂相比,但它作为一种毒弹装备却较为有价值.用来福枪射出STX到人体,其痛感与蚊子咬相仿,但不到15 min人即死亡,比细菌毒素所引起的死亡时间要短很多.STX是一种快速毒素,中毒后症状在0.25~4.00 h发作,它是强烈的胆碱酯酶抑制剂,对中枢神经和外神经均有强烈的作用;它对中枢的作用主要是对心血管和呼吸中枢的作用,它能妨碍离子的通透,从而扰乱神经-肌肉的传导.
4 海洋生物毒素的应用前景展望
21世纪被称为海洋的世纪,海洋更被誉为21世纪人类社会赖以生存和发展的另一个星球.进入21世纪,人类社会面临着日益严重的“人口剧增,资源匮乏,环境恶化”三大问题的严峻挑战.随着陆地资源的不断减少,开发海洋,向海洋索取食物和药物变得日益迫切和重要.因此,研究海洋生物毒素具有重要的理论价值和实际应用前景,一方面它可为神经生理学的研究和细胞调控分子机理提供了丰富的工具药,如特异作用于离子通道的生物活性物质大部分来自海洋生物毒素,包括芋螺毒素、河豚毒素和西加毒素等;另一方面它对攻克人类面临的重大疑难疾病具有重要的意义,如部分海洋生物毒素具有显著的抗癌、抗肿瘤、抗病毒活性,有的在镇痛方面具有良好的效果,并且无成瘾性,有些对调节血压有良好的开发潜力,此外,海洋生物毒素还可直接开发为天然药物,或作为先导化合物用于新药的研究.
海洋生物中的活性物质很多,有相当数量的结构已经确定的化合物尚未进行生理及药理方面的研究.到目前为止,所研究过的海洋生理活性物质还不到海洋生物总数的1%,对有毒海洋生物的研究所占比例更少.海洋是一个庞大而复杂的生物世界,其环境中的物质交换比陆地上要频繁,食物链也复杂,这势必造成海洋生物的化学成分(包括毒素)分布呈多元性,另一方面,这也反映了海洋药物的研究确实存在着困难,如含量极少、分离纯化和合成较难等;有些具有镇痛作用的毒素需脊髓鞘内埋植套管给药,给药途径复杂,如美国上市的芋螺毒素MⅦA.
然而,随着化学及现代生物学研究分析手段的不断更新,海洋活性物质越来越多地受到各个国家的重视,近年来,我国显著加强了对海洋资源开发利用的重视和资金投入,制定了《中国海洋21世纪议程》,并将海洋药物列为一个独立的专题和学科,同时,启动了以提供新药先导物为目的的海洋天然产物研究项目.当前,我国海洋生物毒素的研究与国际先进水平间的距离正在缩小,向海洋要食物、要药物已经从一句口号变成了现实,在全国范围,多方面的海洋生物资源的开发和利用为我国国民经济的持续健康发展注入了活力并做出了巨大的贡献.
[1]OLIVERA B M.ω-conotoxin MVIIA:from marine snail venom to analgesic drug[J].Drugs from the sea,2000:75 -85.
[2]MILJANICH G P.Ziconotide:neuronal calcium channel blocker for treating severe chronic pain[J].Curr.Med.Chem.,2004,11(23):3029 -3040.
[3]BARTON M E,WHITE H S.The effect of CGX-1007 and CI-1041,novel NMDA receptor antagonists,on kinding acquisition and expression[J].Epilepsy Res.,2004,59(1):1 -12.
[4]SANCHEZ-RODRIGUEZ J,TORRENS E,SEGURA-PUERTAS L,et al.Partial purification and characterization of a novel neurotoxin and three cytolysins from box jellyfish(Carybdea marsupialis)nematocyst venom[J].Arch Toxicol.,2006,80(3):163-168.
[5]LUESCH H,HARRIGAN G G,GOETZ G,et al.The cyanobacterial origin of potent anticancer agents originally isolated from sea hares[J].Current Medicinal Chemistry.,2002,9(20):1791 -1806.
[6]HONG B C,NIMJIE R Y,YANG C Y.The organocatalytic direct self-trimerization of acrolein:application to the total synthesis of montiporyne F[J].Tetrahedron Lett.,2007,48(7):1121 -1125.
[7]LUO S,AKONDI K B,ZHANGSUN D,Atypical α-conotoxin LtIA fromConus litteratustargets a novel microsite of the alpha3beta2 nicotinic receptor[J].J Biol Chem,2010,285(16):12355 -12366.
[8]FORNS P,PIRO J,CUEVAS C,et a1.Constrained derivatives of stylostatin 1.1.synthesis and biological evaluation as potential anticancer agents[J].J Med Chem,2003,18,46(26):5825 -5833.
[9]OLIVERA B M,TEICHERT R W.Diversity of the neurotoxicConus peptides[J].Molecular Interventions,2007,7(5):251 -260.
[10]DUDA T F Jr,KOHN A J,MATHENY A M.Cryptic species differentiated inConus ebraeus,a widespread tropical marine gastropod[J].Biological Bulletin,2009(217):292 -305.
[11]DUDA T F Jr,REMIGIO E A .Variation and evolution of toxin gene expression patterns of six closely related venomous marine snails[J].Molecular Ecology,2008(17):3018 - 3032.
[12]林秋金,罗素兰,长孙东亭,等.ω-芋螺毒素的研究进展[J].中国海洋药物,2005,24(4):41-48.
[13]罗素兰,张本,长孙东亭.芋螺毒素[J].生物学通报,2003,38(4):7 -8.
[14]TERLAU H,OLIVERA B M.Conus venoms:a rich source of novel ion channel-targeted peptides[J].Physiol Rev.,2004,84:41-68.
[15]陈伟华,王志强,韩禹宏.A-超家族芋螺毒素研究进展[J].生命科学,2006,18(4):373-379.
[16]袁多多,王春光.M-超家族芋螺毒素研究进展[J],生命科学,2006,18(5):502-506.
[17]马健会,李晖.μ-芋螺毒素—高特异性钠通道阻滞剂[J].生命的化学,2006,26(6):508-510.
[18]JIANG H,WANG C Z,XU C Q,et al.A novel M-superfamily conotoxin with a unique motif fromConus vexillum[J].Peptides,2006,27:682 -689.
[19]冯桂学,雒飞飞,戴秋云.钠通道芋螺毒素研究进展[J].军事医学科学院院刊,2007,31(6):564-567.
[20]黄丽君,王春光,戚正武.I-超家族芋螺毒素研究进展[J].生命科学究,2007,11(4):283-288.
[21]FERBER M,SPORNING A,JESERICH G,et al.A novel conus peptide ligand for K+channels[J].Biol Chem,2003,278(4):2177-2183.
[22]朱晓鹏,长孙东亭,罗素兰,海葵神经毒素研究进展[J].生物技术通报,2007,4:45-50
[23]KEM W R,PENNINGTON M W,NORTON R S.Perspectives in drug discovery and design[J].Journal of Computer-aided Molecular Design,1999,15/16:111 -129.
[24]DIAS-KADAMBI B L,COMBS K A,DRUM C L ,et al.The role of exposed tryptophan residues in the activity of the ecardiotonic polypeptide anthopleurin B[J].J.Biol.Chem.,1996,271(39):23828 -23835.
[25]WASSERSTROM J A,KELLY J E,LIBERTY K N.Modification of cardiac Na channels by anthopleurine-A:effects on gating and kinetics[J].Pflügers Arch,1993,424(1):15224.
[26]MIDDLETON R E,SANCHEZ M,LINDE A R,et al.Substitution of a single residue inStichodactyla helianthuspeptide,ShK-Dap22,reveals a novel pharmacological profile[J].Biochemistry,2003,42(46):13698 -13707.
[27]DIOCHOT S,SCHWEITZ H,BERESS L,et al.Sea anemone peptides with a specific blocking activity against the fast inactivating potassium channel Kv3.4 [J].J.Biol.Chem.,1998,273(12):6744 -6749.
[28]YEUNG S Y,THOMPSON D,WANG Z,et al.Modulation of Kv3 subfamily potassium currents by the sea anemone toxin BDS:significance for CNS and biophysical studies[J].J.Neurosci.,2005,25(38):8735 -8745.
[29]CHAGOT B,ESCOUBAS P,DIOCHOT S,et al.Solution structure of APETx2,a specific peptide inhibitor of ASIC3 protongated channels[J].Protein Sci.,2005,14(8):2003 -2010.
[30]陈琴,罗素兰,长孙东亭.水母毒素研究进展[J].生物技术,2007,6(95):95-98.
[31]KINTNER A H ,SEYMOUR J E,EDWARDS S L.Variation in lethality and effects of two Australian chirodropid jelly-fish venoms in fish[J].Toxicon ,2005 ,46(6):699 -708.
[32]CIMINIELLO P,DELL’AVERSANO C,LACOVO D,et al.Stereostructure and biological activity of 42-Hydroxy-palytoxin:A new palytoxin analogue from Hawaiian Palythoa subspecies[J].Chem.Res.Toxicol.,2009,22(11):1851 -1859.
[33]LOUZAO M C,ARES I R,CAGIDE E.Marine toxins and the cytoskeleton:a new view of palytoxin toxicity[J].FEBS Journal,2008,275(24):6067 -6074.
[34]LEHANE L,LEWIS R J.Ciguatera:recent advances but the risk remains[J].Food Microbiology,2000,61(223):91 -125.
[35]TAKAHASHI M,OHIZUMI Y,YASUMOTO T.Maitoxin,a calcium activator candidate[J].J Biol Chem,1982(257):7287-7289.
[36]李春媛,周玉,张磊,等.西加毒素的研究概况[J].上海海洋大学学报,2009,18(3):365-371.
[37]HUNGERFORD J M.Committee on natural toxins and food allergens marine and freshwater toxins[J].AOAC Int.,2005,1:299-313.
[38]PAZ B,DARANAS A H,NORTE M,et al.Yessotoxin,a group of marine polyether toxins:an overview[J].Mar Drugs.,2008,6(2):73-102.
[39]邢鸣鸾,陈加平,王晓峰,等.大田软海绵酸对人胚胎羊膜细胞FL凋亡的影响[J].水生生物学报,2007,4:607-609.
[40]ARENA P,LEVIN B,FLEMING L E,et al.Neuropsychologic effects in chronic ciguatera fish poisoning[J].Harmful Algae,2004,3(1):51-60.
[41]周玉,王哲.作用于钠通道受体的海产源神经毒素研究概况[J].动物医学进展,2005,26(5):36-40.
[42]DECHRAOUI M B,WACKSMAN J J,RAMSDELL J S,et al.Species selective resistance of cardiacmuscle voltage gated sodium channels:characterization of brevetoxin and ciguatoxin binding sites in rats and fish[J].Toxicon,2006,48(6):702 -712.
[43]刘凤云,李赏,周艳荣,等.海洋生物毒素的药物开发前景[J].生物技术通讯,2002,5(13):392-394.
[44]蔡俊鹏,程露,吴冰,等.鱼腥藻毒素及其检测、去除方法研究进展[J].水利渔业,2006,26(3):3-6.
[45]YUA C F,YUA PHF,CHANA P L,et al.Two novel species of tetrodotoxin-producing bacteria isolated from toxic marine puffer fishes[J].Toxicon,2004,44:641 - 647.
[46]FAYETTE J,COQUARD I R,ALBERTI L.ET-743:A novel agent with activity in soft tissue sarcomas[J].The Oncologist,2005,10(10):827 -832.
[47]D’INCALCI M,NEGRI I M,MASA V L,et al.A review of trabectedin(ET-743):a unique mechanism of action[J].Molecular Cancer Therapeutics,2010,9(8):2157 -2163.
[48]殷芹,刘岩,宫庆礼.河豚毒素的理论及应用研究进展[J].海洋通报,2008,6(27):95-100.
[49]黄军,严美姣,陈国宏.河豚毒素的起源及其研究进展[J].生物技术通讯,2006,6(17):998-1000.
[50]刘定华,张剑宇,韩伯军,等.急性河豚鱼中毒患者的神经电生理测定的特点及意义[J].中华急诊医学杂志,2004,1(13):49-51.
[51]MARTINOV V N,NJA A A.microcapsule technique for long-term conduction block of the sciatic nerve by tetrodotoxin[J].Journal of Neuroscience Methods,2005,141:199 -205.
[52]孙丹,袁宏球.石房蛤毒素的研究进展[J].安徽农业科学,2007,35(32):10204-10205.
[53]JARDIEU F,REYMOND M,HAMARD P,et al.Spatial distributions of expansion rate cell distributions of expansion rate,cell division rate on cell size in maize leaves:a synthesis of the effects of soil water status,evaporative demand and temperature[J].J EXP BOT.,2000,51:1505 -1514.
Research Progresses of Marine Biotoxins
BING Hui,GAO Bing-miao,YU Hai-peng,HU Yuan-yan,ZHU Xiao-peng,ZHANGSUN Dong-ting,LUO Su-lan
(Key Laboratory of Education Ministry for Tropical Biological Resources,Hainan University,Haikou 570228,China)
Because of strong toxicity,novel structure,specific pharmacological effects,some marine biotoxins have become powerful tools of pharmacology and neuroscience,and new medicine source.In the paper,several important toxins,such as peptides,polyethers and alkaloids,which are roughly classified according to their chemical structure were reviewed,and the application prospects of them were discussed.
marine biotoxins;conotoxin;ciguatoxin;tetrodtoxin
Q 946 < class="emphasis_bold">文献标志码:A
A
1004-1729(2011)01-0078-08
2010-11-05
国家自然科学基金(30860368);国家“863”计划(2007AA02Z114);重大新药创制国家科技重大专项课题(2009ZX09103-644)
邴晖(1985-),女,湖北武汉人,海南大学材料与化工学院2008级生物化工专业硕士研究生.
罗素兰,Tel:0898-66289538;E-mail:luosulan2003@163.com

