不成熟CD8α+ DC 经同种白血病抗原冲击后移植物抗白血病效应的体外研究*
徐 霖, 纳 宁, 陈 康, 曹开源, 袁广卿, 傅 强, 朱蓓莉
(中山大学中山医学院1 免疫学教研室3微生物学教研室,广东 广州510080;2中山大学附属第三医院肾移植科,广东 广州510630;4 东莞市卫生学校,广东 东莞523000)
移植物抗宿主病(graft-versus-host disease,GVHD)是同种异基因骨髓移植(allogeneic bone marrow transplantation,allo-BMT)最主要的并发症之一,在防治GVHD 的同时如何保留移植物抗白血病(graft-versus-leukemia,GVL)效应是目前临床上开展骨髓移植和治疗白血病需要解决的难题之一。研究表明某些特定亚群的树突状细胞(dendritic cells,DC)如淋巴系DC,如小鼠CD8α+DC 或人的浆细胞样DC,或者未成熟DC(immature dendritic cells,iDC)可以产生免疫耐受作用[1,2]。同时供者DC 也能提呈次要组织相容性抗原活化T 细胞,介导产生移植物抗白血病(graft-versus-leukemia,GVL)作用[1,3]。我们前期研究中探索和改进了不成熟CD8α+DC 的制备方法[4-6],体外和体内实验已证明其具有一定抑制GVHD 的作用,同时不增加白血病复发[2,7,8],但其GVL 作用仍有待进一步体外研究加以证实。因此本研究通过负载同种异基因白血病抗原的CD8α+DC 对同系T 细胞增殖、细胞因子分泌和杀伤等进行体外实验,观察不成熟CD8α+DC 是否能产生GVL 效应,为不成熟CD8α+DC 抗GVHD 并保留GVL 效应的机制和应用研究奠定基础。
材 料 和 方 法
1 DC 的培养[4-6]
不成熟CD8α+DC(CD8α+iDC)组:C57BL/6 小鼠(H-2b)骨髓细胞以4 ×109/L 的浓度种于6 孔板中,加入细胞因子GM-CSF 5 μg/L,IL-4 20 μg/L、SCF 100 μg/L、Flt3L 25 μg/L 诱导DC,37 ℃、5%CO2培养箱诱导2 d,于培养第3 d收获不成熟CD8α+DC 细胞。
成熟DC(mature DC,mDC)对照组[7,9]:按文献报道方法,C57BL/6 小鼠(H-2b)骨髓细胞以1 ×109/L 的浓度种于6 孔板,加入细胞因子GM-CSF 20 μg/L 和IL-4 10 μg/L,37 ℃、5%CO2培养箱培养诱导8 d。于培养第3 d,第5 d 换液,培养第7 d 加入细胞因子至终浓度为GM-CSF 10 μg/L和TNF-α 10 μg/L 继续诱导促DC 成熟。
2 EL9611 红白血病细胞全抗原的制备
EL9611 红白血病动物模型购自天津中国医学科学院血液学研究所,由丁顺利等[10]建立。传代采用每只BALB/c 鼠尾静脉注射经红细胞裂解液处理的患鼠脾细胞2 ×106个,接种后小鼠平均存活时间(14.5 ±2.1)d,发病晚期(约12 d 左右)计数外周血白细胞(white blood cell,WBC)数目[2,10]。当WBC >3.0 ×1010/L 时将动物拉颈处死,取脾细胞,计数,以1×1011/L 浓度重悬于PBS 中,置-80 ℃、37 ℃反复冻融5次,每次10 min。冻融后的细胞悬液用超声破碎仪以600 W超声10 min,间隔5 s 对样品中所含DNA 进行剪切,4 ℃12 000 r/min离心10 min,取上清用0.22 μm 的针头滤器过滤,-20 ℃保存。
3 抗原冲击与混合淋巴细胞反应(mixed lymphocyte reaction,MLR)[7,8]
CD8α+iDC 组和mDC 对照组均于培养最后1 d 加入蛋白含量终浓度为0 mg/L、2.5 mg/L、5 mg/L、10 mg/L、20 mg/L 经抽滤除菌的EL9611 红白血病(H-2d)全抗原进行冲击,继续培养36 h,使DC 细胞提呈抗原成分。
MLR 以DC 作为刺激细胞,同系T 细胞作为反应细胞。分组如下:实验组:每孔加2 ×105个反应细胞,按与反应细胞比例为1∶1、2∶1、4∶1(分别为2 ×105、4 ×105、8 ×105cells/well)加入经终浓度25 mg/L 丝裂霉素处理2h 的刺激细胞,每组设3 个平行孔;刺激细胞对照组:每孔加2 ×105、4 ×105、8 ×105个经丝裂霉素处理的刺激细胞,不加反应细胞,每组设3 个平行孔;反应细胞对照组:未加刺激细胞的2 ×105个反应细胞/well。空白组:每孔加100 μL 培养基。37 ℃、5%CO2培养3 d,采用MTT 法检测。各实验孔A 值为减去反应细胞对照孔A 值、刺激细胞对照孔A 值和培养基空白孔A 值后的A 值平均值。
4 MLR 培养上清中γ-干扰素(interferon-γ,IFN-γ)和白细胞介素-10(interleukin-10,IL-10)的检测
收集混合淋巴细胞培养上清,ELISA 法测定培养上清中IFN-γ 和IL-10 含量。试剂盒复温30 min 后,各孔分别加入倍比稀释的标准品、适度稀释的上清样品及阴性对照。每组设3 个平行孔,100 μL/well,37 ℃湿盒孵育2 h,洗涤5 次;加入生物素抗体工作液100 μL/well,37 ℃1 h,洗涤5 次后加入酶结合工作液100 μL/well,37 ℃30 min,洗涤后加显色剂100 μL/well,37 ℃显色15 min;加终止液后10 min 内于酶标仪上450 nm 波长处读A 值。结果计算:标准品孔A 值和样品孔A 值分别减去阴性对照孔A 值。标准曲线根据标准品的A 值和标准品细胞因子含量绘制;样品中细胞因子的含量通过标准曲线和标准曲线方程进行确定。
5 CD8α+iDC 诱导T 淋巴细胞的活化
Ag 冲击后的CD8α+iDC 经丝裂霉素C 处理2h,DMEM完全培养基洗涤3 次后,计数备用。取静置1 h 后去除巨噬细胞的C57BL/6(H-2b)的脾细胞,计数,备用。根据混合淋巴细胞反应(MLR)的结果,按CD8α+DC/T 1∶1 的比例,混合DC 和T 细胞后置于6 孔板中,37 ℃、5%CO2培养箱培养。培养第1 d、第3 d 加入终浓度为5 ×105U/L 重组小鼠IL-2维持T 细胞活性。以未加DC 刺激的C57BL/6 小鼠的T 细胞作为杀伤实验的阴性对照。
6 T 细胞杀伤实验
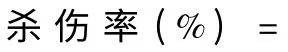
7 统计学处理
结 果
1 EL9611 抗原冲击CD8α+iDC 实验组刺激同系小鼠T 细胞增殖的情况
EL9611 抗原冲击后CD8α+iDC 刺激T 细胞增殖随CD8α+iDC/T 刺激比例增加而增强,1∶1、2∶1 和4∶1 各比例组刺激T 细胞增殖的作用呈梯度增加,各组间差别显著(P <0.05),见图1;在CD8α+iDC/T 比例为1∶1 组中,当抗原冲击浓度为2.5 mg/L 和5 mg/L 时刺激T 细胞增殖作用达到最大,且这2 种浓度之间无显著差别(P >0.05)。在CD8α+iDC/T 比例为2∶1 和4∶1 组中,当抗原冲击浓度为5 mg/L 时刺激T 细胞增殖的作用最强。不同比例组在抗原冲击浓度为20 mg/L 时,刺激T 细胞增殖的作用趋于平稳。以上结果显示低浓度抗原(≤5 mg/L)冲击CD8α+iDC 后刺激T 细胞增殖的作用较强,采用低浓度抗原冲击可能更有利于CD8α+iDC 的GVL 效应。
2 EL9611 抗原冲击mDC 对照组刺激同系小鼠T 细胞增殖的情况
EL9611 抗原冲击后mDC 刺激T 细胞增殖趋势与CD8α+iDC 组类似,随mDC/T 比例的增加,T 细胞的增殖能力增强,各比例组间的差别显著(P <0.05),见图2。各比例组均在抗原冲击浓度为20 mg/L 时显示最弱的刺激T 细胞增殖能力(P <0.05);其它各抗原冲击浓度组(0 mg/L、2. 5 mg/L、5 mg/L、10 mg/L)刺激T 细胞增殖的能力无显著差别(P >0.05),抗原浓度的变化对mDC 刺激T 细胞增殖能力的影响不明显。
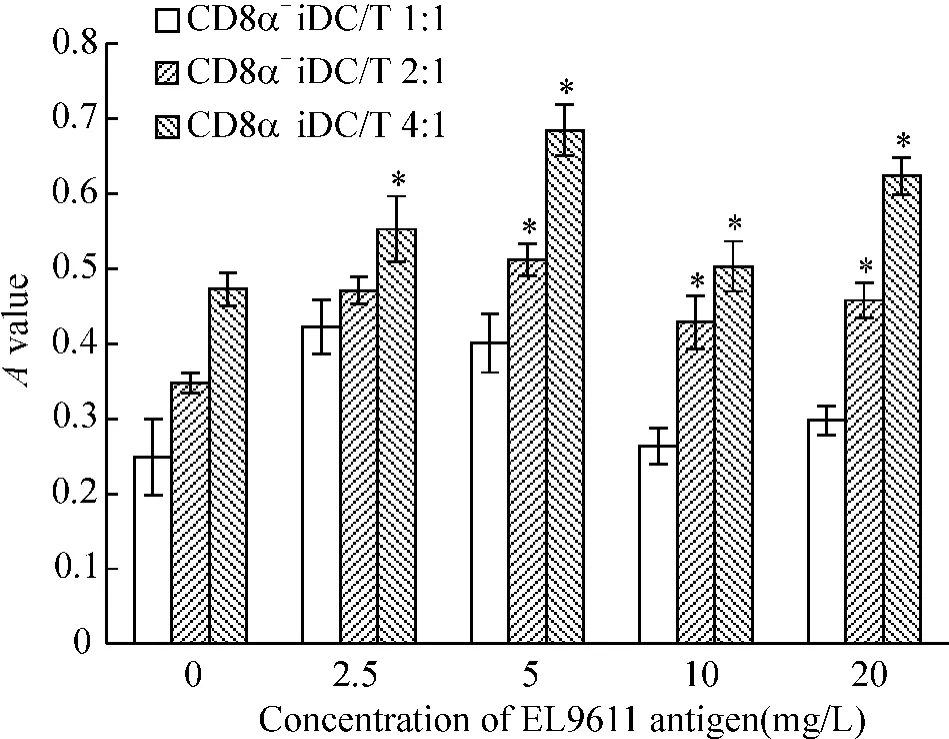
Figure 1. The proliferation of syngeneic T cells stimulated by EL9611 antigen-pulsed CD8α+iDC in DC/T ratio of 1∶1,2∶1 and 4∶1 groups. ±s.n =3. * P <0.05 vs CD8α+ iDC/T 1∶1 group.图1 EL9611 抗原冲击的CD8α+iDC/T 1∶1、2∶1 和4∶1 组刺激T 细胞增殖情况
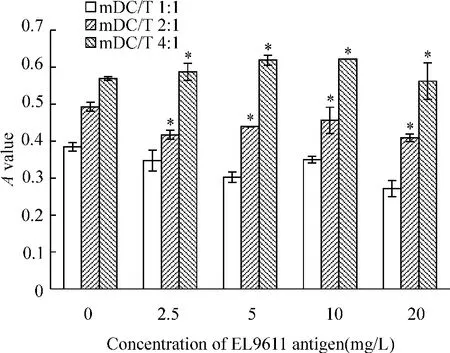
Figure 2. The proliferation of syngeneic T cells stimulated by EL9611 antigen-pulsed mDC in DC/T ratio of 1∶1,2∶1 and 4∶1 groups. ±s.n=3. * P <0.05 vs mDC/T 1∶1 group.图2 EL9611 抗原冲击的mDC/T 1∶1、2∶1 和4∶1 组刺激T细胞增殖情况
3 CD8α+iDC 与mDC 不同比例、不同浓度时对T 细胞刺激能力的比较
从图1、2 可以看出,CD8α+iDC 刺激T 细胞增殖能力与冲击抗原浓度有关,在抗原浓度2.5-5 mg/L 时达到最大,但mDC 未显示此趋势。未经EL9611 H-2d红白血病抗原冲击(即抗原冲击浓度为0 mg/L)时,在DC/T 的各比例组中CD8α+iDC 刺激T 细胞增殖的能力均低于mDC(P <0.05)。当抗原冲击浓度为2.5-5 mg/L 时,CD8α+iDC 刺激T 细胞增殖的能力各比例组中均高于mDC 对照组(P <0.05);当抗原冲击浓度为10 mg/L 时,CD8α+iDC 各比例组刺激T 细胞增殖的能力均弱于mDC(P <0.05);而当抗原冲击浓度进一步增加,达到20 mg/L 时,二者之间差别无显著(P >0.05)。结果进一步表明低浓度抗原冲击CD8α+iDC 刺激T 细胞增殖的效果较好。
4 EL9611 抗原冲击的CD8α+iDC 与T 细胞共培养后IFN-γ 和IL-10 的分泌情况
EL9611 抗原冲击的CD8α+iDC 与T 细胞共培养后,上清液细胞因子ELISA 检测结果显示,CD8α+iDC 经抗原冲击后DC 细胞本身释放一定量的IFN-γ 和IL-10,上清液中IFN-γ 含量为(28.9 ±4.5)ng/L,IL-10 含量为(45.5 ±11.0)ng/L。经与T 细胞共培养后,CD8α+iDC/T 不同比例组分泌IFN-γ 和IL-10 水平均明显增高,差别显著(P <0.05)。IL-10 的分泌在抗原冲击浓度为10 mg/L 时达最高值,与其它浓度组比较差别显著(P <0.05);而在抗原冲击浓度为2.5 mg/L 和5 mg/L 时在各比例组中均达最低值(P <0.05),见图3、4。IFN-γ 的分泌在抗原冲击浓度为2.5 mg/L 时浓度最高,而后显示出下降趋势,在1∶1 和2∶1 组当抗原浓度为5 mg/L 时分泌量最低(P <0.05)。结果提示,当冲击抗原浓度为低浓度时(≤5 mg/L)时,IFN-γ 的分泌量较高而IL-10较低,较低的抗原冲击浓度可能更有利于CD8α+iDC 与T 细胞共培养后发挥GVL 效应,结果与增殖实验一致。
综合细胞因子分泌和增殖反应的情况,我们发现,当抗原冲击为5 mg/L 时,IL-10 分泌最低,T 细胞增殖活性达最大值;当抗原冲击浓度为10 mg/L 时,IL-10 分泌最高,此时T 细胞增殖活性达最低,说明EL9611 抗原冲击后CD8α+iDC刺激T 细胞的增殖活性与IL-10 的含量密切相关,这也提示IL-10 的分泌与CD8α+iDC 发挥GVL 效应存在一定的负相关关系。
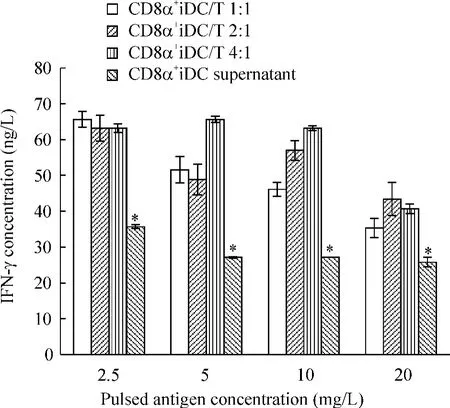
Figure 3. Secretion of IFN-γ by T cells stimulated by EL9611 antigen-pulsed CD8α+iDC. ±s. n =3. * P <0.05 vs CD8α+iDC/T 1∶1,2∶1 and 4∶1 groups.图3 EL9611 抗原冲击后CD8α+iDC 刺激T 细胞分泌IFN-γ 的情况

Figure 4. Secretion of IL-10 by T cells stimulated by EL9611 antigen-pulsed CD8α+iDC. ±s. n =3. * P <0.05 vs CD8α+iDC/T 1∶1,2∶1 and 4∶1 groups.图4 EL9611 抗原冲击后CD8α+iDC 刺激T 细胞分泌IL-10 的情况
5 EL9611 抗原冲击的CD8α+iDC 刺激同系T 细胞的杀伤活性
MLR 结果和细胞因子检测结果显示,EL9611 抗原冲击浓度≤5 mg/L,EL9611 抗原冲击CD8α+iDC/T 比例为1∶1 时,特异性T 细胞活化效果最佳,故以此条件作为杀伤实验的反应条件。
EL9611 靶细胞特异性杀伤实验结果显示,杀伤率随抗原冲击浓度的增加而增强,当冲击浓度为2.5 mg/L 时,杀伤率即可达90%,表现出较强的杀伤作用,表明CD8α+iDC 经同种异基因白血病抗原冲击后能够有效提呈白血病细胞的抗原成分,发挥GVL 效应,见图5。EL9611 抗原特异性T 细胞对BALB/c正常脾细胞的非特异性杀伤实验结果显示,白血病特异T 细胞对正常脾细胞不产生显著的杀伤作用,其杀伤率低于T 细胞阴性对照(未经CD8α+iDC 刺激的T 细胞,P <0.05),见图6,表明白血病特异性T 细胞在杀伤白血病细胞的同时对正常细胞不产生明显的杀伤作用,其杀伤为抗原特异性杀伤,在清除白血病细胞的同时不引起正常细胞的损伤。

Figure 5. Specific cytotoxicity of EL9611 antigen-specific T cells on EL9611 cells. ±s.n=3.图5 EL9611 抗原特异性T 细胞对EL9611 细胞的特异性杀伤实验
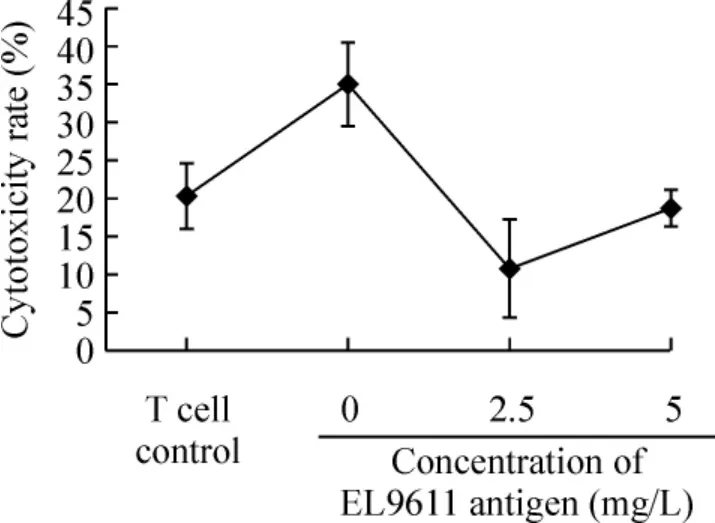
Figure 6. Non-specific cytotoxicity of EL9611 antigen-specific T cells on BALB/c splenocytes.. ±s.n=3.图6 EL9611 抗原特异性T 细胞对BALB/c 脾细胞的非特异性杀伤实验
讨 论
本课题组在前期研究中已通过GM-CSF+IL-4 +SCF+Flt3L 组合的方式成功制备出CD8α+iDC[4-6],体外实验表明其具有体外抑制同种MLR 的作用[7,8],体内实验发现同种异基因骨髓移植同时输注CD8α+iDC 可减轻GVHD 病理损伤,延长小鼠存活期,同时不增加白血病复发[2],推测CD8α+iDC 可能保留了部分GVL 效应。故本研究在不成熟CD8α+DC 抑制GVHD 作用机制体外研究的基础上[7,8],进一步探讨CD8α+iDC 体外是否能够产生一定的GVL 效应。
研究结果发现,冲击抗原浓度对CD8α+iDC 刺激T 细胞增殖的能力有较明显的影响,但mDC 刺激T 细胞增殖的能力较稳定,抗原浓度对其影响较小。未经同种异基因白血病抗原冲击之前,CD8α+iDC 刺激T 细胞增殖的作用明显弱于mDC 对照组,但经小剂量(≤5 mg/L)抗原冲击后其刺激T 细胞增殖的作用高于mDC。CD8α+iDC 刺激T 细胞增殖的能力随CD8α+iDC/T 刺激比例增加而增强,在CD8α+iDC/T 比例为1∶1 而抗原冲击浓度为2.5 mg/L、5 mg/L 时刺激T 细胞增殖的作用达到最大。因此,要最大限度地发挥CD8α+iDC抗GVHD 并保留GVL 效应时,低浓度抗原刺激将更有优势。
对CD8α+iDC 与T 细胞共培养的上清液进行细胞因子检测发现,当冲击抗原浓度为低浓度时(≤5mg/L)时,IFN-γ的分泌量较高而IL-10 较低,故较低的抗原冲击浓度可能更有利于CD8α+iDC 与T 细胞共培养后发挥GVL 效应。而综合细胞因子分泌和增殖反应结果后可以发现,上清中IL-10含量与CD8α+iDC 刺激T 细胞增殖的作用存在一定的负相关关系,提示IL-10 的分泌CD8α+mDC 抑制GVHD 并同时保留GVL 效应的平衡这一作用之间存在着密切的联系,体系中保持合适浓度的IL-10 有利于产生抗GVHD 并同时保留GVL 的效应。虽然受者EL9611 红白血病抗原冲击后的CD8α+iDC 和mDC 都能够刺激T 细胞增殖,但CD8α+iDC 由于能产生更多IL-10,能更好地发挥免疫调节作用,在GVHD防治中更具有应用价值。
杀伤实验结果表明,EL9611 白血病抗原冲击的CD8α+iDC 与T 细胞共培养,当冲击浓度为2.5 mg/L 时,T 细胞对EL9611 靶细胞的杀伤率即可达90%,表现出了较强的杀伤作用。刺激增殖后的T 细胞能有效发挥杀伤红白血病靶细胞的作用,同时不引起对正常细胞的非特异性杀伤,提示CD8α+iDC 在发挥GVL 的同时不会引起正常组织的损伤,杀伤作用具有抗原特异性。当抗原冲击浓度为0 即未用抗原冲击时,CD8α+iDC 即可刺激T 细胞产生杀伤作用,但这一作用是抗原非特异性的,从非特异性杀伤实验的结果可以得到验证。以上结果进一步证实CD8α+iDC 能够提呈同种异基因的EL9611 白血病细胞抗原并产生特异性GVL 效应。
综上所述,CD8α+iDC 可有效刺激抗原特异性T 细胞增殖并产生特异性杀伤效应,所具有的GVL 作用为CD8α+iDC在GVHD 防治中的进一步应用打下了良好的基础,使其有可能成为抗GVHD 同时保留GVL 作用的一种治疗手段,在同种异基因骨髓移植中显示出潜在的应用价值。
[1] Toubai T,Malter C,Tawara I,et al. Immunization with host-type CD8α+dendritic cells reduces experimental acute GVHD in an IL-10-dependent manner[J]. Blood,2010,115(3):724-735.
[2] Xu L,Duan LN,Cao KY,et al. Predominant immature CD8α+dendritic cells prevent graft-versus-host disease but do not increase the risk of leukemia recurrence[J].Eur J Haematol,2007,78(3):235-245.
[3] Xia G,Truitt RL,Johnson BD. Graft-versus-leukemia and graft-versus-host reactions after donor lymphocyte infusion are initiated by host-type antigen-presenting cells and regulated by regulatory T cells in early and long- term chimeras[J]. Biol Blood Marrow Transplant,2006,12(4):397-407.
[4] Na N,Xu L,Cao KY,et al. Optimal in vitro culture conditions for murine predominant immature CD8α+dendritic cells[J].Chin Med J (Engl),2009,122(3):344-348.
[5] 邓玉兰,彭延文,徐 霖,等. 不同级别小鼠来源的骨髓细胞对制备优势DC2 影响的研究[J]. 热带医学杂志,2009,9(2):54-57.
[6] 纳 宁,罗 云,洪良庆,等. 四种细胞因子组合从小鼠骨髓细胞体外诱导优势不成熟CD8α+DC[J].中山大学学报(医学科学版),2008,29(2):126-130.
[7] 陈 康,曹开源,徐 霖,等. 同种异型抗原冲击不成熟CD8α+DCs 抑制T 细胞增殖的体外实验[J]. 中国病理生理杂志,2010,26(11):2202-2206.
[8] 纳 宁,徐 霖,曹开源,等. 小鼠不成熟CD8α+树突状细胞的体外功能研究[J]. 中华器官移植杂志,2011,32(1):6-10.
[9] Basak SK,Haru IA,Stolina M,et al. Increased dendritic cell number and function following continuous in vivo in fusion of granulocyte macrophage-colony-stimulating factor and interleukin-4[J]. Blood,2002,99(8):2869-2879.
[10] 丁顺利,褚建新,赵钧铭,等. 可移植性BALB/c 小鼠红白血病模型的建立及其生物学特性[J].中华血液学杂志,1998,19(12):638-641.

