耐力训练对逆转大鼠实验性心肌肥厚的干预作用
任 绮
(华南师范大学体育科学学院,广东广州 510006)
耐力训练对逆转大鼠实验性心肌肥厚的干预作用
任 绮
(华南师范大学体育科学学院,广东广州 510006)
目的:探讨耐力训练对逆转大鼠实验性心肌肥厚的干预作用及其机制。方法:本实验通过注射异丙肾上腺素(ISO)造模,手术和假手术后大鼠随机分为四组:假手术安静组、假手术运动组、手术安静组和手术运动组。每天60min无负重游泳训练,每周6天,维持此运动量共4周。结果:训练能有效改善心脏肥厚程度(P<0.05或P<0.001)。假手术运动组的EF显著高于假手术安静组(P<0.05),手术安静组和手术运动组的EF显著降低(P<0.05),运动训练对E/A比值没有显著性影响(P>0.05)。假手术运动组心肌组织中CaN的活性显著高于假手术安静组(P<0.001),手术运动组CaN的活性显著低于手术安静组(P<0.05)。手术运动组CaN蛋白表达显著低于手术安静组(P<0.001)。结论:耐力训练可以有效改善实验性肥厚组大鼠心脏的结构和功能,并逆转ISO引起的心肌肥厚,其机制可能与运动干预有助于减缓肌丝降解、调节心肌重塑相关酶CaN的活性有关。
运动训练;心肌肥厚;重塑
临床医学研究已经证实运动训练能够有效地干预心脏重塑,运动作为辅助治疗方式有助于提高患者的生活质量和维持康复疗效,但其内在机制尚未阐明[1]。本研究通过注射异丙肾上腺素(ISO)诱导心肌缺血性损伤,建立实验性心肌肥厚大鼠模型,探讨耐力训练对逆转实验性心肌肥厚的作用和可能机制。
1 材料
1.1 实验动物
由中山大学医学院实验动物中心提供的雄性清洁级Sprague-Dawley(SD)大鼠24只,体重191±10 g。自由饮食,国家标准啮齿动物常规饲料喂养。
1.2 药物与试剂
大鼠cTnI试剂盒由美国BPB BIOMEDICALS公司提供,钙调神经磷酸酶(CaN)测定试剂盒由南京建成生物工程研究所提供,钙调神经磷酸酶多克隆兔抗鼠抗体由武汉博士德公司提供,盐酸异丙肾上腺素注射液(批号:6E20006),由上海禾丰制药有限公司生产,其余试剂均为国产分析纯。
2 实验方法
2.1 分组与模型制备
参照修改ORENSTEIN等人的方法略作改良制备实验性肥厚心肌动物模型,经多普勒超声心动图检查证实实验性肥厚心肌动物模型建成,将造模成功的12只大鼠和正常对照组12只大鼠随机分为4组,每组6只。水深为大鼠体长的2倍,水温30±2℃,运动组每天进行无负重游泳训练15min,在一周内逐渐增加至每天60min无负重游泳训练,每周6天,维持此运动量共 4 周[2][3]。具体分组如下:
假手术安静组(A组):连续8天腹腔注射安慰剂(生理盐水)5ml/kg/天。常规饲养,不进行训练,第4周末24 h检测并取材。假手术运动组(B组):连续8天腹腔注射安慰剂(生理盐水)5ml/kg/天。注射后进行无负重游泳,60min/天,6天/周,共4周,第4周末运动训练后24 h检测并取材。手术安静组(C组):连续8天腹腔注射ISO 5mg/kg/天建立实验性心肌肥厚的动物模型。常规饲养,不训练,第4周末24 h检测并取材。手术运动组(D组):连续8天腹腔注射ISO 5mg/kg/天建立实验性心肌肥厚的动物模型。注射后进行无负重游泳,60min/天,6天/周,共4周,第4周末运动训练后24 h检测并取材。
2.2 动物处死方法及标本收集与处理
每组大鼠腹腔注射戊巴比妥钠(45mg/kg)麻醉,仰卧固定。心脏多普勒超声心动图检测结束后,消毒开腹并经腹后壁正中的腹主动脉抽血4mL,静置1小时后,2000 r/min离心15 min,取血清 -70℃保存。经断头处死大鼠,取出左心室心肌组织冻存。
2.3 检测指标及方法
2.3.1 心脏彩色多普勒超声心动图
参照Reboul等人的检测方法,每组大鼠腹腔注射戊巴比妥钠(45mg/Kg)麻醉,仰卧固定,取胸骨旁左心室长轴切面二尖瓣尖水平,凸阵扫描频率为9.0兆赫,在二维超声引导下取M超曲线。测量舒张末期室间隔厚度、舒张末期左心室直径、射血分数等形态学指标,各指标均在连续3个心动周期上测量后取其平均值[4]。
2.3.2 检测血清cTnI水平
外周血离心提取血清后-70℃冻存,采用Elisa方法,具体操作根据试剂盒要求检测,测定仪器为奥地利产TECAN SUNRISE酶标仪。测定仪器为奥地利产TECAN SUNRISE酶标仪。取出酶标板依照次序对应分别加入100μl标准品于空白微孔中,在标准品孔和样品孔中加入50μl的酶标记溶液;36±2℃孵育反应60 min印干板,每孔加入底物呈色剂A、B液各50μl,轻微混匀5秒;36±2℃下避光孵育反应15 min;每孔加入50μl终止液,轻微混匀30 s终止反应,于波长450 nm的酶标仪上读取各孔OD值,绘制标准曲线后计算对应浓度。
2.3.3 检测心肌组织钙调神经磷酸酶(CaN)蛋白表达
组织修材后常规脱水,石蜡包埋,切片。石蜡切片常规脱蜡后加入阻断内源性过氧化物酶,抗原热修复并滴加封闭用山羊血清工作液。加入1:200倍稀释的兔抗鼠CaN多克隆抗体,37℃在湿盒中孵育1 h。阴性对照:阴性染色加PBS作为对照。滴加适量的葡萄糖多聚过氧化物酶标记的二抗工作液,烤片12 h并无水乙醇脱水,二甲苯透明后中性树胶封片,光学显微镜下照相、观察及记录结果。蛋白阳性表达细胞的胞质呈棕黄色或棕褐色,细胞核蓝染为不表达。每张片随机取10个视野,测定染色阳性数并计算阳性细胞百分比。
2.3.4 检测心肌组织CaN活性
比色法测定心肌组织活性,操作按照试剂盒说明书进行。制成10%的组织匀浆取上清待测,采用比色法测定组织CaN活性。
2.4 统计学方法
应用SPSS 13.0统计软件包进行统计处理,数据以均数±标准差±SD)表示。首先进行方差齐性检验和方差分析,经Levene方差齐性检验,组间均数有显著差异则进一步做多重比较,多个样本均数的比较和样本均数间的多重比较采用单因素方差分析(One-Way ANOVA);两个变量之间相关性采用双变量相关分析,P<0.05为具有显著性水平。
3 实验结果
3.1 心脏彩色多普勒超声心动图
超声心动图的参数可以反映心脏的整体收缩功能和心脏肥厚程度。实验结果表明,药物组大鼠的心肌肥厚指标显著高于假手术组,训练能有效改善心脏肥厚程度(P<0.05或P<0.001)。B组的EF显著高于A组(P<0.05)。C组和D组的EF显著降低,具有组间差异(P<0.05),各组间E/A没有显著性差异(P >0.05)(见表1,图1)。
表1 彩色多普勒超声心动图若干指标的检测结果 ±SD,n=6)
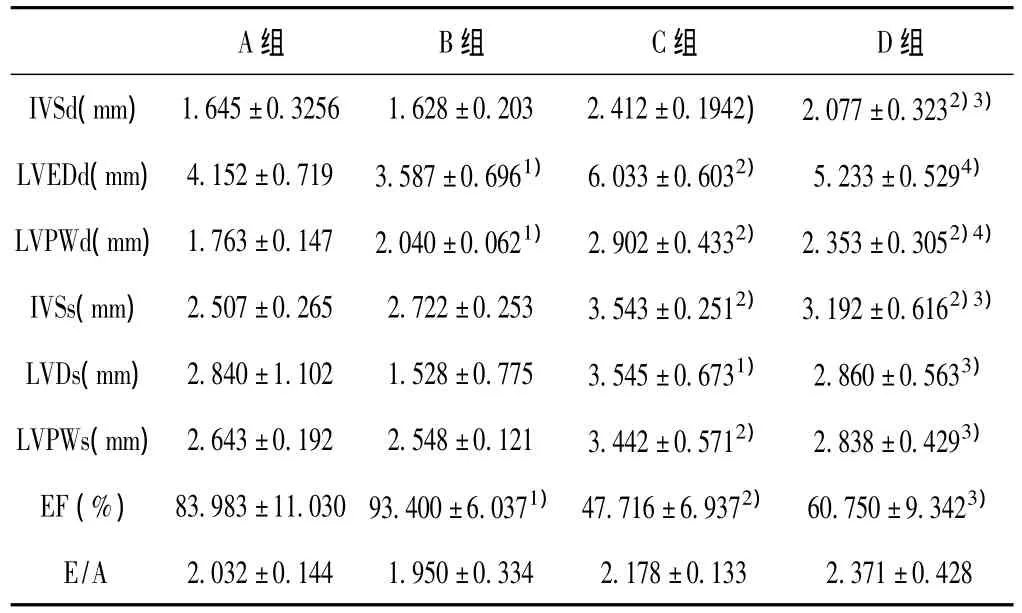
表1 彩色多普勒超声心动图若干指标的检测结果 ±SD,n=6)
注:1)表示与A组比,P<0.05;2)表示与A组比,P<0.001;3)表示与C组比,P<0.05;4)表示与 C组比。IVSd(室间隔舒张末期厚度);LVEDd(舒张末期左心室直径);LVPWd(舒张末期左心室后壁厚度);IVSs(收缩末期室间隔厚度);LVDs(收缩末期左心室直径);LVPWs(收缩末期左心室后壁厚度);EF(左心室射血分数);E/A(E峰A峰比值)
A组 B组 C组 D组IVSd(mm) 1.645±0.3256 1.628±0.203 2.412±0.1942) 2.077±0.3232)3)LVEDd(mm) 4.152±0.719 3.587±0.6961) 6.033±0.6032) 5.233±0.5294)LVPWd(mm)1.763±0.147 2.040±0.0621) 2.902±0.4332) 2.353±0.3052)4)IVSs(mm) 2.507±0.265 2.722±0.253 3.543±0.2512) 3.192±0.6162)3)LVDs(mm) 2.840±1.102 1.528±0.775 3.545±0.6731) 2.860±0.5633)LVPWs(mm) 2.643±0.192 2.548±0.121 3.442±0.5712) 2.838±0.4293)EF(%) 83.983±11.030 93.400±6.0371)47.716±6.9372) 60.750±9.3423)E/A 2.032±0.144 1.950±0.334 2.178±0.133 2.371±0.428
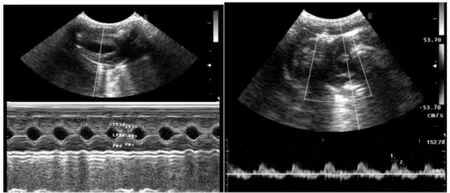
图1 多普勒超声心动仪检测大鼠心脏结构及功能,色多普勒血流脉冲频谱图检测心室功能及E峰/A峰的比值
3.2 血清cTnI水平
C组和D组的血清cTnI水平显著高于对照组。耐力训练后,D组大鼠的血清cTnI水平显著低于C组(P<0.05)(见表2)。
表2 耐力训练对各组大鼠血清cTnI水平的影响 ±SD,n=6)

表2 耐力训练对各组大鼠血清cTnI水平的影响 ±SD,n=6)
注:1)表示与A组比,P<0.001;2)表示与C组比,P<0.05。
A组 B组 C组 D组cTnI(ng/ml) 3.812±0.856 3.860±0.299 7.624±0.3371) 6.742±0.2431)2)
3.3 心肌组织中CaN活性和CaN蛋白表达
B组大鼠心肌组织中CaN的活性显著高于A组(P<0.001),D组的大鼠CaN的活性显著低于C组(P<0.05)。D组的大鼠心肌组织中CaN蛋白表达显著低于C组(P<0.001)(见表3,图2)。
表3 耐力训练对心肌组织中钙调神经磷酸酶(CaN)活性和CaN蛋白表达的影响±SD,n=6)

表3 耐力训练对心肌组织中钙调神经磷酸酶(CaN)活性和CaN蛋白表达的影响±SD,n=6)
注:1)表示与A组比,P<0.001;2)表示与C组比,P<0.05;3)表示与C比,P<0.001。
A组 B组 C组 D组CaN活性(umolPi/mgprot/hour)15.477±5.389 32.172±7.2481) 50.554±8.0321)42.295±11.4951)2)CaN蛋白表达 0.673±0.034 10.063±0.8411) 20.330±1.2081) 15.085±0.5301)3)
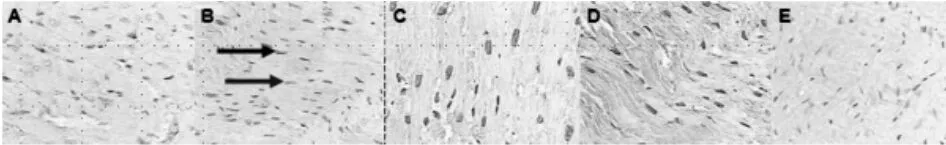
图2 心肌组织CaN蛋白表达
A:A组;B:B组;C:C组;D:D组;E:阴性对照。蛋白阳性表达细胞的胞质呈棕黄色或棕褐色(红色箭头),细胞核蓝染为不表达(蓝色箭头)。
4 分析与讨论
心血管疾病是危害人类健康的常见多发疾病,临床研究表明心脏重塑是导致心血管疾病发生率和死亡率显著升高的独立危险因素[5]。典型的运动性心脏肥大属于生理性肥大具有可复性,与病理性肥大具有不同的分子机制,目前已有不少文献证实了运动对促进心脏结构和功能具有积极的作用。在心脏康复医学领域,运动锻炼和体能活动干预等非药物治疗成为改善人体心血管功能状态,促进心脏的存活及功能恢复,提高生活质量及改善预后的有效治疗途径。本实验建立实验性心肌肥厚模型,观察耐力训练对心脏形态结构和生理功能指标的影响。在反映心脏功能的主要指标中常用射血分数评价心脏功能,射血分数是指心室收缩后的搏出量占心室舒张末期容积的百分比。本实验超声心电图结果表明,耐力训练促使心脏肥大的同时伴随心室射血功能增强。模型组的对比研究表明,耐力训练后手术组大鼠的EF显著升高,说明手术组大鼠的心室收缩功能及顺应性得到改善,提示耐力训练可以有效改善心脏射血功能下降;E/A比值变化不具有显著性,说明耐力训练对改善实验性损伤后的心脏舒张功能影响不大。D.A.BRENNER等人的研究证实12周中等强度耐力训练可以使成年大鼠的左心室功能增强、心室的顺应性上升,E/A峰比值虽然下降,但是并不具有显著性(P>0.05),与本研究的结果基本一致[6]。观察手术运动组大鼠左心室舒张末容量和直径的超声心动图结果,反映心脏肥厚程度的指标舒张末期左心室后壁厚度和舒张末期左心室直径显著改善,提示运动可以逆转心脏的结构重塑,心脏功能的改善与结构重塑有关联。
心脏损伤的检测与诊断是评定运动员身体机能和医务监督的重要方法之一[7]。检测心肌损伤的血清学标志物有多种,cTnI是检测心肌损伤的金标准,具有特异性和敏感性。正常情况下心肌细胞膜处于完整状态时血清cTnI浓度很低,cTnI不能透过细胞膜进入血液循环。在药物致心肌肥厚的形成和发展过程中,损伤心肌细胞的肌动蛋白降解并持续释放cT-nI。本研究结果显示手术组的血清cTnI显著高于对照组,而经过训练后的对照组cTnI水平下降,提示耐力训练干预可以减缓心肌进行性损伤的发展,减缓心肌肌钙蛋白降解。研究表明在心脏康复过程中外周血cTnI基因表达水平与心肌损伤程度呈平行关系[8]。模型组大鼠经过训练后心肌损伤程度减轻,可能是由于耐力训练促使心脏收缩功能和抗氧化系统产生良性反应,通过加速清除自由基,缓解缺血引起的心肌细胞内肌浆网对钙离子摄取功能抑制,阻止细胞内的钙超载,抑制肌钙蛋白的降解酶活性,减轻肌丝降解程度,从而减缓损伤加速机体的修复进程[9]。耐力训练作为清除自由基和拮抗钙离子的有效途径,可改善心脏的病理性重塑进程和提高心脏功能。
运动对细胞内钙离子浓度的影响导致肌丝对钙离子敏感性、收缩速度、肌丝横桥运动、僵硬度产生变化[10][11]。CaN 是受 Ca2+/钙调素(CaM)调节的丝氨酸/苏氨酸蛋白磷酸酶,研究已证明CaN是心肌肥大必需的诱导因子,与PKC、MAPK合称心脏重塑的三大信号转导途径[12]。本实验结果显示,假手术组大鼠进行耐力训练后心肌组织中CaN的活性显著升高,提示CaN参与耐力训练引起的心肌生理性肥大信号途径,手术组的CaN活性增强提示CaN也是病理性心脏重塑的调节机制之一。运动性心肌肥大具有可复性,不同于病理性心肌肥大,两者具有不同的分子机制,本研究结果提示CaN共同参与了生理性和病理性心脏重塑信号途径。耐力训练后手术组大鼠心肌组织中CaN的活性显著低于安静对照组,与免疫组化切片结果变化趋势相同,提示注射ISO引起心脏缺血性损伤使肌丝降解和心肌细胞重塑同时存在,cTnI降解可能是心肌细胞重塑的诱因之一,运动训练具有缓解cTnI降解的效应[13]。心肌肥大是多个信号转导途径相互作用诱发的复杂过程,必须经过不同的信号通路信息整合,共同决定逆转心脏重塑的效应,涉及心脏生理性和病理性肥大的CaN信号通路的上游及下游因子、CaN通路与PKC、MAPK信号途径的交互关系等具体机制有待进一步深入研究。
5 结论
5.1 中等强度耐力训练后手术组大鼠血清cTnI浓度、CaN的活性和蛋白表达显著变化,提示耐力训练干预心脏重塑逆转与cTnI、CaN等因素有关。
5.2 超声心动图结果提示,中等强度耐力训练能有效逆转手术组大鼠的心脏重塑和改善心功能,改善心肌重塑的发展进程,其机制可能与减缓心肌肌钙蛋白降解和调节CaN活性有关。
5.3 CaN信号通路共同参与心脏生理性肥大和病理性肥大的信号转导途径,但其内在交互关系和机制有待进一步深入研究。
[1]WISLOFF U,LOENNECHEN JP,CURRIE S,et al.Aerobic exercise reduces cardiomyocyte hypertrophy and increases contractility,Ca2+sensitivity and SERCA -2 in rat after myocardial infarction[J].Cardiovasc Res.,2002,54(1):162 -174
[2]JA NOSME SZA ROS,DANIEL KHANANSHVILI,GEORGE HART.Mechanisms underlying delayed afterdepolarizations in hypertrophied left ventricularmyocytes of rats[J].Am JPhysiol Heart Circ Physiol,2001,281(2):H903 - H914
[3] ORENSTEIN TL, PARKER TG, BUTANY JW, et al.Favorable left ventricular remodeling following largemyocardial infarction by exercise training.Effect on ventricular morphology and gene expression[J].JClin Invest.,1995,96(2):858-866
[4]REBOUL,C.,S.TANGUY,J.M.JUAN,etal.Cardiac remodeling and functional adaptations consecutive to altitude training in rats:implications for sea level aerobic performance[J].JAppl Physiol,2005,98(1):83 -92
[5]田振军.运动心脏生物学研究[M].北京:科学出版社,第一版,2006:106-107
[6]DANIEL A.BRENNER,CARL S.APSTEIN,KURT W.SAUPE.Exercise Training Attenuates Age-Associated Diastolic Dysfunction in Rats[J].Circulation,2001,104(2):221-226
[7]常芸.运动心脏的理论与实践[M].北京:人民体育出版社.第一版,2008:268-274
[8]姚登福,朱健华,吴玮等.人外周血心肌肌钙蛋白I基因表达水平与心肌损伤程度的关系[J].2004,8(30):6625-6627
[9]刘谦.心肌顿抑的相关研究进展[J].北京医学,2005,27(1):47-49
[10]PALMER,BRADLEY M.,ERIC A.MOKELKE,ANNEM.THAYER,et al.Mild renal hypertension alters run training effects on the frequency response of rat cardiomyocytemechanics[J].JAppl Physiol,2003,95(5):1799 – 1807
[11]PALMER,B.M.,J.M.LYNCH,S.M.SNYDER,et al.Renal hypertension prevents run training modification of cardiomyocyte diastolic Ca2+regulation inmale rats[J].J.Appl.Physiol.,2001,90(6):2063-2069
[12]MOLKENTIN JD,LU JR,ANTOSCL,et al.A calcineurin-dependent transcriptional pathway for cardiac hypertrophy[J].Cell,1998,93(2):215 – 228
[13]IEMITSUM,MAEDA S,MIYAUCHIT,etal.Gene expression profiling of exercise-induced cardiac hypertrophy in rats[J].Acta physiology Scandinavian,2005,185(4):259 -270.
Effect O f Moderate Exercise Training on the
Reversal O f Experimental Cardiac Hypertrophy Of Rats
REN Qi
(School of Physical Education And Sports Science,South China Normal University,Guangzhou 510006,China)
Purpose:The aim of this paper is to evaluate the effectofmoderate exercise training on the reversal of experimental cardiac hypertrophy and itsmechanism.Methods:amodel of experimental cardiac hypertrophy is used by injected isoproterenol(ISO).Rats were random ly assigned to 4 groups:sham-operation sedentary group,sham-operation exercise group,operation sedentary group and operation exercise group.The ratswere forced to swim 60 minutes,nothing attached to the tail,6 days perweek for4 weeks.Results:Exercise training can reverse the ventricular hypertrophy in the operation group(P <0.05 or P<0.001),EF of the sham -operation exercise group was higher than the sham -operation sedentary group(P<0.05),EF of the two operation groups decreased significantly(P <0.05),but there is no significant change of E/A(P >0.05).Exercise training can elevate the activation of CaN in sham-operation exercise group when compared with thatof the sham-operation sedentary group(P <0.001),the activation of CaN in operation exercise group was higher than that of the operation sedentary group(P <0.05).The expression of CaN protein in operation exercise group was lower than that of the operation sedentary group(P <0.001).Conclusion:It concludes that exercise training can modulate the cardiac structure and function induced by ISO.This study provided the evidence thatalleviating the degradation of cardiac troponin andmodulating activation of CaN are themajormechanisms in the reversal of cardiac remodeling.
Exercise Training;Myocyte Hypertrophy;Remodeling
G804.63
A
1007-323X(2011)03-0103-04
2011-04-20
任绮 (1974-),女,讲师,博士
研究方向:运动与心血管功能

