岩白菜素与DNA相互作用的光谱研究
刘 炜, 张琼梅
(1.海南师范大学 化学与化工学院,海南 海口571158 2.海南省热带药用植物化学重点实验室,海南 海口571158)
岩白菜素与DNA相互作用的光谱研究
刘 炜1,2, 张琼梅1
(1.海南师范大学 化学与化工学院,海南 海口571158 2.海南省热带药用植物化学重点实验室,海南 海口571158)
利用盐酸小檗碱为荧光探针,应用荧光光谱法、紫外光谱技术和粘度法研究了岩白菜素与DNA分子间的相互作用.研究结果表明:在pH为7.4的Tris-HCl缓冲溶液体系中,随着DNA浓度的增加,岩白菜素在215 nm处的紫外吸收峰发生红移和吸光度的降低,表明岩白菜素与DNA之间存在着嵌插作用.随着岩白菜素浓度的增加,BR-DNA体系发生荧光猝灭,其猝灭机制判断为静态猝灭;运用位点模型计算了25℃下岩白菜素与DNA的结合位点数和结合常数分别为0.9814和7.86×103L·mol-1.粘度实验进一步证明岩白菜素与DNA为嵌入结合.该结果为研究岩白菜素的抗癌机理提供了重要信息.
岩白菜素;DNA;荧光探针;荧光光谱;紫外光谱;相互作用
药物分子与DNA的相互作用会影响到DNA的生理和物理化学性质,改变DNA的转录和复制.在医药研究中DNA与靶向分子相互作用的研究不仅可以阐述一些抗肿瘤、抗病毒药物以及致癌物的作用机理,而且对进一步指导新型药物的设计合成的研究都具有重要意义[1].
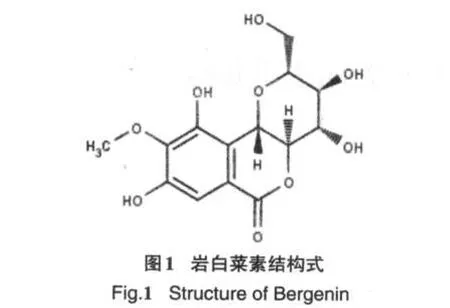
岩白菜素别名岩白菜内酯、矮茶素等(见图1),用于治疗慢性支气管炎,主要存在于虎耳草科植物岩白菜中,在海南龙脑香科植物青梅中亦可提取[2].有研究表明岩白菜素具有一定的抗癌和抗HIV病毒活性,但机理不明,目前尚未见有关其与DNA相互作用的研究报道.本文主要研究岩白菜素与DNA相互作用的机理,包括反应的结合常数、结合位点数以及结合方式等,为研究岩白菜素的抗癌机理提供重要信息.
1 实验部分
1.1 仪器与试剂
RF-5301荧光分光光度仪(Shimadzu公司);TU-1901双光束紫外可见分光光度计(上海普析通用);鲱鱼精DNA(sigma公司);岩白菜素标准品(中检所,溶于甲醇配制成1×10-3mol/L);盐酸小檗碱标准品(中检所,配制成1×10-3mol/L);三羟甲基氨基甲烷(0.1 mol/L).
其它所用试剂均为分析纯试剂,实验用水均为二次蒸馏水.
1.2 实验方法
在一系列10 mL比色管中,依次加入1 mLpH7.4的Tris-HCl缓冲溶液,0.2 mL的岩白菜素溶液和不同量的DNA溶液,再用二次蒸馏水稀释到刻度,摇匀,以相同浓度的DNA溶液为参比,进行紫外吸收光谱的测定.
在一系列10 mL比色管中,依次加入1 mL pH7.4的Tris-HCl缓冲溶液,0.2 mL的盐酸小檗碱溶液,0.2 mL的DNA溶液和不同量的岩白菜素溶液,再用二次蒸馏水稀释到刻度,摇匀,在荧光仪上进行荧光光谱测定.荧光激发波长选择358 nm,狭缝宽度均为5 nm.
2 结果与讨论
2.1 DNA对岩白菜素紫外可见吸收光谱的影响
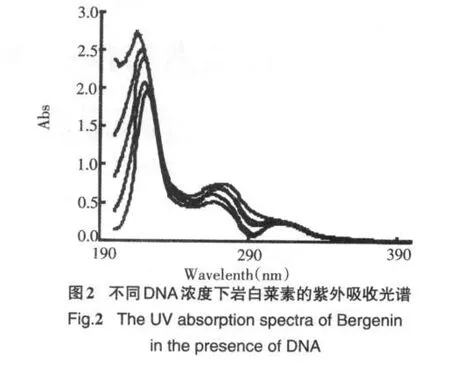
根据岩白菜素与DNA反应的紫外吸收谱图(见图2),随着DNA浓度的增大(图2,b→e∶1.36×10-4mol/L,2.04×10-4mol/L,2.72×10-4mol/L,3.4×10-4mol/L),岩白菜素(图2,a∶2×10-5mol/L)在215 nm处的紫外吸收峰发生了红移,同时在吸光度发生显著降低,由于药物在有DNA存在时出现减色效应、红移现象是该物质与DNA发生插入作用的标志[3],产生减色效应的原因是DNA碱基对与插入药物分子间发生π电子堆积,使后者π空轨道上也有一定的电子填充,从而使药物分子荷电跃迁(MLCT)的几率减小[4],因此岩白菜素是以嵌入式嵌入到DNA双螺旋的碱基对之间.
2.2 岩白菜素对BR-DNA体系的荧光光谱的影响
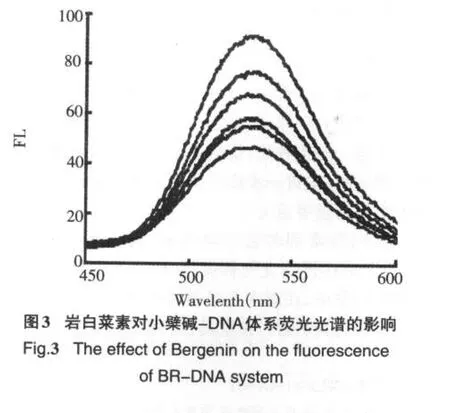
盐酸小檗碱(BR)可以专一性地插入DNA双螺旋的碱基对之间,使本身很弱的荧光得到显著性增强[5],当盐酸小檗碱从双螺旋中出来时,荧光又显著性降低,当体系中存在其他可与DNA发生作用的小分子时,该小分子可与小檗碱竞争与DNA的结合,将小檗碱从DNA双螺旋中挤出,导致体系荧光强度降低,而且体系荧光减弱的强度与小分子与DNA结合作用的强度存在一定的对应关系,因此可作为荧光探针研究DNA与小分子化合物的相互作用.由图3可知,随着岩白菜素(荧光强度很弱)浓度增大(图3,b→f∶2× 10-5mol/L,4×10-5mol/L,6×10-5mol/L,8×10-5mol/L,1×10-4mol/L),BR-DNA体系(图4,a;2×10-5mol/L BR+6.8×10-5mol/LDNA)荧光强度显著猝灭,说明岩白菜素与DNA发生了相互作用,影响了盐酸小檗碱与DNA分子的结合.
2.3 DNA对BR-DNA体系的荧光猝灭方式的判断及结合常数的计算
荧光猝灭可分为静态猝灭和动态猝灭2大类,根据猝灭Stern-Volumer方程
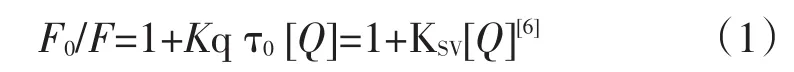
可计算出猝灭常数KSV=9446L·mol-1,相应的双分子猝灭过程速率常数Kq=9.45×1011 L·mol-1·S-1,远大于各类猝灭剂对生物大分子最大扩散碰撞猝灭速率常数(Kq=2.0×1010L·mol-1·s-1)[7],证明岩白菜素对BR-DNA体系的猝灭属于静态猝灭.
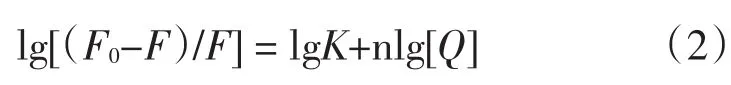
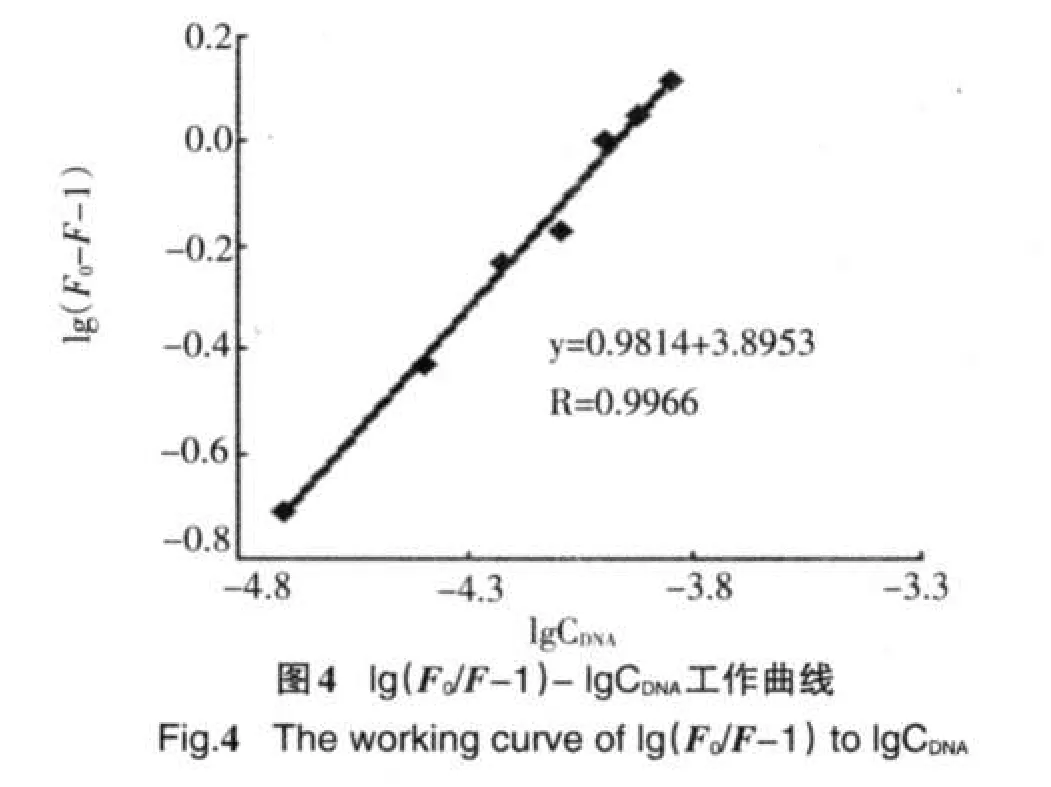
由静态猝灭而导致荧光体荧光强度减弱的过程,其初始荧光强度F0,加入猝灭剂后的荧光强度F、猝灭剂浓度[Q]、结合常数K及结合位点数n之间的关系式可表示如下[8]由lg[(F0-F)/F]对lg[Q]作图,见图4.由图4可得到25℃下岩白菜素与DNA的结合位点数及结合常数分别为0.9814和7.86×103L·mol-1.
2.4 粘度研究
粘度测定被认为是确定键合模式最有力的证据之一,当药物分子以嵌入的方式与DNA结合,DNA为容纳插入的分子双螺旋变长,粘度相应地增加[9].向固定浓度的DNA溶液中加入不同量的岩白菜素,测定其相对粘度,发现随着岩白菜素浓度的增大,DNA相对粘度逐渐增高,由此可知岩白菜素与DNA以嵌入方式结合,此结果与荧光、紫外光谱结果相吻合.
3 结论
用荧光法和紫外吸收光谱法以及粘度法研究了DNA与岩白菜素的相互作用,结果表明,DNA与岩白菜素之间存在较强的相互作用,25℃时结合常数为7.86×103L·mol-1,结合位点数为0.9814,结合方式是岩白菜素通过嵌入结合的方式与DNA结合,该结合方式可导致癌细胞DNA受到损伤从而不能复制.该研究为研究岩白菜素的抗癌机理提供了重要信息.
[1]Blackburn G M,Gait M J.Nucleic acids in chemistry and biology[M].New York,IRL Press,1990.
[2]陈光英,蔡宝华,吴晓鹏,等.HPLC法测定青梅茎皮中岩白菜素[J].中草药,2008,39(5):776-777.
[3]Kumar C V,Asuncion H E.DNA binding studies and site selective fluorescence sensitization of an anthryl probe[J].J Am Chem Soc,1993,115:8547-8553.
[4]Tysoe S A,Morgan R J,Baker T C,et al.Spectroscopic investigation of differential binding modes of Δ-and A-Ru(bpy)(2ppz)2+with calf thymus DNA[J].J Phys Chem 1993,97:1707-1711.
[5]贺吉香,江崇球,高明霞,等.盐酸小檗碱与脱氧核糖核酸相互作用的研究[J].光谱学与光谱分析,2003,23(4):755-758.
[6]Eftink M R,Ghiron C A.Anal Biochem,Fluorescence quenching studies with proteins[J].Anal Biochem,1981,114:199-227.
[7]Kandagal P B,Seetharamappa J,Shaikh S M T,et al.Bind⁃ing of trazodone hydrochloride with human serum albu⁃min:A spectroscopic study[J].J Photochem Photobiol A,2007,185:239-244.
[8]Kandagal P B,Ashoka S,Seetharamappa J,et al.Study of the interaction of an anticancer drug with human and bo⁃vine serum albumin:spectroscopic approach[J].J Pharma⁃ceutical and Biomedical Anal,2006,41:393-399.
[9]Palanisamy U M,Mallayan P.DNA binding and cleavage activity of[Ru(NH3)4(diimine)]Cl2complexes[J].Inor⁃ganica Chimica Acta,2004,357:901-912.
Study of the Interaction Between Bergenin and DNA
LIU Wei,ZHANG Qiongmei
(1.College of Chemistry and Chemical Engineering,Hainan Normal University,Haikou571158,China;2.Hainan Provincial Key Lab of Tropical Pharmaceutical Herb Chemistry,Haikou571158,China)
The interaction of Bergenin and DNA was studied using UV spectrometry,viscosity method and fluorescence spectroscopy with Berberine(BR)as the fluorescent probe.The results showed that at pH 7.4 Tris-HCl buffer solution,the increase of the concentration of DNA caused red shift of the absorption peak and the decrease of the absorbance at 215 nm of Bergenin,which proved that there existed intercalative reaction between Bergenin and DNA;the fluorescence intensity of BR-DNA system was quenched when Bergenin was added and the quenching mechanism was judged as a static quenching;the binding constant K and binding sites n were calculated as 7.86×103L·mol-1and 0.9814 respective⁃ly at 25℃.The viscosity experiment further proved that Bergen reacts with DNA in the mode of intercalative binding.The result can provide important information for the research of anticancer and anti-HIV mechanism of Bergenin.
Bergenin;DNA;fluorescent probe;fluorescence spectroscopy;UV spectrometry;interaction
O 657.32
A
1674-4942(2011)02-0177-03
2011-04-03
海南省有机化学重点学科开放基金项目(007);海南省教育厅项目(Hjkj2009-39)
毕和平

